Fármacos para el asma y otros trastornos pulmonares
Las vías aéreas que sirven de paso a los gases de entrada y de salida del cuerpo humano están en un flujo dinámico y constante. Es necesario un control minuto a minuto de la vía aérea para que llegue un suministro abundante de gases esenciales a los capilares pulmonares y para que el cuerpo se deshaga de algunos de sus productos de desecho más tóxicos. Cualquier restricción de este flujo dinámico, incluso por períodos breves, puede producir graves consecuencias. Este capítulo estudia los fármacos utilizados en la farmacoterapia de dos trastornos principalmente caracterizados por la bronco-constricción: el asma y la enfermedad pulmonar obstructiva crónica.
Conceptos clave
Los conceptos clave numerados proporcionan un breve resumen de los puntos importantes de cada uno de los apartados correspondientes dentro del capítulo. Si alguno de estos puntos no está claro, acuda al apartado correspondiente para su repaso.
La fisiología del aparato respiratorio implica dos procesos principales. La ventilación mueve el aire dentro y fuera de los pulmones, y la perfusión permite el intercambio gaseoso a través de los capilares.
Los bronquíolos están tapizados con músculo liso que controla la cantidad de aire que entra a los pulmones. La dilatación y la constricción de las vías aéreas están controladas por el sistema nervioso autónomo.
La inhalación es la vía de administración más común para los fármacos pulmonares, porque administra los fármacos directamente en el lugar de acción. Los nebulizadores, los IDM y los IPS son dispositivos utilizados para los tratamientos en aerosol.
El asma es una enfermedad crónica que tiene componentes inflamatorio y de broncoespasmo. Los fármacos se usan para prevenir los ataques de asma y para interrumpir un ataque que ya ha comenzado.
Los agonistas beta-adrenérgicos son los fármacos más eficaces para aliviar el broncoespasmo agudo. Estos agentes actúan activando los receptores beta2 del músculo liso bronquial para producir broncodilatación.
El anticolinérgico ipratropio es un broncodilatador que se usa ocasionalmente como alternativa a los betaagonistas en el tratamiento del asma.
Las metilxantinas, como la teofilina, fueron hace tiempo el pilar central de la farmacoterapia para el asma crónico. Son menos efectivas y producen más reacciones adversas que los betaagonistas.
Los glucocorticoides inhalados son a menudo fármacos de elección para la profilaxis del asma a largo plazo. Los glucocorticoides orales se usan para el tratamiento a corto plazo del asma agudo grave.
Los moduladores de los leucotrienos, principalmente usados en la profilaxis del asma, actúan reduiendo el componente inflamatorio del asma.
Los estabilizadores del mastocito son fármacos seguros para la profilaxis del asma. Son menos efectivos que los glucocorticoides inhalados y son inefectivos para el alivio del broncoespasmo agudo.
La enfermedad pulmonar obstructiva crónica (EPOC) es una enfermedad progresiva que se puede tratar con muchos fármacos pulmonares. Los broncodilatadores, expectorantes, mucolíticos, antibióticos y oxígeno pueden proporcionar un alivio sintomático.
Fisiología de la vía respiratoria baja
La función principal del aparato respiratorio es llevar oxígeno al cuerpo y eliminar el dióxido de carbono. El proceso por el que se intercambian los gases se llama respiración.
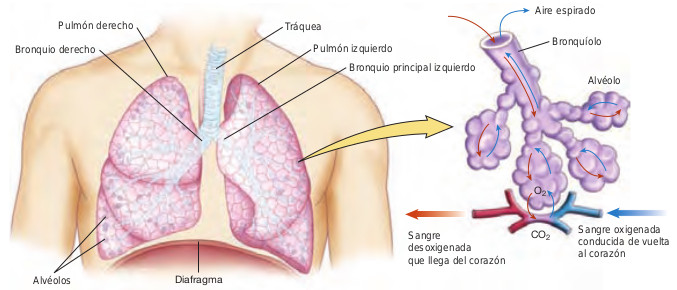
La ventilación es el proceso de introducir y sacar el aire de los pulmones. Según el diafragma se contrae y baja en su posición, crea una presión negativa que introduce aire en los pulmones, y así ocurre la inspiración. Durante la espiración, el diafragma se relaja y el aire abandona los pulmones de forma pasiva, sin gasto energético. La ventilación es un proceso puramente mecánico que ocurre aproximadamente de 12 a 18 veces por minuto en los adultos, una frecuencia determinada por las neuronas del tronco del encéfalo. Esta frecuencia puede modificarse por una serie de factores, incluyendo las emociones, la fiebre, la tensión nerviosa, el pH de la sangre y ciertos medicamentos.
El árbol bronquial termina en bolsas dilatadas llamadas alvéolos, que no tienen músculo liso, pero son muy ricos en capilares. En el alvéolo, una membrana extremadamente fina separa la vía aérea de los capilares pulmonares, permitiendo que los gases se muevan libremente entre el ámbito interno de la sangre y el aire inspirado. Cuando el oxígeno atraviesa esta membrana, se intercambia por dióxido de carbono, un producto de desecho celular que pasa de la sangre al aire. El pulmón está ricamente vascularizado. El flujo de sangre por los pulmones se conoce como perfusión.
El músculo liso bronquiolar
Los bronquíolos son estructuras musculares y elásticas cuyo diámetro o lumen varía con las demandas metabólicas del cuerpo. Los cambios en el diámetro de la luz bronquiolar son posibles gracias al músculo liso controlado por el sistema nervioso autónomo. Durante la respuesta al estrés agudo, se estimulan los receptores adrenérgicos beta2 del sistema nervioso simpático, el músculo liso bronquiolar se relaja y se produce broncodilatación. Esto permite que entre más aire a los alvéolos, aumentando el aporte de oxígeno a los tejidos durante los períodos de estrés o ejercicio. La activación del sistema nervioso simpático también aumenta la frecuencia y la profundidad de la respiración. Los fármacos que estimulan los receptores beta2-adrenérgicos, llamados comúnmente broncodilatadores, son algunos de los fármacos usados habitualmente en el tratamiento de los trastornos pulmonares.
Cuando se activan los nervios del sistema nervioso parasimpático, el músculo liso bronquiolar se contrae y el diámetro de la vía aérea se reduce, produciendo broncoconstricción. La broncoconstricción aumenta la resistencia de la vía aérea, haciendo que la respiración sea más trabajosa y el paciente se quede sin aliento. La estimulación parasimpática también tiene el efecto de ralentizar la frecuencia y profundidad de la respiración.
Administración de fármacos pulmonares por vía inhalada
El aparato respiratorio ofrece un mecanismo rápido y eficiente para administrar fármacos. La enorme superfi cie de los bronquíolos y alvéolos y el rico aporte sanguíneo a estas zonas produce un inicio de acción casi instantáneo para las sustancias inhaladas.
Los medicamentos se administran en el aparato respiratorio por medio de aerosoles. Un aerosol es una suspensión de diminutas gotas de líquido o finas partículas sólidas suspendidas en un gas. La principal ventaja de los aerosoles es que administran el fármaco directamente en el lugar de acción, reduciendo los efectos adversos sistémicos. Para conseguir una acción terapéutica equivalente, un fármaco oral debería administrarse en altas dosis y se distribuiría por todos los tejidos corporales. El tratamiento con aerosoles proporciona un alivio inmediato del broncoespasmo, una alteración durante la cual el músculo liso bronquiolar se contrae rápidamente, haciendo que el paciente jadee para respirar. Los fármacos también pueden administrarse para soltar el moco viscoso del árbol bronquial.
Hay que comprender claramente que los agentes administrados por vía inhalada pueden producir efectos sistémicos por la absorción a través de los capilares pulmonares. Por ejemplo, los anestésicos, como el óxido nitroso y el halotano, se administran por vía inhalada y se distribuyen rápidamente produciendo depresión del SNC. Los disolventes, como los de pintura o pegamento, a veces se inhalan intencionadamente y pueden producir efectos adversos graves en el sistema nervioso e incluso la muerte. Sin embargo, en general, los fármacos que se administran por vía inhalada por enfermedades respiratorias producen una toxicidad sistémica mínima.
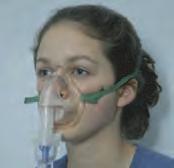
Existen varios dispositivos para administrar los fármacos por vía inhalada. Los nebulizadores son pequeñas máquinas que vaporizan una medicación líquida en un fino vaho que puede inhalarse, usando una mascarilla facial o un dispositivo manual. Si el fármaco es sólido, puede administrarse con un inhalador de polvo seco (IPS). Un IPS es un pequeño dispositivo que se activa por el proceso de la inhalación para instilar un fino polvo directamente en el árbol bronquial. Los inhaladores de dosis medidas (IDM) son un tercer tipo de dispositivo usado habitualmente para administrar fármacos respiratorios. Los IDM utilizan un propulsor para administrar una dosis medida de fármaco en los pulmones en cada respiración. El paciente fija la hora de la inhalación de las bocanadas de fármaco emitidas por el IDM.
Los tratamientos con aerosoles plantean algunos problemas. Es difícil calcular la dosis exacta que recibe el paciente porque depende del patrón respiratorio del paciente y del uso correcto del dispositivo. Incluso en condiciones óptimas, sólo del 10% al 50% del fármaco alcanza realmente la vía respiratoria baja. Los pacientes deben ser cuidadosamente instruidos para que usen correctamente estos dispositivos. El hecho de tragarse la medicación que se deposita en la cavidad oral puede causar efectos sistémicos si el fármaco se absorbe en el tubo digestivo. Además, los pacientes deben aclararse la boca a fondo después de usar el fármaco para reducir el potencial de absorción del mismo a través de la mucosa oral. La figura 39.2 muestra tres dispositivos utilizados para administrar fármacos respiratorios.


Fisiopatología del asma
El asma es una enfermedad pulmonar crónica con componente inflamatorio y broncoespástico. Los fármacos pueden administrarse para disminuir la frecuencia de los ataques asmáticos o para detener ataques que ya hayan comenzado.
El asma es una de las enfermedades crónicas más comunes en EEUU y afecta a casi 15 millones de americanos. Aunque la enfermedad puede aparecer a cualquier edad, a menudo se considera el asma como una enfermedad pediátrica. Caracterizada por un broncoespasmo agudo, el asma puede producir una intensa disnea, tos y trabajo respiratorio. Junto con la broncoconstricción, hay una respuesta inflamatoria aguda que estimula la secreción de histamina, lo cual aumenta el moco y el edema de las vías aéreas. Como en la rinitis alérgica, la vía aérea se vuelve más respondedora a los alérgenos. Tanto el broncoespasmo como la inflamación contribuyen a la obstrucción de la vía aérea.
El paciente con asma puede presentarse con síntomas agudos o crónicos. Los intervalos entre los síntomas pueden oscilar entre días a semanas o meses. Algunos pacientes sufren asma cuando se exponen a desencadenantes específicos (ej. alérgenos, contaminantes del aire, estrés, infecciones respiratorias, o sustancias químicas y alimentos). Otros sufren la alteración con el ejercicio, una enfermedad llamada asma inducida por el ejercicio. La crisis asmática es una forma grave y prolongada de asma que no responde al tratamiento farmacológico y puede conducir a insuficiencia respiratoria.
Como el asma tiene un componente de broncoconstricción y otro de inflamación, la farmacoterapia de la enfermedad se centra en uno de estos mecanismos o en ambos. Los objetivos del tratamiento farmacológico son dobles: poner fin a los broncoespasmos agudos que ya han comenzado y reducir la frecuencia de los ataques de asma. Se necesitan medicamentos distintos para lograr cada uno de estos objetivos.
Tratamiento del asma agudo con agonistas beta-adrenérgicos
Los agonistas beta2 son broncodilatadores eficaces para el tratamiento del asma y otras enfermedades pulmonares. Son algunos de los agentes prescritos con mayor frecuencia en la patología pulmonar.
Los agonistas beta-adrenérgicos son simpaticomiméticos y se consideran fármacos de elección en el tratamiento de la broncoconstricción aguda. Algunos betaagonistas activan tanto los receptores beta 1 como los beta2 , mientras que otros sólo activan los beta2. Los simpaticomiméticos selectivos para los receptores beta2 del pulmón han sustituido en gran medida a los agentes más antiguos no selectivos, como la adrenalina, porque producen menos efectos colaterales cardíacos. Los betaagonistas se llaman comúnmente broncodilatadores, porque esta es su acción farmacológica principal.
Los broncodilatadores relajan el músculo liso bronquial, ensanchando así la vía aérea y haciendo que la respiración sea más fácil para el paciente. Aunque son bastante eficaces para aliviar el broncoespasmo, los betaagonistas no tienen propiedades antiinflamatorias; por eso, se necesitan otros tipos de fármacos para controlar el componente inflamatorio del asma crónico.
Un método práctico de clasificar los agonistas beta-adrenérgicos para el asma es por su duración de acción. Los broncodilatadores de acción ultracorta, como el isoproterenol y la isoetarina, actúan inmediatamente, pero sus efectos duran sólo 2 o 3 horas. Los agentes de acción corta, como el metaproterenol, la terbutalina y el pirbuterol también actúan rápidamente, pero duran hasta 5 o 6 horas. Los betaagonistas de acción intermedia, como el albuterol, el levalbuterol y el bitolterol, duran unas 8 horas. El agente de duración más larga, el salmeterol, tiene unos efectos broncodilatadores que duran hasta 12 horas. El formoterol es un nuevo agonista beta2-adrenérgico que combina un inicio de acción muy rápido (1 a 3 minutos) con una duración de 12 horas. El fármaco específico que se elige para el tratamiento depende el patrón de los síntomas que experimenta el paciente.
Los broncodilatadores de acción ultracorta, corta e intermedia actúan lo bastante rápido como para coartar los episodios agudos de asma. El inicio de acción del salmeterol es demasiado largo para interrumpir el asma. Sin embargo, los agentes de acción larga son más convenientes porque requieren unas dosis menos frecuentes y son especialmente útiles en pacientes que con frecuencia se despiertan por la noche con un ataque de asma. Las fórmulas de acción larga a veces se usan a la vez que los glucocorticoides inhalados para controlar el asma crónico persistente.
Los agonistas beta-adrenérgicos inhalados producen muy poca toxicidad sistémica, porque sólo se absorben pequeñas cantidades del fármaco. Cuando estos fármacos se administran por vía oral, se consigue una mayor duración de la acción, pero se sufren con mayor frecuencia efectos secundarios, como taquicardia, arritmias e hiperglucemia; a veces están contraindicados en pacientes con arritmias. Con el uso crónico se puede desarrollar tolerancia al betaagonista, y la acción broncodilatadora se hará más corta. Si esto sucede, habría que aumentar la dosis de betaagonista, o añadir un segundo fármaco como un glucocorticoide al régimen terapéutico. El aumento de uso de un betaagonista durante un período de horas al día indica que la enfermedad del paciente está empeorando rápidamente y que debe buscar atención médica de forma inmediata.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con agonistas beta-adrenérgicos para el asma implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento farmacológico prescrito. El padecer dificultad para respirar puede ser penoso y afectar enormemente a la calidad de vida del paciente. El control del asma es vital para que la persona pueda seguir una vida normal. Cuando se usan beta-adrenérgicos como broncodilatadores, ayudan a reducir la dificultad respiratoria. Algunos facilitan la expectoración de las secreciones respiratorias.
Compruebe las constantes vitales del paciente, especialmente la frecuencia respiratoria y cardíaca, el murmullo vesicular, el esfuerzo respiratorio, el color de la piel y el nivel de saturación de oxígeno antes de la administración de los agonistas beta-adrenérgicos. Averigüe si existen antecedentes de bradicardia, arritmias, infarto de miocardio (IM), hipotiroidismo, al teración de la función renal, diabetes mellitus, glaucoma, hiperplasia prostática benigna y tuberculosis. Los agonistas beta-adrenérgicos no deben usarse en pacientes con antecedentes de arritmia o IM. Su uso está limitado en niños menores de 6 años. Los agonistas beta-adrenérgicos no se recomiendan en mujeres que estén amamantando.
Los fármacos de esta clase pueden producir muchos efectos secundarios indeseables. Los efectos secundarios graves incluyen broncoespasmo de rebote, dolor torácico o dificultad respiratoria. Otros efectos adversos comunes incluyen palpitaciones, taquicardia, sequedad de boca, nerviosismo, tos o hiperglucemia.
Educación del paciente
La educación del paciente en lo referente a los agonistas beta-adrenérgicos debe incluir los objetivos del tratamiento; las razones para obtener datos basales como las constantes vitales y la existencia de enfermedades cardíacas y renales subyacentes, y los posibles efectos adversos.
Incluya los siguientes puntos cuando instruya al paciente sobre los agonistas beta-adrenérgicos:
- Limitar el uso de productos que contengan cafeína.
- Informar inmediatamente de dificultad respiratoria, palpitaciones cardíacas, temblor, vómitos, nerviosismo o cambios en la visión.
- Seguir las instrucciones del profesional sanitario para la utilización correcta del inhalador, incluyendo lo siguiente:
- Aguantar la respiración durante 10 segundos después de inhalar la medicación.
- Esperar dos minutos antes de la segunda inhalación.
- Enjuagarse la boca después del uso.
- Saber que la saliva y el esputo pueden teñirse de rosa tras el uso del inhalador.
- Tomar la medicación como se le ha prescrito y no aumentar, disminuir, omitir ni cambiar los intervalos entre dosis.
- Informar si no se alivian los síntomas de forma satisfactoria.
Tratamiento del asma crónico con anticolinérgicos
Aunque los betaagonistas son fármacos de elección en el tratamiento del asma agudo, los anticolinérgicos son broncodilatadores alternativos. Sólo se usan dos anticolinérgicos normalmente en las enfermedades pulmonares.
El bloqueo del sistema nervioso parasimpático produce efectos similares a los observados mediante la activación del sistema nervioso simpático. Por tanto, es predecible que los fármacos anticolinérgicos produzcan broncodilatación y tengan aplicaciones potenciales en la farmacoterapia del asma y otras enfermedades pulmonares. Por ejemplo, a pesar de sus muchas reacciones adversas, la atropina se utilizó ampliamente en el tratamiento del asma antes del descubrimiento de los betaagonistas inhalados.
El ipratropio es el anticolinérgico más comúnmente prescrito en la farmacoterapia de la enfermedad pulmonar obstructiva crónica (EPOC) y el asma. Tiene un inicio de acción más lento que la mayoría de los betaagonistas y produce una broncodilatación menos intensa. Sin embargo, la combinación del ipratropio con un betaagonista produce una broncodilatación mayor y más prolongada que cada fármaco por separado. Aprovechando este aumento del efecto, existe una mezcla de ipratropio y albuterol en un único envase IDM. El tiotropio es un anticolinérgico más moderno de la familia del ipratropio que ha sido recientemente aprobado para la EPOC.
Los anticolinérgicos inhalados son tratamientos seguros. El amplio espectro de reacciones adversas anticolinérgicas observadas cuando los fármacos de esta clase se administran por vía sistémica raramente se dan cuando se inhalan. La sequedad de boca, las alteraciones digestivas, la cefalea y la ansiedad son las quejas más frecuentes de los pacientes.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento anticolinérgico del asma implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento farmacológico prescrito. Los fármacos de este grupo se usan como mantenimiento y no como tratamientos de primera línea en un episodio respiratorio agudo. Los efectos de los fármacos son más retardados comparados con los fármacos beta-adrenérgicos de acción rápida.
Compruebe la frecuencia respiratoria antes y después de la primera dosis de un IDM, porque la primera dosis puede precipitar un broncoespasmo. Vigile las constantes vitales, especialmente la frecuencia respiratoria y cardíaca, el trabajo respiratorio, el color de la piel, el nivel de saturación de oxígeno y el murmullo vesicular. Averigüe si existen antecedentes de glaucoma de ángulo estrecho, hiperplasia prostática benigna, alteraciones renales u obstrucción del cuello vesical. Los anticolinérgicos deben usarse con precaución en pacientes con antecedentes de cualquiera de estas alteraciones y en ancianos.
El ipratropio no se recomienda en niños menores de 12 años, y el tiotropio no se recomienda en pacientes menores de 18 años. Los anticolinérgicos no se recomiendan en mujeres durante la lactancia.
Los fármacos anticolinérgicos pueden producir efectos adversos indeseables, aunque no suelen ser graves. Incluyen tos, sinusitis, infección respiratoria alta, sequedad de boca, retención urinaria, náuseas, vómitos y estreñimiento.
Educación del paciente
La educación del paciente en relación con los anticolinérgicos debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales y la existencia de alteraciones vesicales o renales subyacentes, y las posibles reacciones adversas. Incluya los siguientes puntos cuando instruya al paciente sobre los anticolinérgicos:
- No usar esta medicación para coartar un ataque agudo de asma.
- Esperar 5 minutos entre el uso de este medicamento y cualquier otra medicación inhalada.
- Evitar el contacto de la medicación con los ojos.
- Enjuagarse la boca tras inhalar la medicación para eliminar el sabor amargo.
- Usar el inhalador correctamente.
- Informar de cambios en el patrón urinario, sobre todo en pacientes ancianos.
- Informar si aparecen cambios en el color o la cantidad de esputos.
- Informar si no se alivian los síntomas de forma satisfactoria.
Tratamiento del asma crónico con metilxantinas
Las metilxantinas son los fármacos más antiguos y asentados. Son unos broncodilatadores alternativos que se prescriben para el tratamiento del asma persistente y crónico.
Las metilxantinas comprenden un grupo de broncodilatadores relacionados químicamente con la cafeína. La teofilina y la aminofilina se consideraban fármacos de elección para el asma hace 20 años. La teofilina, sin embargo, tiene un margen de seguridad muy estrecho e interacciona con muchos otros fármacos. Además, los efectos adversos, como las náuseas, vómitos y estimulación del SNC, son relativamente frecuentes, y pueden darse arritmias a altas dosis. Al igual que la cafeína, las metilxantinas pueden producir nerviosismo e insomnio.
Las metilxantinas se administran por vía oral o IV, en lugar de inhaladas. Tras ser sustituida por fármacos más seguros y eficaces, la teofilina actualmente se usa para la profilaxis oral a largo plazo del asma que no responde a betaagonistas o a glucocorticoides inhalados.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con metilxantinas para el asma implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento farmacológico prescrito. El uso de las metilxantinas es limitado por la estimulación del SNC y la disponibilidad de otros fármacos que actúan más selectivamente sobre el aparato respiratorio. Las acciones de las metilxantinas sobre el sistema cardiovascular no son tan importantes como las de la cafeína, pero sí que afectan a la función cardíaca.
Compruebe las constantes vitales del paciente, especialmente la frecuencia respiratoria y el pulso, la frecuencia cardíaca, el murmullo vesicular, el trabajo respiratorio, el color de la piel y el nivel de saturación de oxígeno antes de la administración de metilxantinas. Compruebe si hay antecedentes de enfermedad coronaria, angina de pecho, alteraciones renales o hepáticas graves, úlcera péptica, hiperplasia prostática benigna y diabetes mellitus. El uso de metilxantinas en pacientes con enfermedad coronaria o angina de pecho está contraindicado. Úselos con precaución en ancianos y niños y no se recomienda en mujeres durante la lactancia.
Los fármacos de esta clase pueden producir efectos adversos indeseables. Los efectos adversos graves incluyen convulsiones inducidas por el fármaco, insuficiencia circulatoria o parada respiratoria. Otras reacciones adversas más comunes incluyen taquicardia, irritabilidad, nerviosismo, insomnio, mareo, cefalea, palpitaciones, vómitos y dolor abdominal.
Educación del paciente
La educación del paciente en relación con las metilxantinas debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales y la existencia de alteraciones cardíacas o renales subyacentes, y las posibles reacciones adversas. Incluya los siguientes puntos cuando instruya al paciente sobre las metilxantinas:
- Limitar el uso de productos que contengan cafeína.
- Informar de signos precoces de toxicidad, incluyendo anorexia, naúseas, vómitos, mareo, nerviosismo, hipotensión o convulsiones.
- Tomar la medicación como se le ha prescrito, y no aumentar, disminuir, omitir o cambiar los intervalos entre dosis.
- Limitar el hábito tabáquico, porque fumar reduce la respuesta terapéutica de las metilxantinas.
- Animar a la ingesta de líquidos, si no se encuentra restringida.
- No tomar fármacos de venta sin receta médica sin notificárselo al profesional sanitario.
- Acudir a todas las citas programadas y a las pruebas de laboratorio.
- Informar si no se alivian los síntomas de forma satisfactoria.
Profilaxis del asma con glucocorticoides
Los glucocorticoides inhalados se usan para la prevención a largo plazo de los ataques asmáticos. Los glucocorticoides orales pueden usarse para el tratamiento a corto plazo del asma grave agudo.
Los glucocorticoides son las sustancias naturales antitinflamatorias más potentes que se conocen. Como el asma tiene un importante componente inflamatorio, no es sorprendente que los fármacos de este tipo desempeñen un papel principal en el tratamiento de esta enfermedad. Los glucocorticoides frenan la activación de las células inflamatorias y aumentan la producción de los mediadores antiinflamatorios. Se disminuye la producción de moco y el edema, reduciendo así la obstrucción de la vía aérea. Aunque los glucocorticoides no son broncodilatadores, sensibilizan el músculo liso bronquial para que responda mejor al estímulo betaagonista. Además, reducen la hipersensibilidad bronquial a los alérgenos que es la responsable del desencadenamiento de algunos ataques de asma. En la farmacoterapia del asma, los glucocorticoides pueden administrarse por vía sistémica o por inhalación.
Los glucocorticoides inhalados son el tratamiento de elección para prevenir los ataques de asma. Cuando se inhalan en una pauta diaria, los glucocorticoides suprimen la inflamación sin producir reacciones adversas graves. Aunque los síntomas mejoran en la primera o segunda semana de tratamiento, se requieren de 4 a 8 semanas para lograr el máximo efecto. Para los pacientes con asma persistente, se puede prescribir un agonista beta2-adrenérgico de larga acción junto con el glucocorticoide inhalado para lograr un efecto aditivo.
Los pacientes deben estar informados de que los glucocorticoides inhalados deben tomarse a diario para producir su efecto terapéutico y que estos fármacos no son eficaces para interrumpir los ataques agudos de asma que ya han comenzado. La mayoría de los asmáticos llevan consigo un inhalador con un betaagonista de acción rápida para interrumpir los ataques agudos si ocurren.
Para el asma grave e inestable que no responde a otros tratamientos, pueden prescribirse glucocorticoides sistémicos, como la prednisona oral. El tiempo del tratamiento debe ser lo más corto posible, normalmente de 5 a 7 días. Al final del breve período de tratamiento, se pasa a los pacientes a glucocorticoides inhalados para el manejo a largo plazo.
Los glucocorticoides inhalados se absorben en la circulación tan lentamente que las reacciones adversas sistémicas se observan en raras ocasiones. Los efectos colaterales locales incluyen ronquera y candidiasis orofaríngea. Si se toman durante más de 10 días, los glucocorticoides sistémicos pueden producir reacciones adversas graves, como atrofia suprarrenal, úlcera péptica, osteoporosis e hiperglucemia. Dado que el asma afecta normalmente a los niños, el retraso del crecimiento es preocupante con el uso de estos fármacos.
Como todas estas reacciones adversas son dependientes de la dosis y el tiempo, pueden evitarse limitando el tratamiento sistémico a menos de 10 días.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con glucocorticoides para el asma implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento farmacológico prescrito. Compruebe si hay antecedentes de asma, rinitis alérgica, hipertensión, enfermedad cardíaca, trombosis, síndrome de Cushing, infecciones fúngicas y diabetes mellitus. Vigile las constantes vitales del paciente, especialmente la frecuencia respiratoria y cardíaca, el trabajo respiratorio, el murmullo vesicular, el color de la piel, el nivel de saturación de oxígeno y peso corporal. Busque signos y síntomas de infección. Los inhaladores de esteroides deben usarse con precaución en pacientes con hipertensión, enfermedad digestiva, insuficiencia cardíaca congestiva, diabetes y enfermedad tromboembólica. El uso de glucocorticoides no se recomienda en mujeres embarazadas o durante la lactancia.
Los glucocorticoides pueden producir muchos efectos adversos indeseables cuando se administran sistémicamente. Los efectos adversos graves incluyen fracturas por compresión vertebral, reacciones anafilactoides y agravamiento o enmascaramiento de las infecciones. Otras reacciones adversas frecuentes incluyen retención de sodio y de líquidos, náuseas, acné, mala cicatrización de heridas, hiperglucemia, candidiasis oral y características cushingoides.
Como el objetivo principal de los glucocorticoides inhalados es prevenir la dificultad respiratoria, advierta al paciente de que no use este tratamiento durante un ataque agudo de asma.
Además, alerte al paciente para que vigile si aparecen signos y síntomas de infecciones simples, porque los glucocorticoides inhiben la respuesta inflamatoria y pueden enmascarar los signos de infección. Recomiende al paciente que se enjuague la boca tras usar inhaladores de esteroides, porque los fármacos pueden favorecer las infecciones fúngicas de boca y garganta.
Los glucocorticoides pueden aumentar la glucemia y deben controlarse estrechamente en pacientes con diabetes mellitus.
Educación del paciente
La educación del paciente en relación con los glucocorticoides para el asma debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales y la existencia de alteraciones cardíacas o renales subyacentes, y las posibles reacciones adversas. Incluya los siguientes puntos cuando instruya al paciente sobre los glucocorticoides:
- Tomarse la temperatura y presión arterial a diario e informar si se elevan.
- Si es diabético, controlar la glucemia estrechamente e informar de elevaciones inexplicables o importantes.
- Informar si aparecen deposiciones pegajosas, edema, mareo o dificultad respiratoria.
- No usar esta medicación para coartar ataques agudos de asma.
- Vigilar por si aparecen signos de infección, como mala cicatrización de heridas, décimas en la temperatura o malestar general.
- Enjuagarse la boca tras el uso.
- Vigilar el peso semanalmente e informar de cambios inusuales.
- Añadir comidas ricas en potasio a la dieta a menos que esté contraindicado y vigilar si aparece hipopotasemia.
- Tomar la medicación como se le ha prescrito y no aumentar, disminuir, omitir ni cambiar los intervalos entre dosis.
- No tomar ácido acetilsalicílico sin notificárselo al profesional sanitario.
- Informar si aumenta la incidencia de los síntomas de asma.
Profilaxis del asma con los moduladores de los leucotrienos
Los moduladores de los leucotrienos son fármacos nuevos, aprobados en los años noventa, que se usan para reducir la inflamación y aliviar la broncoconstricción. Modifican la acción de los leucotrienos, que son mediadores de la respuesta inflamatoria en los pacientes asmáticos.
Los leucotrienos son mediadores de la respuesta inmunitaria que están implicados en las reacciones alérgicas y asmáticas. Aunque el prefi jo leuco- se refiere a los leucocitos, estos mediadores son sintetizados por los mastocitos, así como por los neutrófi los, basófi los y eosinófi los. Cuando se liberan en la vía aérea favorecen el edema, la inflamación y la broncoconstricción.
Actualmente existen tres fármacos que modifican la función de los leucotrienos. El cileutón actúa bloqueando la lipooxigenasa, la enzima que sintetiza los leucotrienos. Los otros dos agentes de este tipo, el zafirlukast y el montelukast, actúan bloqueando los receptores de leucotrienos. Estos fármacos reducen la inflamación. No se consideran broncodilatadores como los agonistas beta2 , aunque reducen la broncoconstricción de forma indirecta.
Los moduladores de los leucotrienos son medicaciones orales aprobadas para la profilaxis del asma crónico. Como el cileutón se toma cuatro veces al día, es menos conveniente que el montelukast o el zafirlukast, que se toman cada 12 horas. El cileutón tiene un inicio de acción más rápido (2 horas) que los otros dos moduladores de los leucotrienos, que tardan hasta una semana en producir su máximo beneficio terapéutico. Debido a su inicio de acción retardado, los moduladores de los leucotrienos son ineficaces para interrumpir los ataques agudos de asma. El papel actual de los moduladores de leucotrienos en el tratamiento del asma es para el asma persistente que no puede controlarse con otros agentes.
Los moduladores de los leucotrienos ocasionan pocos efectos adversos graves. Pueden aparecer cefalea, tos, congestión nasal o molestias digestivas. Se ha visto que los pacientes mayores de 65 años sufren una mayor frecuencia de infecciones cuando toman moduladores de los leucotrienos. Estos agentes están contraindicados en pacientes con disfunción hepática importante o con alcoholismo crónico, ya que son metabolizados principalmente por el hígado.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con moduladores de los leucotrienos para el asma implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento farmacológico prescrito.
Compruebe si hay antecedentes de asma. Controle las constantes vitales, especialmente la frecuencia respiratoria y cardíaca, el trabajo respiratorio, el murmullo vesicular, el color de la piel y el nivel de saturación de oxígeno. Controle el HC y realice pruebas de función hepática periódicamente. Vigile estrechamente el tiempo de protrombina (TP) y el cociente normalizado internacional (INR) en pacientes que estén tomando warfarina. Vigile estrechamente las concentraciones de fenitoína en pacientes que la estén tomando; reduzca la dosis de teofilina y vigile estrechamente las concentraciones (con cileutón) si el paciente está tomando esta medicación al mismo tiempo. Compruebe si hay signos y síntomas de infección, especialmente en pacientes mayores de 65 años. Vigile estrechamente la frecuencia cardíaca y la presión arterial en pacientes que estén tomando propranolol al mismo tiempo. Controle la efectividad del montelukast en pacientes que estén tomando al mismo tiempo fenobarbital.
Debido al inicio de acción retardado de los moduladores de los leucotrienos, recomiende a los pacientes que no los usen durante un ataque agudo de asma. Además, avise a los pacientes de que vigilen si aparecen signos y síntomas de toxicidad hepática o de síndrome seudogripal, porque estos fármacos se metabolizan en el hígado.
Consideraciones por edades
Los moduladores de los leucotrienos deben usarse con precaución en ancianos, porque pueden aumentar el riesgo de infección. No deben usarse en pacientes que abusen del alcohol o en embarazadas (categoría B de riesgo en el embarazo). La seguridad en niños menores de 2 años (zafirlukast) no se ha establecido; el montelukast no debe usarse en niños menores de 1 año.
Educación del paciente
La educación del paciente en relación con el tratamiento con leucotrienos para el asma debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales y la existencia de alteraciones hepáticas subyacentes, así como las posibles reacciones adversas. Incluya los siguientes puntos cuando instruya al paciente acerca de los moduladores de los leucotrienos:
- Tomar el fármaco como se le ha prescrito, incluso durante los períodos libres de síntomas.
- No usar esta medicación para interrumpir un ataque agudo de asma.
- Informar inmediatamente si aparecen naúseas, fatiga, obnubilación, picor, dolor abdominal, orina de color oscuro y síntomas seudogripales.
- Acudir a todas las citas programadas y a las visitas al laboratorio para las pruebas.
- Informar si no se alivian los síntomas de forma satisfactoria.
- No amamantar mientras se tomen estos fármacos.
Profilaxis del asma con los estabilizadores de los mastocitos
Hay dos estabilizadores de los mastocitos que desempeñan un papel limitado, pero importante, en la profilaxis del asma. Estos fármacos actúan inhibiendo la liberación de histamina por parte de los mastocitos.
La cromolina y el nedocromilo se clasifican como estabilizadores del mastocito porque su acción sirve para inhibir la liberación de histamina por parte de los mastocitos y de otros mediadores de la inflamación. Al reducir la inflamación, permiten prevenir los ataques de asma. Al igual que los glucocorticoides, estos agentes deben tomarse a diario porque no son eficaces para interrumpir los ataques agudos. El máximo efecto terapéutico puede tardar en llegar varias semanas. Tanto la cromolina como el nedocromil se encuentran en la categoría B de riesgo en el embarazo y no muestran una toxicidad importante.
Los estabilizadores del mastocito son menos efectivos en la prevención del asma crónico que los glucocorticoides inhalados.
La cromolina fue el primer estabilizador del mastocito que se descubrió. El fármaco se administra con un IDM o un nebulizador, y la forma intranasal se usa en el tratamiento de la rinitis alérgica estacional. Los efectos adversos incluyen picazón o quemazón de la mucosa nasal, irritación de garganta y congestión nasal. Aunque no es frecuente, se han descrito casos de broncoespasmo y anafilaxia. Dada su corta semivida (80 minutos), la cromolina debe inhalarse de cuatro a seis veces al día.
El nedocromilo es un nuevo estabilizador del mastocito que tiene acciones y usos similares a los de la cromolina. Administrado con un IDM, el fármaco produce efectos similares a los de la cromolina, aunque al tener una semivida más larga, el nedocromil permite que las dosis sean menos frecuentes. Los pacientes a menudo experimentan un sabor amargo y desagradable, lo que es una causa frecuente para que dejen el tratamiento.
Farmacoterapia de la EPOC
La enfermedad pulmonar obstructiva crónica (EPOC) es un término general que se usa para describir varias enfermedades pulmonares caracterizadas por tos, producción de moco y alteración del intercambio gaseoso. Los fármacos pueden usarse para producir un alivio sintomático, pero no curan las enfermedades.
La EPOC es una causa principal de muerte e incapacidad. Las tres enfermedades específicas de la EPOC son el asma, la bronquitis crónica y el enfisema. La bronquitis crónica y el enfisema se asocian mucho con el tabaco (el consumo de cigarrillos es responsable del 85% al 90% de todos los casos de EPOC no asmática) y, secundariamente, con respirar los contaminantes del aire. En la bronquitis crónica, el exceso de moco se produce en la vía respiratoria baja debido a la inflamación e irritación que proceden del humo del tabaco o la contaminación. La vía aérea se obstruye parcialmente con el moco, produciendo los clásicos signos de disnea y tos. Un signo precoz de la bronquitis es con frecuencia una tos productiva al despertarse. El intercambio gaseoso puede estar alterado; por eso la respiración sibilante y la disminución de la tolerancia al ejercicio son otros signos críticos. Los microbios colonizan el ambiente rico en moco y las infecciones pulmonares son frecuentes. Como la mayoría de los pacientes con EPOC son fumadores desde hace mucho tiempo, a menudo tienen enfermedades cardiovasculares asociadas, como insuficiencia cardíaca e hipertensión.
La EPOC es progresiva, siendo su estadio terminal el enfisema. Tras años de inflamación crónica los bronquíolos pierden su elasticidad y los alvéolos se dilatan al máximo para permitir que entre más aire a los pulmones. El paciente sufre una disnea extrema con la más ligera actividad física. La distinción clínica entre la bronquitis crónica y el enfisema a veces no está clara, porque los pacientes pueden mostrar síntomas de las dos enfermedades al mismo tiempo.
Los objetivos de la farmacoterapia de la EPOC son aliviar los síntomas y evitar las complicaciones de la enfermedad. Se han usado varios tipos de fármacos para tratar las infecciones, controlar la tos y aliviar el broncoespasmo. La mayoría de los pacientes reciben broncodilatadores como el ipratropio, agonistas beta2 o glucocorticoides inhalados. Se prescriben broncodilatadores tanto de acción corta como de acción larga.
A veces se usan mucolíticos y expectorantes para reducir la viscosidad del moco bronquial y para ayudar a su eliminación. El tratamiento con oxígeno a largo plazo ayuda a respirar y ha demostrado que reduce la mortalidad en pacientes con EPOC avanzada. Pueden prescribirse antibióticos en pacientes que sufran muchas rachas de infecciones pulmonares.
Los pacientes con EPOC no deben recibir fármacos con actividad antagonista beta-adrenérgica para evitar la broncoconstricción. Deben evitarse los depresores respiratorios, como los opioides y los barbitúricos. Es importante destacar que ninguno de los tratamientos ofrece una cura para la EPOC; sólo tratan los síntomas de una enfermedad que tiende a empeorar progresivamente. La principal enseñanza para el profesional de enfermería es recomendar encarecidamente a estos pacientes que dejen de fumar. Se ha demostrado que el abandono del tabaco ralentiza la progresión de la EPOC y produce menos síntomas respiratorios.