Fármacos para los trastornos hipofisarios, tiroideos y suprarrenales
Como el sistema nervioso, el sistema endocrino es un importante controlador de la homeostasis. Mientras que un nervio ejerce un control instantáneo sobre una sola fibra muscular o glándula, una hormona del sistema endocrino puede afectar a todas las del cuerpo y tardar hasta varios días en producir un resultado óptimo. El balance hormonal se mantiene dentro de un rango muy estrecho: una cantidad muy pequeña o muy grande de una hormona puede causar profundos cambios fisiológicos. Este capítulo estudia los trastornos endocrinos más frecuentes y su farmacoterapia.
Conceptos clave
Los conceptos clave numerados proporcionan un breve resumen de los aspectos más importantes de cada uno de los apartados correspondientes dentro del capítulo. Si alguno de estos puntos no está claro, acuda al apartado correspondiente para su revisión.
El sistema endocrino mantiene la homeostasis usando las hormonas como mensajeros químicos que se secretan en respuesta a cambios en el ambiente interno. La retroalimentación negativa evita las respuestas excesivas por parte del sistema endocrino.
El hipotálamo secreta hormonas liberadoras, que se dirigen a la hipófisis anterior para liberar hormonas específicas. La hipófisis posterior libera sus hormonas en respuesta a señales nerviosas del hipotálamo.
Las hormonas se usan en los tratamientos de sustitución, como antineoplásicos, y por sus efectos terapéuticos naturales, como la supresión de las defensas corporales. Los bloqueantes de las hormonas se usan para inhibir las acciones de ciertas hormonas.
Sólo unas pocas hormonas hipofisarias e hipotalámicas, incluyendo la hormona del crecimiento y la ACTH, tienen aplicaciones clínicas como fármacos. La hormona del crecimiento y la ADH son ejemplos de hormonas hipofisarias que se usan como fármacos en terapia sustitutiva.
La glándula tiroides secreta tiroxina (T4) y triyodotironina (T3), que controlan el metabolismo basal y afectan a todas las células del cuerpo.
El hipotiroidismo puede tratarse administrando hormonas tiroideas, especialmente levotiroxina (T4).
El hipertiroidismo se trata administrando agentes, como las tioamidas que disminuyen la actividad de la glándula tiroides o usando yodo radiactivo, que destruye las células tiroideas hiperactivas.
La corteza suprarrenal secreta glucocorticoides, gonadocorticoides y mineralocorticoides. Los glucocorticoides preparan el cuerpo para el estrés a largo plazo e influyen en el metabolismo de los carbohidratos, de los lípidos y de las proteínas en casi todas las células.
La liberación de glucocorticoides está estimulada por la ACTH secretada en la hipófisis. La ACTH y otros agentes relacionados se usan rara vez como medicamentos.
La insuficiencia suprarrenal puede ser aguda o crónica. Los glucocorticoides se prescriben en la insuficiencia suprarrenal, en alergias, neoplasias y una gran variedad de otras enfermedades.
Los fármacos antisuprarrenales pueden usarse para tratar el síndrome de Cushing grave al inhibir la síntesis de corticoesteroides. No son curativos y su uso se limita a 3 meses de tratamiento.
El sistema endocrino y la homeostasis
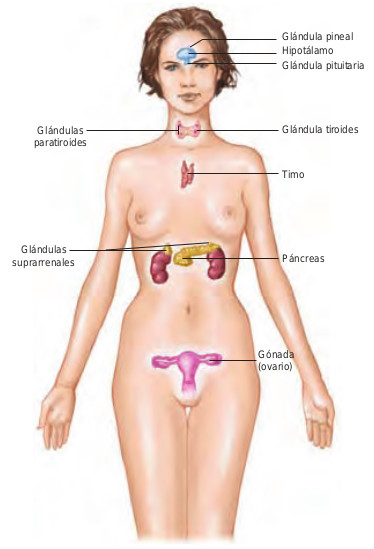
El sistema endocrino consta de varias glándulas que secretan hormonas, mensajeros químicos que se liberan en repuesta a un cambio del ambiente interno del cuerpo. El papel de las hormonas es mantener el cuerpo en homeostasis. Por ejemplo, cuando el nivel de glucosa en la sangre se eleva por encima de lo normal, el páncreas secreta insulina para devolver la glucosa a sus niveles normales. Las distintas glándulas endocrinas y sus hormonas se ilustran en la figura 43.1.
Tras la secreción de una glándula endocrina, las hormonas entran en la sangre y son transportadas por el cuerpo. Algunas, como la insulina y la hormona tiroidea, tienen receptores en casi todas las células del cuerpo; así, estas hormonas tienen efectos muy extensos. Otras, como la hormona paratiroidea (PTH) y la oxitocina, tienen receptores sólo en algunos tipos específicos de células.
En el sistema endocrino es común que una hormona controle la secreción de otra hormona. Además, es frecuente que la última hormona o acción de la vía ejerza una retroalimentación para disminuir la secreción de la primera hormona. Por ejemplo, si se reducen las concentraciones de calcio en el suero, se libera PTH; la PTH produce un aumento de la calcemia, lo cual ejerce una retroalimentación hacia las glándulas paratiroides para que dejen de secretar PTH. Esta característica de la homeostasis endocrina se conoce como retroalimentación negativa.
Hipotálamo e hipófisis
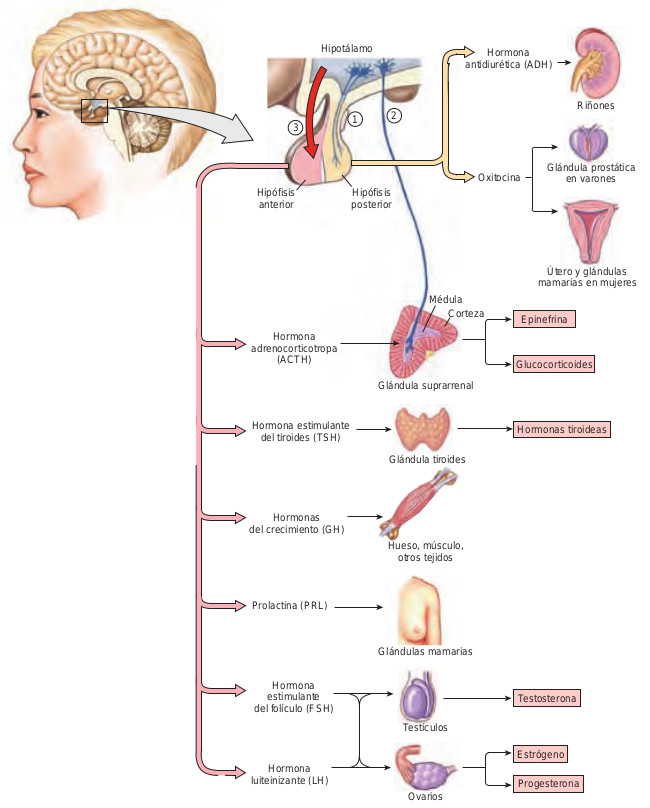
Hay dos estructuras del cerebro, el hipotálamo y la glándula pituitaria (hipófisis), que merecen un reconocimiento especial porque controlan muchas otras glándulas endocrinas. El hipotálamo secreta hormonas liberadoras que viajan por los vasos sanguíneos un corto trayecto, hasta la hipófisis. Estas hormonas liberadoras indican a la hipófisis cuál es la hormona que debe liberar. Tras la secreción, la hormona pituitaria viaja hasta sus tejidos diana para producir sus efectos. Por ejemplo, el hipotálamo secreta hormona liberadora de tirotropina (TRH), que viaja hasta la glándula pituitaria con el mensaje de secretar hormona estimuladora del tiroides (TSH). Entonces la TSH viaja hasta su órgano diana, la glándula tiroides, para estimular la liberación de hormona tiroidea. Aunque la hipófisis a menudo se llama glándula maestra, es más correcto considerarla como una unidad integrada junto con el hipotálamo.
La glándula pituitaria consta de dos regiones distintas. La pituitaria anterior o adenohipófisis está compuesta por tejido glandular y secreta hormona adrenocorticotropa (ACTH), hormona estimuladora del tiroides (TSH), hormona del crecimiento, prolactina, hormona estimuladora del folículo (FSH) y hormona luteinizante (LH). La pituitaria posterior o neurohipófisis contiene tejido nervioso en lugar de tejido glandular. Las neuronas de la neurohipófisis almacenan hormona antidiurética (ADH) y oxitocina, que se liberan en respuesta a impulsos nerviosos del hipotálamo. Se muestra una selección de hormonas asociadas con el hipotálamo y con la glándula pituitaria en la figura 43.2.
Indicaciones para la farmacoterapia hormonal
Los objetivos de la farmacoterapia hormonal varían ampliamente. En muchos casos se administra una hormona como tratamiento sustitutivo en pacientes que no consiguen secretar suficientes cantidades de sus propias hormonas endógenas.
Son ejemplos de tratamiento sustitutivo la administración de hormona tiroidea tras la extirpación quirúrgica de la glándula tiroides, o la insulina en pacientes cuyo páncreas no funciona.
El tratamiento sustitutivo aporta las mismas concentraciones fisiológicas de la hormona que estarían presentes en el cuerpo en condiciones normales. Se resumen algunos trastornos endocrinos y su tratamiento farmacológico en la tabla 43.1.
Algunas hormonas se usan en la quimioterapia contra el cáncer para disminuir el tamaño de los tumores sensibles a las hormonas. Son ejemplos de esto la testosterona para el cáncer de mama y el estrógeno para el cáncer testicular. El mecanismo de acción antineoplásica de estas hormonas no se conoce. Cuando se usan las hormonas como antineoplásicos, sus dosis superan ampliamente los niveles fi siológicos que se encuentran normalmente en el cuerpo. Las hormonas casi siempre se usan en combinación con otras medicaciones antineoplásicas.
Otro objetivo de la farmacoterapia hormonal puede ser producir una respuesta exagerada que es parte de la acción normal de la hormona. La administración de hidrocortisona para suprimir la inflamación se aprovecha de la acción normal de los glucocorticoides, pero en cantidades mucho mayores que las que se encuentran normalmente en el cuerpo. El aporte de estrógenos o progesterona en épocas específicas durante el ciclo menstrual puede evitar la ovulación y el embarazo. En este ejemplo, el paciente toma hormonas naturales; sin embargo, las toma en un momento en que las concentraciones corporales son normalmente bajas.
La farmacoterapia endocrina también incluye el uso de «antihormonas». Estos antagonistas hormonales bloquean las acciones de las hormonas endógenas. Por ejemplo, el propiltiouracilo (PTU) se administra para bloquear los efectos de una glándula tiroides hiperactiva. El tamoxifeno se administra para bloquear las acciones del estrógeno en el cáncer de mama dependiente de estrógeno.
| Glándula | Hormona | Trastorno | Tratamiento farmacológico |
|---|---|---|---|
| corteza suprarrenal | glucocorticoides | hipersecreción: síndrome de cushing | agentes antisuprarrenales |
| hiposecreción: enfermedad de addison | glucocorticoides | ||
| hipófisis | hormona del crecimiento | hiposecreción: baja estatura | somatrem y somatropina |
| hipersecreción: acromegalia (adultos) | octreótido | ||
| hormona antidiurética | hiposecreción: diabetes insípida | vasopresina, desmopresina y lipresina | |
| tiroides | hormona tiroidea (T3 y T4) | hipersecreción: enfermedad de graves | propiltiouracilo, metimazol e i-131 |
| hiposecreción: mixedema (adultos) | hormona tiroidea, levotiroxina (T4) |
Trastornos del hipotálamo y la hipofisis
Dado el papel crítico de la hipófisis en controlar otros tejidos endocrinos, la falta de una secreción pituitaria adecuada puede tener efectos múltiples y profundos sobre la función corporal. Puede aparecer hipopituitarismo en varios tumores de la hipófisis y de zonas afines del cerebro, en traumatismos, trastornos autoinmunitarios o accidentes cerebrovasculares. La farmacoterapia se ocupa de la administración de la hormona que falte, tal vez durante el resto de la vida del paciente.
Farmacoterapia con hormonas pituitarias e hipotalámicas
De las 15 hormonas diferentes secretadas por la hipófisis y el hipotálamo, sólo unas pocas se usan en la farmacoterapia. Hay motivos válidos para no usarlas ampliamente. Algunas de estas hormonas sólo pueden obtenerse de fuentes naturales (encéfalo humano) y pueden ser muy caras si se usan en cantidades terapéuticas. Además, suele ser más eficaz administrar fármacos que afecten directamente a la secreción en los órganos diana. Dos hormonas pituitarias, la prolactina y la oxitocina, afectan al aparato reproductor femenino. La corticotropina afecta a la glándula suprarrenal. De las demás, la hormona del crecimiento y la antidiurética son las que tienen mayor utilidad clínica.
Hormona del crecimiento (GH)
La hormona del crecimiento o somatotropina estimula el crecimiento y el metabolismo de casi todas las células del cuerpo. La deficiencia de esta hormona en los niños puede producir baja estatura, un trastorno caracterizado por una altura física disminuida en comparación con la regla de un grupo de edad específico. La deficiencia grave produce enanismo. La baja estatura está causada por muchos trastornos aparte del déficit de GH, y a menudo no se encuentra una causa específica.
Antes de 1985 toda la GH se obtenía extrayéndola de hipófisis humanas, lo cual limitaba enormemente la cantidad disponible para tratamientos farmacológicos. Ahora se comercializan varias preparaciones de GH humana elaboradas en grandes cantidades mediante la tecnología de ADN recombinante. Por ejemplo, el somatrem y la somatropina son preparaciones de GH humana elaboradas con técnicas de ADN recombinante que están disponibles para tratamiento sustitutivo en niños. Si se empieza el tratamiento en etapas tempranas de la vida, se puede conseguir un crecimiento de hasta 15 centímetros. El tratamiento con GH está contraindicado en los pacientes en los que ya se han cerrado las epífisis. Los agentes de GH suelen tolerarse bien, aunque los pacientes deben someterse a controles regulares de tolerancia a la glucosa y función tiroidea durante el tratamiento farmacológico.
Todas las preparaciones de hormona del crecimiento se administran por vía subcutánea.
Antes de 2003, el tratamiento con hormona del crecimiento estaba aprobado sólo para tratar la talla baja en niños con deficiencias de GH. Sin embargo, la FDA ha aprobado el tratamiento con hormona del crecimiento para tratar niños con talla baja que tienen concentraciones normales de GH. El criterio de la talla para el tratamiento se define como una altura esperada en el adulto de menos de 160 centímetros para hombres y de 150 centímetros para mujeres.
El tratamiento con GH en niños con concentraciones normales de hormona del crecimiento puede añadir de 2,5 a 7,5 centímetros de altura tras 4 a 6 años de tratamiento farmacológico. El coste anual de unos 30.000 a 40.000 dólares puede desanimar a muchos padres que busquen este tratamiento para sus hijos.
El exceso de secreción de hormona del crecimiento en adultos se conoce como acromegalia. Es una rara enfermedad que casi siempre se debe a un tumor pituitario, y a veces requiere tratamiento farmacológico. El octeótrido es un antagonista sintético de la hormona del crecimiento que se parece estructuralmente a la hormona inhibidora de la hormona del crecimiento (somatostatina). Además de inhibir la hormona del crecimiento, el octeótrido favorece la reabsorción de líquido y electrólitos en el tubo digestivo y prolonga el tiempo de tránsito intestinal. Sus aplicaciones se limitan a tratar la acromegalia en adultos y a tratar la diarrea grave que a veces se asocia a los tumores carcinoides metastásicos. La acromegalia también se ha tratado con pegvisomant, un antagonista de los receptores de la hormona del crecimiento aprobado recientemente.
Hormona antidiurética
Como su nombre indica, la hormona antidiurética (ADH) retiene agua en el cuerpo. La ADH se libera de la glándula pituitaria posterior cuando el hipotálamo nota que el volumen plasmático ha disminuido, o que la osmolalidad de la sangre se ha vuelto muy alta. La ADH actúa sobre los tubos colectores del riñón aumentando la reabsorción de agua. La ADH también se denomina vasopresina, porque puede aumentar la presión arterial cuando se libera en grandes cantidades. La vasopresina se encuentra disponible como fármaco para tratar la diabetes insípida, una rara enfermedad producida por deficiencia de ADH. Los pacientes con este trastorno tienen una sed intensa y producen orina muy diluida debido al gran volumen de agua que se pierde por los riñones.
La desmopresina (DDAVP) es la forma más común de hormona antidiurética que se usa. Tiene una duración de acción de hasta 20 horas, mientras que la vasopresina y la lipresina tienen duraciones de sólo 2 a 8 horas. Además, la desmopresina se encuentra disponible como vaporizador nasal y se puede autoadministrar fácilmente, mientras que la vasopresina debe administrarse IM o subcutánea. El paciente también puede aumentar o disminuir más fácilmente la dosis en función de la eliminación de orina. La desmopresina se encuentra disponible en forma subcutánea, intravenosa y oral, y a veces se usa por vía intranasal para la enuresis nocturna. La desmopresina y la lipresina no tienen los intensos efectos vasoconstrictores de la vasopresina; por eso producen menos efectos adversos.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con hormona antidiurética para la deficiencia de ADH implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento prescrito.
Vigile los desequilibrios electrolíticos, los cambios en la densidad de la orina y en la ingesta de líquidos, porque la hormona antidiurética hace que el agua se reabsorba en el cuerpo. Es crucial controlar las concentraciones de sodio y potasio en suero para determinar si el tratamiento con ADH consigue efecto.
Una densidad urinaria baja indica que la orina está diluida y que la ADH es insuficiente; por tanto, hay que realizar análisis de orina y control de los aportes y pérdidas de líquidos para evaluar la respuesta terapéutica al régimen de tratamiento.
Compruebe las constantes vitales, sobre todo la presión arterial y el pulso, porque la retención hídrica puede aumentar la presión arterial, y la ADH es un potente vasoconstrictor. La vasopresina está contraindicada en pacientes con patología cardíaca y debe usarse con precaución en ancianos que pueden tener una patología cardíaca no diagnosticada. Vigile los aportes y pérdidas y el peso corporal, porque estos fármacos pueden producir retención de agua, produciendo edemas periféricos y aumento del peso corporal. Compruebe el estado neurológico, porque la intoxicación por agua produce un descenso en los niveles de sodio; los pacientes pueden mostrar síntomas de cefalea y cambios en el estado mental como somnolencia y confusión.
Obtenga un listado actualizado de los fármacos que toma el paciente y de su estilo de vida, para determinar si están contraindicados. El alcohol, la epinefrina, la heparina, el litio y la fenitoína también pueden disminuir los efectos terapéuticos de la ADH.
Consideraciones por edades
La desmopresina se administra a niños a partir de 6 años para la enuresis nocturna. El fármaco es más eficaz en niños de más de 9 años. Normalmente se usa como segunda opción, cuando han fracasado las terapias conductuales y motivacionales. En ocasiones se utiliza de forma esporádica, cuando el niño va a estar fuera de casa por acontecimientos especiales y hay un estrés emocional añadido.
No cura la enuresis, pero disminuye su incidencia. Después de retirar el fármaco, la frecuencia de recaída es elevada.
Educación del paciente
La educación del paciente en relación con el tratamiento antidiurético debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales, la existencia de trastornos cardíacos subyacentes y las posibles reacciones adversas al fármaco. Incluya los siguientes puntos cuando instruya al paciente sobre el tratamiento con hormona antidiurética:
- Acudir a todas las visitas al laboratorio programadas para las pruebas de análisis de orina y electrólitos en suero.
- Vigilar el peso dos veces a la semana e informar si aumenta o disminuye.
- Informar si aparece cefalea, cambios en el estado mental o aumento de la hinchazón de piernas o tobillos, que pueden indicar retención de líquidos y/o hipertensión.
- Evitar el consumo de alcohol, ya que disminuye los efectos terapéuticos de la ADH.
- No tomar otros fármacos prescritos o de venta sin receta médica, productos de herbolario, vitaminas ni minerales sin notificárselo al profesional sanitario.
- Informar inmediatamente si aparecen episodios de angina.
Función normal de la glándula tiroides
La glándula tiroides secreta hormonas que afectan casi a todas las células del cuerpo. Al estimular las enzimas que intervienen en la oxidación de la glucosa, las hormonas tiroideas regulan la tasa de metabolismo basal, que es la velocidad habitual a la que las células realizan sus funciones. Al aumentar el metabolismo celular, la hormona tiroidea aumenta la temperatura corporal.
La glándula también ayuda a mantener la presión arterial y a regular el crecimiento y el desarrollo.
La glándula tiroides tiene dos tipos básicos de células que secretan hormonas diferentes. Las células parafoliculares secretan calcitonina, una hormona implicada en la homeostasis del calcio. Las células foliculares de la glándula secretan hormona tiroidea, que realmente es una combinación de dos hormonas diferentes: la tiroxina (T4) y la triyodotironina (T3). El yodo es esencial para la síntesis de estas hormonas, y lo aporta la ingesta alimenticia de sal común yodada. Los nombres de estas hormonas se refi eren al número de átomos de yodo unidos a cada molécula, tres (T3) o cuatro (T4). La tiroxina es la principal hormona secretada por la glándula tiroides.
Cuando circula por la sangre, la hormona tiroidea se une a una proteína transportadora, la globulina transportadora de tiroxina (TBG), que evita que se degrade. Dada la importancia de la TBG en el transporte de la hormona tiroidea a sus lugares de actuación, su deficiencia puede producir disfunción tiroidea. En los tejidos diana la tiroxina se convierte en T3 mediante la fragmentación enzimática de un átomo de yodo. Entonces la T3 entra en las células diana, donde se une a los receptores intracelulares dentro del núcleo.
La función tiroidea está regulada a través de varios niveles de control hormonal. El descenso de los niveles de tiroxina en sangre indica al hipotálamo que secrete hormona liberadora del tiroides (TRH) o tirotropina. La TRH estimula la hipófisis para que secrete TSH, que estimula la glándula tiroides para que libere hormona tiroidea. El aumento de los niveles de hormona tiroidea en la sangre desencadena una retroalimentación negativa para parar la secreción de TRH y TSH.
Agentes tiroideos
Los trastornos tiroideos son frecuentes y a menudo se indica tratamiento farmacológico. La dosis correcta de fármaco tiroideo se individualiza enormemente y requiere ajustes cuidadosos y periódicos.
Farmacoterapia del hipotiroidismo
El hipotiroidismo puede producirse por un mal funcionamiento de la glándula tiroides o por una secreción baja de TSH por parte de la hipófisis. La causa más frecuente de hipotiroidismo en EEUU es la destrucción de la glándula tiroides por una tiroiditis crónica autoinmunitaria, conocida como enfermedad de Hashimoto. Los síntomas precoces de hipotiroidismo en los adultos, o mixedema, incluyen debilidad general, calambres musculares y sequedad de la piel. Otros síntomas más graves incluyen habla farfullante, bradicardia, aumento de peso, disminución de los sentidos del gusto y olfato e intolerancia al frío. Las pruebas de laboratorio suelen revelar un aumento de TSH con descenso de las concentraciones de T3 y T4 . La etiología del mixedema incluye enfermedad autoinmune, extirpación quirúrgica de la glándula tiroides o tratamiento agresivo con fármacos antitiroideos. Con dosis altas, el fármaco antiarrítmico amiodarona puede inducir hipotirodismo dado su alto contenido en yodo. La hipertrofia de la glándula tiroides o bocio puede estar presente o ausente, dependiendo de la causa de la enfermedad.
El hipotiroidismo suele responder bien al tratamiento farmacológico con agentes tiroideos naturales o sintéticos. Se puede elegir entre glándula tiroides desecada de vaca, cerdo u oveja (tiroides USP), T3 sintética y T4 sintética. La levotiroxina (T4) es más estable que el tiroides USP y elimina la posibilidad de reacciones alérgicas a las proteínas animales. Ya que pequeños cambios en la biodisponibilidad del fármaco pueden afectar a la función tiroidea, los pacientes deben evitar intercambiar marcas una vez que la enfermedad se ha estabilizado. La liotironina sódica es una forma sintética de acción corta de la hormona tiroidea natural que puede administrarse IV a individuos con coma mixedematoso. Su corta duración de acción permite una rápida respuesta en pacientes críticos.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con hormonas tiroideas implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento prescrito. Obtenga una lista actualizada de las medicaciones del paciente, tratamientos de herbolario, suplementos alimenticios y fármacos de venta sin receta médica, porque la hormona tiroidea interacciona con muchas sustancias.
Como el tiroides regula el metabolismo basal, compruebe el peso del paciente y sus constantes vitales. El aumento de peso, el descenso en el pulso y la hipotensión son característicos de un metabolismo disminuido que caracteríza al hipotiroidismo.
La levotiroxina aumenta el metabolismo, lo cual puede producir colapso cardiovascular en pacientes con patología cardíaca no diagnosticada. Vigile el pulso y la presión arterial para descartar signos precoces de colapso cardiovascular. El tiroides desecado puede producir las mismas complicaciones cardiovasculares que la levotiroxina. Compruebe si hay taquicardia, ritmo cardíaco irregular o hipertensión, que podrían indicar una sobredosis de hormona tiroidea. Demasiada cantidad del fármaco produce hipertiroidismo, en el que el paciente muestra nerviosismo, pérdida de peso e intolerancia al calor. Vigile estrechamente a los pacientes con alteración de la función renal, porque un aumento del metabolismo aumenta la carga de trabajo de los riñones. La levotiroxina está contraindicada en los enfermos con insuficiencia suprarrenal.
Consideraciones por edades
Durante las 12 primeras semanas de gestación, la glándula tiroides del feto no funciona completamente y la madre es la única fuente de hormona tiroidea para el bebé. Si la madre está hipotiroidea durante este período, hay un mayor riesgo de aborto, y el bebé tendrá un mayor riesgo de problemas del desarrollo. Por ejemplo, los hijos de madres con hipotiroidismo no tratado tienen casi cuatro veces más probabilidad de tener un CI más bajo y problemas de aprendizaje. Por este motivo, las mujeres con antecedentes de hipotiroidismo deben consultar con un endocrinólogo antes de quedarse embarazadas. El profesional sanitario evaluará los niveles de T3 y T4 y ajustará la dosis de hormona tiroidea sustitutiva a los niveles terapéuticos, evitando así las complicaciones del desarrollo. La mayoría de las mujeres pueden seguir tomando hormona tiroidea durante la lactancia, porque sólo se excretan pequeñas cantidades de hormona tiroidea en la leche materna.
Educación del paciente
La educación del paciente en relación con el tratamiento sustitutivo con hormona tiroidea debería incluir los objetivos del tratamiento, los motivos para obtener datos basales, como las constantes vitales, la existencia de enfermedades subyacentes, como patología cardíaca, y los posibles efectos adversos del fármaco. Incluya los siguientes puntos cuando instruya al paciente sobre el tratamiento sustitutivo con hormona tiroidea:
- Informar al profesional sanitario si padece enfermedad de Addison, diabetes mellitus o diabetes insípida, porque el tratamiento sustitutivo con hormona tiroidea puede estar contraindicado.
- Tomar la medicación para el tiroides con el estómago vacío a la misma hora cada día.
- Informar inmediatamente si aparece nerviosismo, palpitaciones o intolerancia al calor, porque esto puede indicar sobredosis.
- Informar inmediatamente si nota una fatiga excesiva, habla balbuceante, ronquera o pulso lento, porque esto puede ser indicativo de que la dosis es muy baja.
- No dejar de tomar la medicación sin consultar al profesional sanitario.
- No tomar otros fármacos prescritos, de venta sin receta, de herbolario o suplementos alimenticios sin informar al profesional sanitario.
- Acudir a todas las citas programadas y a las visitas al laboratorio para las pruebas.
Farmacoterapia del hipertiroidismo
A menudo se usan medicamentos para tratar la causa del hipertiroidismo o para aliviar sus molestos síntomas. El objetivo del tratamiento antitiroideo es disminuir la actividad de la glándula tiroides.
La hipersecreción de hormona tiroidea produce síntomas contrarios de los causados por el hipotiroidismo: aumento del metabolismo corporal, taquicardia, pérdida de peso, aumento de la temperatura corporal y ansiedad. El tipo más común de hipertiroidismo se llama enfermedad de Graves. Se considera una enfermedad autoinmunitaria en la que el cuerpo desarrolla anticuerpos contra su propia glándula tiroides, es de cuatro a ocho veces más frecuente en mujeres y ocurrecon mayor frecuencia entre los 30 y los 40 años de edad. Otras causas de hipertiroidismo son los adenomas de tiroides, los tumores hipofisarios y el embarazo.
Si la causa de la hipersecreción es un tumor o si la enfermedad no puede controlarse con tratamiento farmacológico, está indicada la extirpación quirúrgica de la glándula tiroides.
Los dos fármacos principales para el hipertiroidismo, el propiltiouracilo (PTU) y el metimazol, se llaman tioamidas. Estos agentes actúan inhibiendo la incorporación de los átomos de yodo a la T3 y a la T4 . El metimazol tiene una semivida mucho más larga, lo cual ofrece la ventaja de que necesita dosis menos frecuentes, aunque las reacciones adversas pueden ser más graves. Las dos tioamidas son agentes de categoría D de riesgo en el embarazo, pero el metimazol atraviesa la placenta más rápidamente que el propiltiouracilo y está contraindicado en embarazadas.
Un tercer fármaco antitiroideo, el yoduro de sodio-131, es un isótopo radiactivo que destruye las glándulas tiroideas hiperactivas con radiación ionizante. Poco después de la administración oral, el I-131 se acumula en la glándula tiroides, donde destruye las células foliculares. El objetivo del tratamiento farmacológico con I-131 es destruir la cantidad justa de glándula tiroides para que los niveles de función tiroidea vuelvan al estado normal. Los beneficios completos pueden tardar meses en observarse. Aunque la mayoría de los pacientes sólo necesitan una dosis, otros necesitan múltiples tratamientos. Se usan dosis pequeñas diagnósticas de I-131 en medicina nuclear para determinar el grado de captación de yodo en las distintas partes de la glándula tiroides.
El yodo no radiactivo también está disponible para tratar otros trastornos tiroideos. La solución de Lugol es una mezcla de yodo elemental al 5% y yoduro potásico al 10% que se usa para suprimir la función tiroidea 10 a 15 días antes de la tiroidectomía. El yoduro sódico se administra IV (junto con el propiltiouracilo) para controlar la forma aguda de hipertiroidismo que puede amenazar la vida del paciente conocida como crisis tirotóxica o tormenta tiroidea. El yoduro potásico se administra para proteger al tiroides del daño por radiación tras un ataque nuclear bioterrorista.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento del hipertiroidismo implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento prescrito. Estudie si hay signos y síntomas de hipotiroidismo, como aumento de peso, hipotensión, bradicardia, fatiga, depresión, sensibilidad al frío, pérdida de pelo y piel seca en aquellos pacientes que estén recibiendo terapia antitiroidea. Compruebe si hay complicaciones o reacciones adversas específicas de la medicación antitiroidea prescrita al paciente. Para los pacientes que reciben propiltiouracilo (PTU), vigile periódicamente los niveles de leucocitos, porque el PTU puede producir agranulocitosis, que pone al paciente en riesgo de infección. Compruebe si hay signos de ictericia y vigile las enzimas hepáticas, porque el PTU se metaboliza en el hígado.
La administración de anticoagulantes debe controlarse cuidadosamente, porque el PTU produce un aumento del sangrado.
El metimazol es similar al PTU, pero es más tóxico. Estudie si hay discrasias sanguíneas como agranulocitosis e ictericia. Estas reacciones adversas suelen desaparecer cuando se retira el medicamento.
El yodo radiactivo (I-131) se usa para disminuir permanentemente la función tiroidea. Analice las pruebas de función tiroidea, porque esta medicación debe calibrarse cuidadosamente para lograr una dosis terapéutica que mantenga un estado eutiroideo. Instruya al paciente sobre los signos y síntomas de hipotiroidismo. Ya que el paciente emite radiación tras tomar este fármaco, debe evitarse a los niños y las embarazadas durante 1 semana tras la administración, y el contacto físico cercano con otras personas debe limitarse durante unos pocos días.
Consideraciones por edades
El yodo radiactivo (I-131) está contraindicado en pacientes embarazadas o que estén amamantando. Las mujeres tratadas con este agente deben tomar precauciones para evitar quedar embarazadas. Si una mujer cree que puede estar embarazada, debe consultar inmediatamente con el profesional sanitario. Las mujeres que tomen este medicamento deben dejar de amamantar durante el tiempo que dure el tratamiento y buscar métodos de alimentación alternativos con su profesional sanitario.
Educación del paciente
La educación del paciente en relación con los agentes antitiroideos debería incluir los objetivos del tratamiento, los motivos para obtener datos basales, como las constantes vitales, la existencia de enfermedades cardíacas o renales subyacentes y las posibles reacciones adversas al fármaco. Incluya los siguientes puntos cuando instruya al paciente sobre los agentes antitiroideos:
- Acudir a todas las visitas programadas al laboratorio para los análisis.
- No amamantar.
- Realizar una anticoncepción fiable e informar al profesional sanitario si se planea o se sospecha un embarazo.
- Informar inmediatamente si aparece nerviosismo, palpitaciones o intolerancia al calor, porque esto puede indicar que la dosis es baja.
- Informar inmediatamente si aparece una fatiga excesiva, lentitud en el habla, ronquera o pulso lento, porque esto puede indicar sobredosis.
- Informar al profesional sanitario si está tomando alguna de las siguientes medicaciones, porque están contraindicadas con los agentes antitiroideos: aminofilina, heparina o digoxina.
Función normal de la glándula suprarrenal
Aunque sean pequeñas, las glándulas suprarrenales secretan hormonas que afectan a todos los tejidos corporales. Los trastornos suprarrenales incluyen los que resultan de un exceso de secreción hormonal y los que se producen por una secreción hormonal deficiente. La farmacoterapia específica depende de qué porción de la glándula suprarrenal sea responsable de la secreción anormal.
Las glándulas suprarrenales secretan tres tipos principales de hormonas: los glucocorticoides, los mineralocorticoides y los gonadocorticoides. En conjunto, los glucocorticoides y los mi neralocorticoides se denominan corticoesteroides u hormonas adrenocorticales. Los términos corticoesteroide y glucocorticoide a veces se usan de forma intercambiable en la práctica clínica. Sin embargo, debe comprenderse que el término corticoesteroide se refiere a un fármaco que tiene actividad tanto glucocorticoide como mineralocorticoide.
Gonadocorticoides
Los gonadocorticoides secretados por la corteza suprarrenal son principalmente andrógenos (hormonas sexuales masculinas), aunque también se producen pequeñas cantidades de estrógenos. Las cantidades de estas hormonas sexuales suprarrenales son mucho menores que las secretadas por los testículos o los ovarios. Se cree que los gonadocorticoides suprarrenales contribuyen al comienzo de la pubertad. Las glándulas suprarrenales también son la principal fuente de estrógenos endógenos en las mujeres posmenopáusicas. La hipersecreción de gonadocorticoides, como la que ocurrepor un tumor de la corteza suprarrenal, produce hirsutismo y masculinización, signos que son más evidentes en las mujeres.
Mineralocorticoides
La aldosterona representa más del 95% de los mineralocorticoides secretados por las glándulas suprarrenales.
La función principal de la aldosterona es promover la reabsorción de sodio y la excreción de potasio en el túbulo renal, regulando así el volumen plasmático. Cuando el volumen plasmático desciende, el riñón secreta renina, que hace que se produzca angiotensina II. La angiotensina II hace que se secrete aldosterona, que promueve la retención de sodio y agua. Los intentos de modificar esta vía condujeron al desarrollo del grupo de medicamentos inhibidores de la enzima convertidora de angiotensina (ECA), que a menudo se usan para trastornos cardiovasculares, como la hipertensión y la insuficiencia cardíaca. Algunos tumores suprarrenales producen una secreción excesiva de aldosterona, una enfermedad conocida como hiperaldosteronismo, que se caracteriza por hipertensión e hipopotasemia.
Glucocorticoides
Más de 30 glucocorticoides se secretan en la corteza suprarrenal, incluyendo el cortisol, la corticoesterona y la cortisona. El cortisol, también llamado hidrocortisona, se secreta en mayor cantidad, y es el más importante farmacológicamente. Los glucocorticoides afectan al metabolismo de casi todas las células y preparan al cuerpo para el estrés a largo plazo. Los efectos de los glucocorticoides son variados, e incluyen los siguientes:
- Aumento de la glucemia (efecto hiperglucemiante) al inhibir la secreción de insulina y promover la gluconeogénesis, la síntesis de carbohidratos a partir de fuentes lipídicas y proteicas
- Aumento de la fragmentación de proteínas y lípidos y su utilización como fuentes de energía
- Supresión de la respuesta inflamatoria e inmunitaria
- Aumento de la sensibilidad del músculo liso vascular a la norsuprarrenalina y a la angiotensina II
- Influencia sobre el SNC, alterando el humor y manteniendo la excitabilidad cerebral normal
Control de la secreción de glucocorticoides
El control de los niveles de glucocorticoides en la sangre comienza con el factor liberador de corticotropina (CRF), secretado por el hipotálamo. El CRF viaja a la hipófisis, donde produce la liberación de hormona adrenocorticotropa (ACTH).
La ACTH viaja por la sangre y alcanza la corteza suprarrenal, haciendo que libere glucocorticoides. Cuando aumenta el nivel de cortisol en sangre, ejerce una retroalimentación negativa hacia el hipotálamo y la pituitaria para que dejen de liberarse glucocorticoides.
La ACTH, también conocida como corticotropina, está disponible como medicamento en tres preparaciones distintas: corticotropina inyectada, corticotropina de depósito y corticotropina con hidróxido de zinc. Un cuarto fármaco, la cosintropina, se parece mucho a la ACTH. Aunque estas preparaciones estimulan la glándula suprarrenal para que produzca glucocorticoides, raramente se usan para corregir la deficiencia de corticoesteroides. Los agentes de la ACTH deben administrarse por vía parenteral, y producen muchas reacciones adversas. El uso principal de estos agentes es diagnosticar alteraciones suprarrenales. Tras la administración de cosintropina hay que medir las concentraciones plasmáticas de cortisol para determinar si la glándula suprarrenal ha respondido al estímulo de la ACTH.
Farmacoterapia con glucocorticoides
Los glucocorticoides se usan como tratamiento sustitutivo en pacientes con insuficiencia suprarrenal y para frenar la repuesta inflamatoria e inmunitaria. Los glucocorticoides son uno de los grupos de fármacos más extensamente prescritos.
La falta de una producción adecuada de corticoesteroides, conocida como insuficiencia suprarrenal, puede deberse a una hiposecreción de la corteza suprarrenal o a una secreción inadecuada de ACTH por parte de la pituitaria. Los síntomas incluyen hipoglucemia, fatiga, hipotensión, aumento de la pigmentación de la piel y alteraciones GI como anorexia, vómitos y diarrea. Son diagnósticos unos niveles bajos de cortisol plasmático junto con unos niveles elevados de ACTH en plasma, porque esto indica que la glándula suprarrenal no está respondiendo al estímulo de la ACTH. La insuficiencia suprarrenal primaria, conocida como enfermedad de Addison, es bastante rara e incluye una deficiencia tanto de glucocorticoides como de mineralocorticoides. La destrucción autoinmune de las dos glándulas suprarrenales es la causa más común de enfermedad de Addison. La insuficiencia suprarrenal secundaria es más frecuente y se asocia a farmacoterapia con glucocorticoides.
La insuficiencia suprarrenal aguda puede ocurrir cuando los glucocorticoides se retiran bruscamente en un paciente que ha estado con un tratamiento a largo plazo. Cuando los glucocorticoides se toman como medicación durante períodos prolongados, ejercen una retroalimentación negativa a la pituitaria para que deje de secretar ACTH. Sin el estímulo de la ACTH, la corteza suprarrenal se retrae y deja de secretar glucocorticoides endógenos, una condición conocida como atrofia suprarrenal.
Si la medicación de glucocorticoides se retira bruscamente, las glándulas suprarrenales atrofiadas no serán capaces de secretar los suficientes glucocorticoides y aparecen síntomas de insuficiencia suprarrenal aguda. Los síntomas incluyen náuseas, vómitos, obnubilación, confusión y coma. Es preciso administrar inmediatamente hidrocortisona IV, ya que puede aparecer un shock rápidamente si los síntomas no se tratan. Otras posibles causas de insuficiencia suprarrenal aguda son la infección, el traumatismo y un cáncer.
Para la insuficiencia suprarrenal crónica se indica el tratamiento sustitutivo con glucocorticoides. El objetivo del tratamiento sustitutivo es lograr la misma concentración fisiológica de hormonas en sangre que estaría presente si las glándulas suprarrenales estuvieran funcionando correctamente. Los pacientes que requieren tratamiento sustitutivo suelen precisar la toma de glucocorticoides el resto de su vida. Los pacientes con insuficiencia suprarrenal pueden también necesitar un mineralocorticoide, como la fludrocortisona.
Los glucocorticoides se prescriben en un gran número de patologías además de la insuficiencia suprarrenal aguda y crónica. Su capacidad de suprimir la respuesta inflamatoria e inmunitaria de forma rápida y eficaz les aporta una enorme utilidad para tratar varias enfermedades. De hecho, ningún otro fármaco se usa con tantas indicaciones diferentes. Las siguientes son indicaciones de tratamiento con glucocorticoides:
- Insuficiencia suprarrenal Alergias, incluida la rinitis estacional
- Asma y enfermedad pulmonar obstructiva crónica
- Enfermedad inflamatoria intestinal crónica, incluyendo la colitis ulcerosa y la enfermedad de Crohn
- Trastornos hepáticos, neurológicos y renales caracterizados por edema
- Patología neoplásica, incluyendo la enfermedad de Hodgkin, las leucemias y los linfomas
- Cirugía postrasplante
- Trastornos reumáticos, incluyendo la artritis reumatoide, la espondilitis anquilosante y la bursitis
- Shock
- Trastornos cutáneos, incluyendo la dermatitis por contacto y las erupciones
Existen más de 20 glucocorticoides disponibles como medicamento y la elección de un agente en particular depende principalmente de las propiedades farmacocinéticas del fármaco. La duración de acción, que normalmente se usa para clasificar a estos agentes, varía desde corta hasta larga.
Algunos, como la hidrocortisona, tienen actividad mineralocorticoide que produce retención de sodio y líquidos; otros, como la prednisona, no tienen tal efecto. Algunos glucocorticoides están disponibles sólo por una vía: por ejemplo, tópica para patologías dermatológicas o intranasal para la rinitis alérgica.
Los glucocorticoides interaccionan con muchos fármacos. Sus efectos hiperglucémicos pueden disminuir la efectividad de los agentes antidiabéticos. Combinar los glucocorticoides con otros fármacos ulcerogénicos como el ácido acetilsalicílico y otros AINE aumenta marcadamente el riesgo de úlcera péptica.
La administración junto con diuréticos ahorradores de potasio puede producir hipocalcemia e hipopotasemia.
Las siguientes estrategias se usan para limitar la incidencia de reacciones adversas graves derivadas de los glucocorticoides:
- Mantener las dosis más bajas posibles que logren un efecto terapéutico.
- Administrar los glucocorticoides en días alternos para limitar la atrofia suprarrenal.
- Para patologías agudas, administrar a los pacientes cantidades más altas durante unos pocos días y luego disminuir gradualmente el fármaco hasta que se interrumpa del todo.
- Administrar los fármacos locales por inhalación, inyección intraarticular o aplicación tópica en la piel, ojos u oídos cuando sea posible, para disminuir la posibilidad de producir efectos sistémicos.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento con glucocorticoides para la insuficiencia suprarrenal implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento prescrito.
Compruebe las constantes vitales en busca de aumentos de la temperatura y de la presión arterial, porque el tratamiento con glucocorticoides puede predisponer al paciente a sufrir infecciones y a aumentos de presión arterial. Vigile las concentraciones de potasio, T3 y T4 , porque pueden disminuir al tomar glucocorticoides. Vigile la glucemia, porque los glucocorticoides pueden causar hiperglucemia e inmunodepresión, lo cual retrasa la cicatrización de las heridas. Controle a los pacientes con tratamiento a largo plazo con glucocorticoides por si aparece osteoporosis o aumento de los niveles de colesterol. La administración de glucocorticoides a largo plazo puede producir síndrome de Cushing. Estudie si hay signos y síntomas de enfermedad de Cushing, como la cara de luna llena, el cuello de bisonte y los trastornos del humor y la personalidad.
Los individuos con patologías médicas como asma, EPOC, insuficiencia renal crónica, enfermedad de Crohn, colitis ulcerosa, artritis reumatoide y lupus típicamente se tratan con glucocorticoides a largo plazo en épocas de estrés o de exacerbaciones de su enfermedad para suprimir la respuesta inflamatoria. Hay que enseñar a estos individuos la importancia y las razones para el cumplimiento de la medicación prescrita y la importancia de reducir las dosis gradualmente.
Consideraciones por edades
Los glucocorticoides sistémicos están contraindicados en embarazadas y mujeres que estén amamantando. Los estudios en animales han demostrado que dosis altas de glucocorticoides sistémicos producen paladar hendido, aunque los datos de estudios en humanos están menos claros. El uso de un glucocorticoide sistémico durante el embarazo debe valorarse con mucho cuidado, teniendo en cuenta la gravedad de la enfermedad de la madre. Si el tratamiento farmacológico es necesario, se sugiere utilizar hidrocortisona, cortisona, prednisona o metilprednisolona, ya que se inactivan más rápidamente por las enzimas placentarias, al contrario que la dexametasona y la betametasona, que tienen más probabilidad de llegar al feto en forma activa.
Educación del paciente
La educación del paciente en relación con el tratamiento con glucocorticoides debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales, la existencia de enfermedades cardíacas o renales subyacentes y las posibles reacciones adversas al fármaco. Incluya los siguientes puntos cuando instruya al paciente sobre el tratamiento con glucocorticoides:
- Informar si aparecen cambios inusuales en el humor o en la personalidad, cara de luna llena y joroba de búfalo, porque estos son signos de sobredosis (síndrome de Cushing).
- Practicar una anticoncepción fiable e informar al profesional sanitario si planea o sospecha un embarazo.
- No amamantar mientras esté tomando estas medicaciones.
- Informar de heridas que curen de forma anormalmente lenta.
- Acudir a todas las citas programadas y a las visitas al laboratorio para los análisis.
- Informar si aparece fiebre, que podría indicar que hay una infección subyacente.
- Informar si aparecen signos de hiperglucemia.
Farmacoterapia en el síndrome de Cushing
El síndrome de Cushing aparece cuando hay unas concentraciones elevadas de glucocorticoides en el cuerpo durante un período prolongado. Aunque la hipersecreción de estas hormonas puede deberse a tumores de la hipófisis (exceso de ACTH) o de las glándulas suprarrenales, la causa más común de síndrome de Cushing es el tratamiento a largo plazo con medicación sistémica con glucocorticoides. Los síntomas y signos incluyen atrofia suprarrenal, osteoporosis, hipertensión, aumento del riesgo de infecciones, retraso en la cicatrización de las heridas, acné, úlceras pépticas, obesidad general y redistribución de la grasa alrededor de la cara (cara de luna llena), hombros y cuello (joroba de búfalo). Pueden aparecer cambios de humor y de la personalidad, y el paciente puede depender psicológicamente del fármaco. Algunos glucocorticoides, incluyendo la hidrocortisona, tienen también actividad mineralocorticoide y pueden producir retención de sodio y agua. Debido a sus propiedades antiinflamatorias, los glucocorticoides pueden enmascarar los signos de infección, conllevando un retraso en el tratamiento antibiótico.
El síndrome de Cushing tiene una alta tasa de mortalidad y el objetivo del tratamiento es identificar y tratar la causa del exceso de la secreción de glucocorticoides. Si la causa es el sobretratamiento con fármacos glucocorticoideos, suele ser suficiente con una reducción gradual de la dosis para revertir el síndrome. Cuando la causa de esta hipersecreción es un tumor suprarrenal o tal vez un tumor ectópico que secreta ACTH, se indica la resección quirúrgica.
Los pacientes que sufran una forma grave necesitan tratamiento farmacológico para disminuir rápidamente los niveles de glucocorticoide en suero. La terapia combinada con aminoglutetimida y metirapona se utiliza a veces. La aminoglutetimida suprime la función suprarrenal en 3 a 5 días; sin embargo, el tratamiento suele limitarse a 3 meses, porque se vuelve ineficaz según pasa el tiempo. Se ha demostrado que el fármaco antifúngico ketoconazol es un tratamiento más seguro a largo plazo. La mayoría de los agentes antisuprarrenales inhiben la conversión metabólica de colesterol a corticoesteroides suprarrenales. No son curativos; su uso es temporal hasta que el tumor se extirpe o, en su caso, se trate con radiación o antineoplásicos.
Consideraciones de enfermería
El papel del profesional de enfermería en el tratamiento antisuprarrenal para el síndrome de Cushing implica un control cuidadoso de la enfermedad del paciente y proporcionarle información relacionada con el tratamiento prescrito. Compruebe los valores de las pruebas de laboratorio, incluyendo el recuento plaquetario, la bilirrubina y la protrombina si hay ictericia, hematomas y sangrado, porque el tratamiento antisuprarrenal puede producir leucopenia y trombocitopenia.
Vigile por si aparece hipotensión ortostática, porque el fármaco disminuye la producción de aldosterona. Vigile por si aparecen mareos y ayude a la deambulación. Advierta al paciente, que cambie lentamente de posición. El ketoconazol administrado con dosis altas es un inhibidor eficaz de los corticoesteroides. Esta medicación se metaboliza en el hígado; por tanto, hay que comprobar la función hepática antes de administrarlo y vigilar durante el tratamiento. El ketoconazol está contraindicado en pacientes con disfunción hepática y en los que abusan del alcohol. Obtenga una historia detallada para descartar la ingesta de alcohol o una posible infección por VIH, porque estas medicaciones están contraindicadas en estos pacientes.
Consideraciones por edades
La aminoglutetimida está contraindicada en el embarazo. En los estudios en animales, se ha demostrado que el fármaco evita la implantación fetal y aumenta la posibilidad de muerte fetal. También en la gestación en animales, el fármaco causa una enfermedad rara llamada seudohermafroditismo, en el que el individuo tiene los órganos reproductores internos de un solo género pero muestra genitales externos masculinos y femeninos. También se ha demostrado que el ketoconazol es teratógeno y embriotóxico con dosis altas en animales.
Educación del paciente
La educación del paciente en relación con el tratamiento con fármacos antisuprarrenales debería incluir los objetivos del tratamiento, los motivos para obtener datos basales como las constantes vitales, la existencia de enfermedades hematológicas subyacentes y las posibles reacciones adversas al fármaco. Incluya los siguientes puntos cuando instruya al paciente sobre el tratamiento con fármacos antisuprarrenales:
- Informar inmediatamente si aparece un sangrado inusual, cambio en el color de las heces o de la orina o coloración amarillenta de los ojos o de la piel.
- Vigilar la temperatura e informar si aparece fiebre.
- Cambiar lentamente de posición para evitar los mareos.
- Tomar la medicación con zumo de frutas o agua para mejorar su absorción.
- Evitar el consumo de alcohol.
- Practicar una anticoncepción fiable e informar al profesional sanitario si se planea o se sospecha un embarazo.
- Acudir a todas las citas programadas y a las visitas al laboratorio para los análisis.
- Practicar técnicas de relajación, porque un aumento del estrés puede producir reacciones adversas al fármaco.