01. Control hormonal del metabolismo de glucosa, grasas y proteínas
Metabolismo de glucosa, grasas y proteínas
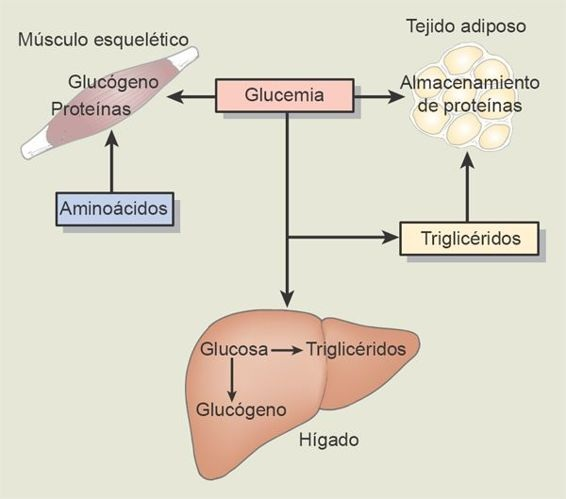
El organismo utiliza glucosa, ácidos grasos y otras sustancias como combustible para satisfacer sus requerimientos energéticos. Si bien los sistemas respiratorio y circulatorio combinan esfuerzos para proveer al organismo del oxígeno que necesita con fines metabólicos, es el hígado, en conjunto con las hormonas derivadas del páncreas endocrino que controla la provisión de combustible del organismo (figura 50-1).
Metabolismo de la glucosa
La glucosa es una molécula de 6 carbonos. Es un combustible tan eficiente que cuando se metaboliza en presencia de oxígeno se degrada para generar dióxido de carbono y agua. Si bien muchos tejidos y sistemas orgánicos son capaces de utilizar otras formas de combustible como los ácidos grasos y las cetonas, el cerebro y el sistema nervioso dependen casi de manera exclusiva de la glucosa como fuente energética. Puesto que el cerebro no puede sintetizar y almacenar más que una provisión de glucosa que dure unos cuantos minutos, la función cerebral normal hace necesaria una provisión continua a partir de la circulación. La hipoglucemia intensa y prolongada puede inducir muerte cerebral, e incluso la hipoglucemia moderada puede causar disfunción cerebral sustancial.
Los tejidos corporales obtienen la glucosa a partir de la sangre. En las personas sin diabetes las concentraciones preprandiales de la glucosa en la sangre se encuentran bajo regulación estricta entre 70 mg/dl y 100 mg/dl (4,4 a 5 mmol/l). Después de una comida las concentraciones de glucosa en la sangre se elevan y se secreta insulina en respuesta a este aumento de la glucosa. Alrededor de 2 terceras partes de la glucosa que se ingiere en una comida se retira de la sangre y almacena en el hígado como glucógeno. Entre comidas, el hígado libera glucosa como medio para mantener la glucemia en su intervalo normal.
La glucosa que no se necesita para la obtención de energía se extrae de la sangre y se acumula en forma de glucógeno o se convierte en grasas. Cuando los tejidos como los del hígado y del músculo esquelético se saturan de glucógeno, la glucosa adicional se convierte en ácidos grasos en el hígado y luego se almacena en forma de triglicéridos en los adipocitos. Cuando el valor de la glucemia cae por debajo de lo normal como ocurre entre las comidas, el glucógeno se degrada por medio de un proceso denominado glucogenólisis, y se libera glucosa. Si bien el músculo esquelético tiene reservas de glucógeno, carece de la enzima glucosa-6-fosfatasa, que permite a la glucosa degradarse en grado suficiente para pasar por la membrana celular e ingresar al torrente sanguíneo, por lo que sólo es útil para la célula muscular.
Además de movilizar sus reservas de glucógeno, el hígado sintetiza glucosa a partir de aminoácidos, glicerol y ácido láctico, en un proceso denominado gluconeogénesis. Esta glucosa puede liberarse en forma directa a la circulación o almacenarse en forma de glucógeno.
Metabolismo lipídico
La grasa es la variante más eficiente para el almacenamiento de combustible al proveer 9 kcal/g de energía almacenada, en comparación con 4 kcal/g que aportan los carbohidratos y las proteínas. Las grasas constituyen una porción significativa de la dieta estadounidense tradicional. Por ende, el consumo de las grasas en el organismo para la obtención de energía tiene tanta importancia como el consumo de los carbohidratos. Además, muchos de los carbohidratos que se consumen en la dieta se convierten en triglicéridos para ser almacenados en el tejido adiposo.
Un triglicérido contiene 3 ácidos grasos unidos por una molécula de glicerol. La movilización de los ácidos grasos para ser utilizados como fuente de energía se facilita gracias a la acción de enzimas (lipasas) que degradan a los triglicéridos para obtener una molécula de glicerol y 3 de ácidos grasos. La molécula de glicerol puede ingresar a la vía glucolítica y luego utilizarse junto con la glucosa para generar energía, o puede aprovecharse para producir glucosa. Los ácidos grasos se transportan hacia los tejidos donde se utilizan para la obtención de energía. Casi todas las células corporales, excepto el cerebro, el tejido nervioso y los eritrocitos, pueden utilizar de manera intercambiable los ácidos grasos y la glucosa para la obtención de energía. Si bien muchas células utilizan los ácidos grasos como fuente de combustible, los ácidos grasos no pueden convertirse en la glucosa que requiere el cerebro para la generación de energía.
Gran parte de la degradación inicial de los ácidos grasos tiene lugar en el hígado, en particular cuando se están utilizando cantidades excesivas de estas sustancias para la obtención de energía. El hígado sólo consume una cantidad pequeña de los ácidos grasos para cubrir sus propios requerimientos energéticos; y convierte al resto en cetonas y las libera hacia la sangre. En las situaciones en que se favorece la degradación de las grasas como en la DM y el ayuno, se liberan grandes cantidades de cetonas hacia el torrente sanguíneo. Debido a que las cetonas son ácidos orgánicos, desencadenan cetoacidosis cuando sus concentraciones son excesivas.
Metabolismo proteico
Las proteínas son esenciales para la integración de todas las estructuras corporales, lo que incluye a los genes, las enzimas, las estructuras contráctiles del músculo, la matriz del hueso, y la hemoglobina de los eritrocitos. Los aminoácidos son los bloques de construcción de las proteínas. Cantidades significativas de aminoácidos se encuentran presentes en las proteínas corporales. A diferencia de la glucosa y los ácidos grasos, existe sólo una capacidad limitada para el almacenamiento de los aminoácidos excedentes en el organismo. La mayor parte de los aminoácidos almacenados se encuentran integrados a proteínas. Los aminoácidos en exceso necesarios para la síntesis proteica se transforman en ácidos grasos, cetonas o glucosa, y luego se almacenan o consumen como combustible metabólico. Puesto que los ácidos grasos no puede convertirse en glucosa, el organismo debe degradar las proteínas y utilizar los aminoácidos como sustrato principal para la gluconeogénesis durante los períodos en que los requerimientos metabólicos exceden el consumo de alimentos.
Hormonas reguladoras de la glucosa
El control hormonal de la glucemia reside en gran medida en el páncreas endocrino. El páncreas está constituido por 2 tipos de tejido principales: los acinos y los islotes de Langerhans (figura 50-2).
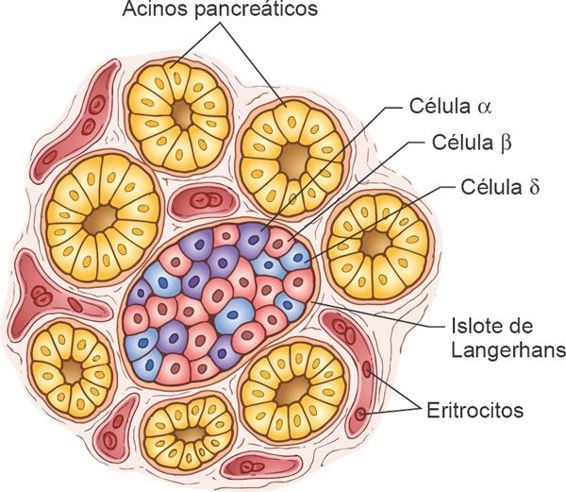
Los acinos secretan jugos digestivos hacia el duodeno, en tanto los islotes de Langerhans liberan hormonas a la sangre. Cada islote está compuesto por células β que secretan insulina y amilina, células α que secretan glucagón, y un número pequeño de células δ que secretan somatostatina.
Además, existe por lo menos otro tipo de célula, la célula PP, presente en números bajos en los islotes que secreta una hormona con función incierta denominada polipéptido pancreático. Esta hormona menos conocida participa en distintas funciones digestivas y pudiera desempeñar algún papel en la regulación de la conducta alimentaria.
Insulina
Si bien se sabe que varias hormonas incrementan la glucemia, la insulina es la única hormona que se sabe tiene un efecto directo para la reducción de las concentraciones de glucosa en la sangre. Las acciones de la insulina son 3:
- Promueve la captación de glucosa en las células blanco y facilita el almacenamiento de glucosa en forma de glucógeno.
- Previene la degradación de las grasas y el glucógeno.
- Inhibe la gluconeogénesis e incrementa la síntesis de proteínas (tabla 50-1).
La insulina actúa para promover el almacenamiento de las grasas al incrementar el trasporte de la glucosa hacia el interior de los adipocitos. También facilita la síntesis de triglicéridos a partir de la glucosa en los adipocitos, e inhibe la degradación intracelular de los triglicéridos almacenados. La insulina también bloquea la degradación de las proteínas e incrementa la síntesis de estas sustancias al aumentar el transporte activo de aminoácidos hacia el interior de las células somáticas. La insulina inhibe la gluconeogénesis, o la obtención de glucosa a partir de otras fuentes, en particular los aminoácidos. Cuando existen cantidades suficientes de glucosa e insulina, la degradación de proteínas es mínima debido a que el organismo es capaz de utilizar la glucosa y los ácidos grasos como fuente de combustible. En los niños y los adolescentes la insulina es necesaria para el crecimiento y el desarrollo normales.
La forma activa de la insulina está compuesta por 2 cadenas polipeptídicas: una cadena A y una cadena B (figura 50-3).
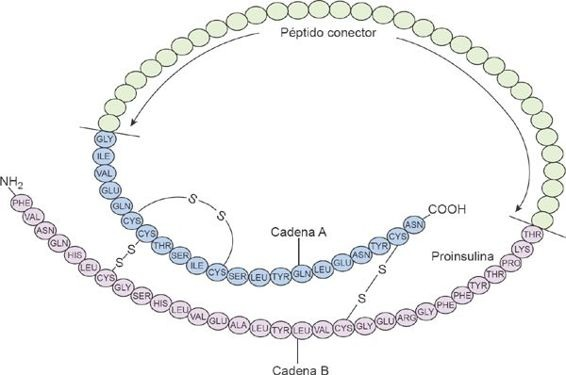
La insulina activa se forma en las células β a partir de una molécula más grande denominada proinsulina. La forma activa de la insulina se produce a partir de la modificación de la proinsulina, mediante la escisión de la estructura péptido C que une a las cadenas A y B. Las cadenas de péptido C pueden cuantificarse en el medio clínico y este valor aplicarse para estudiar la función de las células β. Por ejemplo, las personas con diabetes mellitus tipo 2 con función remanente escasa o nula de las células β del páncreas, muestran concentraciones muy bajas o nulas de péptido C en la sangre. Así, estos individuos tienen probabilidad de requerir restitución de insulina como tratamiento.
Las concentraciones de la glucosa en la sangre regulan la liberación de insulina a partir de las células β del páncreas. Las concentraciones de insulina se incrementan al tiempo que se eleva la glucemia, y disminuyen cuando las concentraciones de glucosa en la sangre disminuyen. La glucosa de la sangre ingresa a la célula β mediante un transportador de glucosa específico (GLUT-2). Es entonces que se fosforila mediante la acción de una enzima denominada glucocinasa, para obtener trifosfato de adenosina (ATP), que se requiere para cerrar los canales del potasio y despolarizar a la célula. La despolarización conduce a la apertura de los canales del calcio y la secreción de insulina.
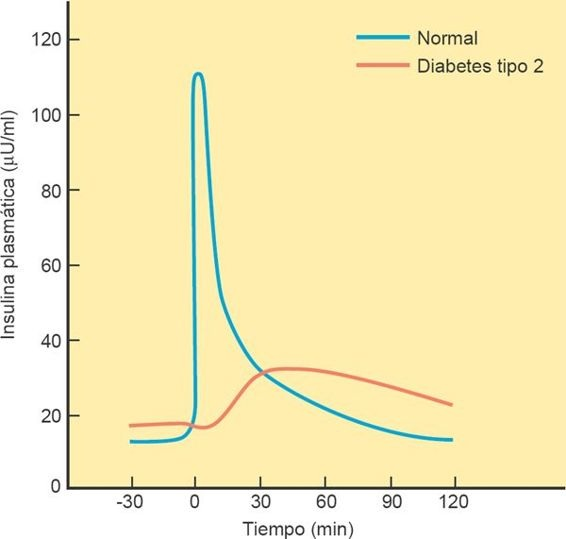
La secreción de insulina tras la exposición a la glucosa ocurre con un patrón bifásico y pulsátil con una liberación inicial rápida de insulina preformada a la que le sigue una liberación más sostenida de insulina recién sintetizada. Después de la exposición a la glucosa, que es un nutrimento secretagogo, ocurre una liberación de primera fase de la insulina preformada almacenada, seguida por una liberación de segunda fase de insulina recién sintetizada. La diabetes puede derivar de una regulación anómala en las pases o una insuficiencia de este proceso (figura 50-4).
La insulina que secretan las células β ingresa a la circulación portal y viaja en forma directa al hígado, donde alrededor del 50% se utiliza o degrada. La insulina se une con rapidez a los tejidos periféricos o se destruye en el hígado o los riñones y tiene una vida media aproximada de 15 min una vez que se libera a la circulación general. Para iniciar sus efectos en los tejidos blanco, la insulina se une a un receptor de la membrana.
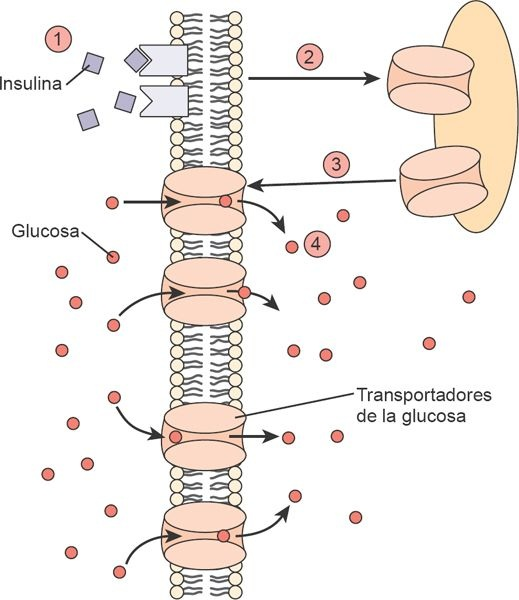
Puesto que las membranas celulares son impermeables a la glucosa, una familia de transportadores de glucosa interviene el movimiento de este azúcar desde la sangre hasta el interior de las células. Estos transportadores desplazan la glucosa a través de la membrana celular a una velocidad mayor que la que podría alcanzarse mediante su difusión. Estos transportadores de glucosa denominados GLUT-1, GLUT-2 y así sucesivamente, tienen una distribución tisular única. Por ejemplo, el GLUT-4 es el transportador de glucosa sensible a la insulina en el músculo esquelético y el tejido adiposo (figura 50-5). Se encuentra retenido en el interior de la membrana de estas células y es incapaz de actuar como un transportador para la glucosa hasta que una señal de la insulina lo hace desplazarse desde su sitio inactivo hasta la membrana celular donde facilita el ingreso de la glucosa.
Glucagón
El glucagón es una molécula polipeptídica sintetizada por las células α de los islotes de Langerhans, mantiene los valores de la glucemia entre las comidas y en los períodos de ayuno. El glucagón viaja por la vena porta hasta el hígado donde ejerce su acción principal. A diferencia de la insulina, el glucagón provoca un incremento de la glucemia (tabla 50-1). El efecto fisiológico principal del glucagón es el incremento de las concentraciones de la glucosa en el plasma. El efecto más radical del glucagón es su capacidad para dar inicio a la glucogenólisis, o la degradación del glucógenohepático como medio para incrementar la glucemia en cuestión de minutos. El glucagón también aumenta el trasporte de aminoácidos hacia el hígado y estimula su conversión en glucosa, que es un proceso denominado gluconeogénesis. Debido a que las reservas hepáticas de glucógeno son limitadas, la gluconeogénesis es importante para el mantenimiento de las concentraciones de la glucosa en la sangre en el transcurso del tiempo.
Al igual que la insulina, la secreción del glucagón se regula con base en la glucemia. Una disminución de la concentración de la glucosa en la sangre hasta el grado de la hipoglucemia que genera un incremento inmediato de la secreción de glucagón, en tanto un aumento de la glucosa en la sangre hasta un nivel de hiperglucemia genera una reducción de la secreción del glucagon. Las concentraciones de glucagón también aumentan durante el ejercicio extenuante como medio para prevenir una disminución de la glucemia.
Amilina, somatostatina y hormonas derivadas del intestino
El polipéptido amiloide de los islotes, o amilina, es una hormona que secretan las células β del páncreas junto con la insulina y el péptido C. Las concentraciones plasmáticas de la amilina aumentan después de una comida o de una infusión de glucosa. La amilina parece actuar junto con la insulina para regular las concentraciones de la glucosa en el torrente sanguíneo al suprimir la secreción posprandial de glucagón y reducir la velocidad del vaciamiento gástrico.
La somatostatina es una hormona polipeptídica que sólo contiene 14 aminoácidos y tiene acción local en los islotes de Langerhans. Las comidas ricas en grasas, en carbohidratos y en particular en proteínas, estimulan la liberación de la somatostatina; y la insulina inhibe su liberación. La somatostatina también reduce la actividad intestinal tras la ingestión de los alimentos. La contribución que hace la somatostatina a la liberación de insulina y glucagón no se encuentra bien establecida, y la regulación de la liberación de esta hormona ha probado ser difícil de estudiar por efecto del número 3 bajo de células del islote que la sintetizan.
Se han identificado varias hormonas derivadas del intestino que cuentan con lo que se denomina efecto de incretina, que implica un incremento en la liberación de insulina después de una carga oral de nutrimentos. Esto sugiere que los factores derivados del intestino pueden estimular la secreción de insulina después de una comida con predominio de carbohidratos. El efecto de la incretina genera alrededor del 50% de la secreción de insulina tras una comida y por ende desempeña un papel prominente en el metabolismo posprandial. Estas hormonas con efecto de incretina han constituido el centro de la investigación en los años recientes, y los medicamentos derivados de la incretina han mostrado tener efectos benéficos como la mejoría del control de la glucemia, el fomento de la saciedad, el retraso del vaciamiento gástrico y la pérdida ponderal.
Hormonas contrarreguladoras
Otras hormonas que pueden afectar la glucemia son las catecolaminas, la hormona del crecimiento y los glucocorticoides. Estas hormonas junto con el glucagón se denominan en ocasiones hormonas contrarreguladoras, puesto que contrarrestan las funciones de almacenamiento de la insulina para la regulación de las concentraciones de la glucosa en la sangre durante los períodos de ayuno, ejercicio y otras situaciones que limitan el consumo de glucosa o depletan sus reservas.
Adrenalina
La adrenalina que deriva de la médula suprarrenal ayuda a mantener las concentraciones de la glucosa en la sangre durante los períodos de estrés. La adrenalina, una catecolamina, es una inductora potente de la glucogenólisis en el hígado que hace que grandes cantidades de glucosa se liberen a la sangre. También inhibe la liberación de la insulina a partir de las células β y con ello reduce el desplazamiento de la glucosa hacia el interior de los miocitos, mientras que al mismo tiempo incrementa la degradación de las reservas musculares de glucógeno. No obstante, la glucosa que se libera a partir del glucógeno muscular no puede liberarse a la sangre, la movilización de estas reservas para su utilización en el músculo permite reservar la glucosa de la sangre para que sea utilizada por otros tejidos como el cerebro y el sistema nervioso. La adrenalina también tiene un efecto lipolítico directo sobre las células adiposas de manera que incrementa la movilización de los ácidos grasos para utilizarse como fuente de energía. El efecto hiperglucemiante que tiene la adrenalina también es un mecanismo homeostático importante durante los períodos de hipoglucemia.
Hormona del crecimiento
La hormona del crecimiento tiene muchos efectos metabólicos. Aumenta la síntesis de proteínas en todas las células del organismo, moviliza los ácidos grasos a partir del tejido adiposo, y antagoniza los efectos de la insulina. El efecto fisiológico más importante de la hormona del crecimiento es la estimulación del crecimiento longitudinal, mediante el incremento de la formación de hueso y cartílago nuevos. La secreción de la hormona del crecimiento se inhibe por medio de la insulina y del aumento de las concentraciones de la glucosa en la sangre. Durante los períodos de ayuno cuando caen tanto las concentraciones de glucosa en la sangre como la secreción de insulina, las concentraciones de la hormona del crecimiento se elevan. El ejercicio como correr y andar en bicicleta, y distintas condiciones de estrés, como la anestesia, la fiebre y el traumatismo, aumentan las concentraciones de la hormona del crecimiento. La hipersecreción crónica de la hormona del crecimiento como en el caso de la acromegalia, puede inducir intolerancia a la glucosa y desarrollo de DM. La síntesis de la hormona del crecimiento es pulsátil y sus niveles circulantes aumentan durante la niñez, alcanzan un máximo durante la pubertad y disminuyen con el envejecimiento.
Hormonas glucocorticoides
Las hormonas glucocorticoides que se sintetizan en la corteza suprarrenal junto con otras hormonas corticoesteroides son críticas para la sobrevivencia durante los períodos de ayuno e inanición. Estimulan la gluconeogénesis hepática y generan un aumento de la síntesis hepática de glucosa. El papel principal de estas hormonas es aumentar la glucosa en la sangre. Los glucocorticoides también modulan la respuesta inmunitaria y ejercen una respuesta antiinflamatoria general. El consumo de glucocorticoides sintéticos como la prednisona, es un tratamiento común para los trastornos inflamatorios, que tiene impacto subsecuente sobre las concentraciones de la glucosa en la sangre.
Existen varias hormonas esteroideas con actividad glucocorticoide. La más importante entre ellas es el cortisol, que genera alrededor del 95% de toda la actividad glucocorticoide. Casi cualquier tipo de estrés, ya sea físico o emocional, determina un incremento inmediato de la secreción de hormona adrenocorticotrópica (HACT) a partir del lóbulo anterior de la hipófisis, al que sigue pocos minutos después un gran aumento de la secreción de cortisol a partir de la glándula suprarrenal. La hipoglucemia es un estímulo potente para la secreción del cortisol.