02. Diabetes Mellitus
La diabetes mellitus (DM) hace referencia a un grupo de trastornos metabólicos que comparten la característica de la hiperglucemia. Antes del descubrimiento de la insulina, en la década de los 20, la DM era una enfermedad mortal. La incidencia de la diabetes mellitus tipo 2 se ha incrementado en forma radical durante el último siglo, y seguirá aumentando en Estados Unidos ante la prevalencia creciente de la obesidad, el envejecimiento de la población, la disminución de la mortalidad y el crecimiento de las poblaciones minoritarias.
La DM es un trastorno del metabolismo de los carbohidratos, las proteínas y las grasas, que deriva de un desequilibrio entre la disponibilidad y los requerimientos de insulina. Los factores que contribuyen al desequilibrio incluyen la reducción de la secreción de la insulina, la disminución del empleo de la glucosa, y el aumento de la síntesis de glucosa. Una persona con DM no controlada es incapaz de transportar la glucosa hacia el interior de las células adiposas y musculares. Como consecuencia las células del organismo sufren inanición, y se incrementa la degradación de las grasas y las proteínas para obtener combustibles alternativos.
Clasificación y etiología
Si bien la DM es sin duda un trastorno de la disponibilidad de insulina, no se trata de una sola enfermedad. El Expert Committee on the Diagnosis and Classification of Diabetes Mellitus desarrolló un sistema revisado para la clasificación de la diabetes en 1997 (recuadro 50-1).
Recuadro 50-1. Clasificación etiológica de la diabetes mellitus
Diabetes tipo 1 (destrucción de células β, insuficiencia absoluta de insulina)
- A. De mediación inmunitaria.
- B. Idiopática.
Diabetes tipo 2 (resistencia a la insulina con insuficiencia relativa de la hormona)
Otros tipos específicos
- Defectos genéticos de la función de las células β (ej. diabetes juvenil de inicio en la madurez).
- Defectos genéticos que afectan la acción de la insulina (ej. resistencia tipo A a la insulina).
- Trastornos del páncreas exocrino.
- Endocrinopatías (ej. enfermedad de Cushing, acromegalia).
- Inducida por fármacos o químicos (ej. glucocorticoides).
- Infecciones (ej. citomegalovirus, virus de la rubéola).
- Otros síndromes genéticos (ej. síndrome de Turner syndrome, síndrome de Dawn).
Diabetes mellitus gestacional
Las 2 categorías amplias de la DM son la tipo 1 y la tipo 2. A la diabetes tipo 2 corresponden en la actualidad alrededor del 90% al 95% de los casos de diabetes. Otras categorías de DM son la diabetes gestacional (DMG; es decir, diabetes que se desarrolla durante el embarazo) y otros tipos específicos de diabetes, de los cuales muchos son secundarios a otras afecciones (ej. síndrome de Cushing, acromegalia, pancreatitis).
El sistema de clasificación revisado incluye también un sistema para el diagnóstico de la DM con base en las fases de la intolerancia a la glucosa (tabla 50-2). Los criterios revisados reconocen a un grupo de personas cuyas concentraciones de glucosa, que aunque no cubren los criterios para la diabetes, son demasiado altas para considerarse normales. Estos individuos que en conjunto se considera padecen prediabetes, incluye a las personas con intolerancia a la glucosa (IG), y con anomalías de la glucemia preprandial (AGP). Una glucosa plasmática preprandial (GPP) menor de 100 mg/dl (5,5 mmol/l) o una prueba de tolerancia oral a la glucosa (PTOG) de 2 h con un resultado inferior a 140 mg/dl se consideran normales. La IG corresponde a cuantificaciones anómalas de la glucosa en el plasma (140 mg/dl a 199 mg/dl [7,8 a 11 mmol/l]) 2 h después de recibir en promedio una carga oral de glucosa de 75 g. La AGP se define por una elevación de la concentración de la GPP (100 mg/dl a 125 mg/dl [5,6 mmol/l a 6,9 mmol/l]). Las categorías de IG e AGP (es decir, prediabetes) se relacionan con un aumento del riesgo de cardiopatía ateroesclerótica y de progresión a diabetes mellitus tipo 2. En tanto la IG y la AGP tienen tasas distintas de evolución a diabetes como consecuencia de sus mecanismos fisiopatológicos. Los criterios que se muestran en el recuadro 50-2 se utilizan para confirmar el diagnóstico en las personas con prediabetes. Las intervenciones que se aplican en los individuos con prediabetes, como la reducción calórica, el incremento de la actividad física y la pérdida ponderal, resultan benéficas para disminuir el riesgo de desarrollo de la enfermedad.
Recuadro 50-2. Criterios para el diagnóstico de la diabetes mellitus
- HbA1c* ≥ 6,5%.
- GPP ≥ 126 mg/dl (7,0 mmol/l). El ayuno se define como la ausencia de consumo calórico durante por lo menos 8 h.
- Glucemia plasmática a las 2 h en una PTOG ≥ 200 mg/dl (11,1 mmol/l).
- En una persona con síntomas clásicos de hiperglucemia o una crisis hiperglucémica, cuantificación aleatoria de glucemia en plasma ≥200 mg/dl (11,1 mmol/l).
Diabetes mellitus tipo 1
La diabetes tipo 1 se caracteriza por la destrucción de las células β del páncreas. La diabetes tipo 1 puede subdividirse en 2 variedades: diabetes tipo 1A de mediación inmunitaria y diabetes tipo 1B idiopática (sin correlación inmunitaria). En Estados Unidos y Europa alrededor del 90% al 95% de las personas con diabetes tipo 1 padece diabetes tipo 1A de mediación inmunitaria. El desarrollo de la diabetes tipo 1B es menos común y no parece tener un componente autoinmunitario. Desde la perspectiva terapéutica no se diferencian las variedades de la diabetes tipo 1.
Diabetes mellitus tipo 1A de mediación inmunitaria
La diabetes tipo 1A, que se denomina con frecuencia tan sólo como diabetes tipo 1, se caracteriza por la destrucción de mediación inmunitaria de las células β. Este tipo de diabetes, denominada antes diabetes juvenil, ocurre las más de las veces en individuos jóvenes pero puede presentarse a cualquier edad. La velocidad de destrucción de las células β es bastante variable, siendo rápida en algunos individuos y lenta en otros. La variante con progresión rápida se observa con frecuencia en niños pero también puede desarrollarse en adultos.
La variante de progresión lenta suele ocurrir en adultos y en ocasiones se denomina diabetes autoinmunitaria latente del adulto (DALA).
La diabetes tipo 1 es un trastorno metabólico que se caracteriza por una carencia absoluta de insulina, una elevación de la glucemia, y una degradación de las grasas y las proteínas corporales.
La carencia absoluta de insulina en personas con diabetes tipo 1 implica que tienen una tendencia particular al desarrollo de cetoacidosis. Una de las acciones de la insulina es la inhibición de la lipólisis (es decir, la degradación de las grasas) y la liberación de ácidos grasos libres (AGL) a partir de los adipocitos. En la ausencia de insulina se desarrolla cetosis, cuando estos ácidos grasos se liberan a partir de los adipocitos y se convierten en cetonas en el hígado. Por efecto de la pérdida de la respuesta a la insulina, todos los pacientes con diabetes tipo 1A requieren restitución con insulina exógena para revertir el estado catabólico, controlar los niveles de glucemia y prevenir la cetosis.
Se piensa que la diabetes tipo 1A es un trastorno autoinmunitario que deriva de una predisposición genética (es decir, genes diabetogénicos), un suceso desencadenante ambiental como una infección, y una reacción de hipersensibilidad mediada por linfocitos T contra algún antígeno de la célula β. La susceptibilidad a la diabetes tipo 1A implica a genes múltiples. El gen de mayor susceptibilidad para la diabetes tipo 1A se ubica en la región de los antígenos leucocitarios humanos (ALM) del cromosoma 6. Gran parte de la evidencia se concentra en los genes hereditarios del complejo mayor de histocompatibilidad (CMH) en el cromosoma 6 que codifican los ALM. Si bien el riesgo de desarrollar diabetes tipo 1 es 10 veces mayor en parientes de individuos con el trastorno, el riesgo general es más bien bajo. Alrededor del 3% al 4% de los niños desarrolla diabetes tipo 1 cuando un progenitor padece la enfermedad. Los autoanticuerpos de la diabetes se han utilizado para predecir el riesgo de diabetes tipo 1 y para clasificar a las personas con DM que cuentan con un proceso destructivo de mediación inmunitaria de las células β.
Es posible la existencia de autoanticuerpos relacionados con la diabetes tipo 1A varios años antes del desarrollo de hiperglucemia. Existen 2 tipos principales de autoanticuerpos: autoanticuerpos contra insulina (AAI) y autoanticuerpos contra las células del islote, y anticuerpos dirigidos contra otros antígenos del islote, lo que incluye a la descarboxilasa del ácido glutámico (DAG) y la fosfatasa de la tirosina de las proteínas IA-2. Las pruebas para detección de anticuerpos contra DAG o IA-2, y para AAI mediante el empleo de ensayos de radioenlace sensibles permite identificar más del 85% de los casos de diabetes tipo 1, nuevos o a futuro. La aparición de AAI puede preceder a la de los anticuerpos contra DAG o IA-2, y los AAI pueden ser los únicos anticuerpos detectados en el momento del diagnóstico en niños pequeños. Estas personas también pueden padecer otros trastornos autoinmunitarios, como enfermedad de Graves, artritis reumatoide y enfermedad de Addison. La investigación continúa para identificar el papel de los autoanticuerpos de la diabetes en las intervenciones futuras para la diabetes tipo 1.
El hecho de que se sospeche que la diabetes tipo 1 deriva de una interacción entre factores genéticos y ambientales condujo a investigar estrategias dirigidas a la prevención y el control temprano de la enfermedad. Estas estrategias incluyen la identificación de personas con susceptibilidad genética y la intervención temprana en individuos con diagnóstico reciente de diabetes tipo 1. Una vez que se establece el diagnóstico de diabetes tipo 1, existe con frecuencia un período breve de regeneración de las células β, durante el cual desaparecen los síntomas de la diabetes y disminuye la necesidad de las inyecciones de insulina, o bien se anula. A esta fase en ocasiones se le denomina período de la luna de miel. Las intervenciones inmunitarias (inmunomodulación) diseñadas para interrumpir la destrucción de las células β antes del desarrollo de la diabetes tipo 1 se están investigando en varios estudios clínicos. Desafortunadamente ninguna de las intervenciones analizadas hasta la fecha ha demostrado utilidad clínica real.
Diabetes mellitus tipo 2 y el síndrome metabólico
La diabetes tipo 2 es responsable de la mayor parte de los casos de diabetes, alrededor del 90% al 95%. Se trata de una condición heterogénea que describe la presencia de hiperglucemia asociada a una insuficiencia relativa de insulina. No ocurre una destrucción autoinmunitaria de las células β. Si bien muchos individuos con diabetes tipo 2 son adultos y presentan sobrepeso, las tendencias recientes indican que la diabetes tipo 2 se ha convertido en una afección más frecuente en adolescentes y niños obesos. De igual manera, las personas con diabetes tipo 2 con el tiempo pueden requerir insulina. Por lo tanto, los términos previos relacionados con la diabetes tipo 2, como diabetes de inicio en el adulto y diabetes no dependiente de insulina, pueden generar confusión y por ende resultan obsoletos.
La diabetes tipo 2 tiene un componente genético fuerte. Se ha implicado a distintos factores genéticos y patogénicos adquiridos en la disfunción progresiva de las células β en personas con prediabetes y diabetes tipo 2. En las personas con un progenitor con diabetes tipo 2 aumenta el riesgo de desarrollar el padecimiento. Si los 2 progenitores padecen el trastorno, el riesgo se aproxima al 40%. No obstante una predisposición familiar intensa, la genética de la diabetes tipo 2 aún se encuentra mal definida. La investigación en el campo de la diabetes tipo 2 ha identificado alteraciones genéticas relacionadas con secreciones anómalas de insulina, pero estos estudios continúan.
Las anomalías metabólicas que conducen a la diabetes tipo 2 incluyen:
- Resistencia a la insulina.
- Anomalías de la secreción de insulina a partir de las células β del páncreas.
- Aumento de la síntesis de glucosa en el hígado (figura 50-6).
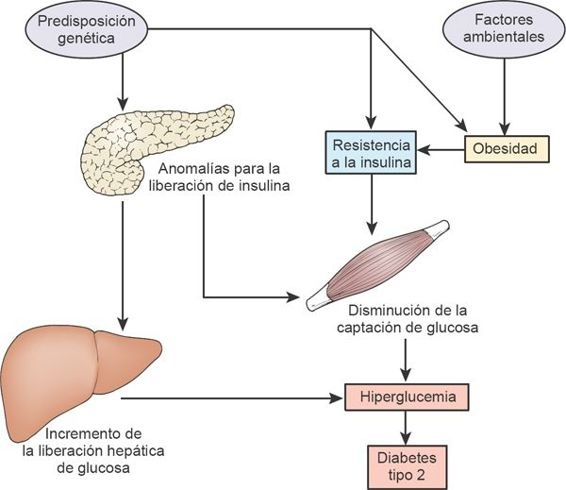
En contraste con la diabetes tipo 1, en que existe una insuficiencia absoluta de insulina, los individuos con diabetes tipo 2 pueden tener concentraciones altas, normales o bajas de insulina. La resistencia a la insulina consiste en la disminución de la capacidad de la hormona para actuar de manera efectiva sobre los tejidos blanco, en particular el músculo, el hígado y el tejido adiposo. Es la característica predominante de la diabetes tipo 2 y deriva de una combinación de factores, como la susceptibilidad 9 genética y la obesidad. En la tabla 50-3 se comparan las características de la diabetes tipo 1 y tipo 2.
Al inicio, la resistencia a la insulina promueve un aumento de la secreción de la hormona sube con frecuencia y hasta un nivel de hiperinsulinemia modesta, al tiempo que las células β intentan mantener la concentración normal de la glucosa en la sangre. Al pasar el tiempo el aumento de la demanda para la secreción de insulina conduce al agotamiento y al fallo de las células β. Esto trae como consecuencia una elevación de las concentraciones preprandiales de glucosa en sangre y con el tiempo un aumento de la síntesis de glucosa en el hígado. Puesto que los individuos con diabetes tipo 2 no tienen una insuficiencia absoluta de insulina, tienen menos tendencia a la cetoacidosis en comparación con los pacientes con diabetes tipo 1.
En el estado basal, la resistencia hepática a la insulina se manifiesta por la sobreproducción de glucosa, no obstante la presencia de hiperinsulinemia preprandial, siendo la velocidad de síntesis de glucosa el determinante principal de la elevación de la GPP en personas con diabetes tipo 2. Si bien la resistencia a la insulina identificada en individuos con diabetes tipo 2 puede derivar de distintos factores, muestra una asociación intensa con la obesidad y la inactividad física.
Las causas específicas de la disfunción de las células β no son claras, pero parecen incluir una disminución inicial de la masa de células β relacionada con factores genéticos o prenatales (ej. retraso del crecimiento intrauterino), incremento de la apoptosis o disminución de la regeneración de las células β, agotamiento de las células β por resistencia crónica a la insulina, glucotoxicidad (es decir, desensibilización de las células β por toxicidad inducida por glucosa), lipotoxicidad (es decir, efectos tóxicos de los lípidos sobre las células β), y deposito amiloide u otras condiciones que tienen potencial de disminuir la masa de células β.
Resistencia a la insulina y el síndrome metabólico
Existe evidencia creciente que sugiere que la resistencia a la insulina no sólo contribuye a la hiperglucemia en los individuos con diabetes tipo 2, sino que pudiera desempeñar algún papel sobre otras anomalías metabólicas. Éstas incluyen obesidad, concentraciones plasmáticas altas de triglicéridos y bajas de lipoproteínas de alta densidad (LAD), hipertensión, inflamación sistémica (según lo revelan la proteína C reactiva [PCR] y otros mediadores), fibrinólisis anómala, anomalías funcionales del endotelio vascular y enfermedad macrovascular (enfermedad arterial coronaria, cerebrovascular y periférica). Esta constelación de anomalías se denomina con frecuencia síndrome de resistencia a la insulina, síndrome X o, el concepto preferido, síndrome metabólico. Los signos clínicos, las anomalías de laboratorio y las afecciones relacionadas que se asocian a este síndrome se describen en el recuadro 50-3. La resistencia a la insulina y el aumento del riesgo de desarrollo de diabetes tipo 2 también se identifican en mujeres con síndrome de ovario poliquístico.
Recuadro 50-3. Hallazgos concurrentes y frecuentes en personas con resistencia a la insulina o síndrome metabólico
Signos clínicos:
- Obesidad central (región superior del cuerpo) con aumento del perímetro abdominal.
- Acantosis nigricans (cambios cutáneos con hiperpigmentación e hipertrofia).
Anomalías de laboratorio:
- Elevación de la glucemia preprandial, posprandial o ambas.
- Resistencia a la insulina con hiperinsulinemia.
- Dislipidemia con incremento de triglicéridos y disminución del colesterol en LAD.
- Anomalías de la trombólisis.
- Hiperuricemia.
- Disfunción endotelial y del músculo liso vascular.
- Albuminuria.
Afecciones comórbidas:
- Hipertensión.
- Ateroesclerosis.
- Hiperandrogenismo con síndrome de ovario poliquístico.
Un factor importante en los individuos con síndrome metabólico que conduce a la diabetes tipo 2 es la obesidad. Alrededor del 80% al 90% de las personas con diabetes tipo 2 presenta sobrepeso. Los individuos obesos muestran aumento de la resistencia a la acción de la insulina y compromiso de la supresión de la síntesis hepática de glucosa, lo que da origen tanto a hiperglucemia como a hiperinsulinemia. El tipo de obesidad es una consideración relevante para el desarrollo de la diabetes tipo 2. Se ha encontrado que los individuos con obesidad de la porción superior del cuerpo (o central) tienen un riesgo más alto de desarrollar diabetes tipo 2 y trastornos metabólicos que aquéllos con obesidad en la región inferior del cuerpo (o periférica). El perímetro abdominal y la relación abdomen-cadera (RAC), que son medidas sustitutivas de la obesidad central, han demostrado una correlación adecuada con la resistencia a la insulina. Para su manejo, debe incorporarse al plan terapéutico la pérdida ponderal, con una reducción inicial del 5% al 10% del peso corporal, así como la atención de la diabetes y de las anomalías metabólicas relacionadas.
Se postula la teoría de que la resistencia a la insulina y el aumento de la síntesis de glucosa en las personas obesas con diabetes tipo 2 pudieran derivar de un aumento de la concentración de los AGL. Esto tiene varias consecuencias:
- La elevación excesiva y crónica de los AGL puede inducir disfunción de las células β(lipotoxicidad).
- Los AGL actúan sobre los tejidos periféricos para inducir resistencia a la insulina y subutilización de la glucosa al inhibir su captación y el almacenamiento del glucógeno.
- La acumulación de los AGL y los triglicéridos reduce la sensibilidad del hígado a la insulina, lo que determina un aumento de la síntesis hepática de glucosa e hiperglucemia, en particular en el estado de ayuno.
De esta manera, el incremento de los AGL que se observa en individuos con obesidad (en particular, de tipo visceral) y predisposición genética a la diabetes tipo 2 pudiera con el tiempo conducir a la disfunción de las células β, al aumento de la resistencia a la insulina y a una síntesis mayor de glucosa en el hígado. Una consecuencia adicional es la desviación de los AGL excesivos hacia tejidos distintos al adiposo, lo que incluye al hígado, el músculo esquelético, el corazón y las células β del páncreas. En el hígado, la captación de los AGL a partir de la sangre portal puede inducir acumulación hepática de triglicéridos y hepatopatía grasa no alcohólica.
Otros tipos específicos de diabetes
Un porcentaje bajo del número total de casos de diabetes corresponde a variedades específicas del trastorno que se relacionan con ciertas condiciones o síndromes. Este tipo de diabetes puede desarrollarse cuando existe enfermedad pancreática o se extirpa tejido pancreático, así como en los trastornos endocrinos como la acromegalia, el síndrome de Cushing o el feocromocitoma. Los trastornos endocrinos que generan hiperglucemia lo hacen al aumentar la síntesis hepática de glucosa o reducir la utilización celular del azúcar. Varios tipos específicos de diabetes se relacionan con defectos monogenéticos de la función de las células β. Otras causas de diabetes pueden ser defectos genéticos de la función de las células β o de la secreción de insulina, tratamientos farmacológicos o sustancias químicas.
Varios medicamentos que se utilizan con frecuencia para el tratamiento de otros trastornos pueden inducir alteraciones relevantes de la glucemia. Por ejemplo, los diuréticos, de manera particular los tiazídicos y los de asa pueden elevar la glucemia. Estos diuréticos aumentan la pérdida de potasio, que se piensa altera la liberación de insulina a partir de las células β. Otros fármacos y t que se sabe inducen hiperglucemia son el diazóxido, los glucocorticoides, los anticonceptivos orales, los fármacos antipsicóticos y la nutrición parenteral total (es decir, lahiperalimentación). Los incrementos de la glucemia relacionados con fármacos suelen revertirse una vez que el medicamento se suspende, no obstante en muchos casos éstos se utilizan para tratar afecciones crónicas y deben tomarse en consideración para el control a largo plazo de la glucemia.
Diabetes gestacional
La DMG corresponde a cualquier grado de intolerancia a la glucosa que se presenta de manera inicial durante el embarazo. La DMG se identifica en cerca del 7% de todos los embarazos. Ocurre con más frecuencia en mujeres afroamericanas, hispanas o latinoamericanas e indias estadounidenses. Las más de las veces afecta a:
- Mujeres con antecedente familiar de diabetes.
- Mujeres con antecedente de óbito fetal o aborto espontáneo.
- Mujeres que tuvieron un neonato con alguna anomalía fetal en un embarazo previo.
- Mujeres que tuvieron un neonato con peso alto para la edad gestacional.
- Mujeres obesas.
- Mujeres con edad avanzada.
- Mujeres con 5 o más embarazos.
Diagnóstico
En vista de la incidencia creciente de la obesidad y del desarrollo de diabetes tipo 2 en poblaciones más jóvenes, la ADA estableció directrices revisados para la DMG. Un estudio epidemiológico multinacional reciente demostró que el riesgo de evolución maternofetal o neonatal adversa se incrementa en proporción directa a la glucemia en la madre. Este estudio, el Hyperglycemia and Adverse Pregnancy Outcomes (HAPO), influyó sobre las recomendaciones nuevas que indican que todas las mujeres deben ser sometidas a pruebas para detección de DMG entrelas 24 y las 28 semanas mediante una PTOG con 75 g de glucosa.
A la ingestión de glucosa le sigue la toma de muestras de sangre venosa para cuantificar la concentración del azúcar a intervalos de 1 h y 2 h (ADA). Si la concentración de la glucosa en el plasma es superior a 92 mg/dl (5,1 mmol/l) en el estado de ayuno, de 180 mg/dl (10 mmol/l) a la primera hora o de 153 mg/dl (8,5 mmol/l) a las 2 h, se establece el diagnóstico de DMG (tabla 50-4).
Lo más probable es que estos estándares nuevos generen un incremento significativo del número informado de mujeres con DMG, pero permitirá un mejor control de la glucemia. Las mujeres que cuentan con factores de riesgo para diabetes necesitan ser sometidas a prueba en su primera consulta prenatal y luego deben clasificarse como pacientes con diabetes tipo 2 si el caso lo amerita. El diagnóstico y el manejo médico cuidadosos resultan esenciales debido a que las mujeres con DMG tienen un riesgo más alto de sufrir complicaciones durante el embarazo, mortalidad y trastornos neonatales. Los trastornos neonatales incluyen macrosomía (es decir, tamaño corporal mayor que el normal), hipoglucemia, hipocalcemia, policitemia e hiperbilirrubinemia.
Tratamiento
El tratamiento de la DMG incluye la observación estrecha de la madre y el feto debido a que se ha demostrado que incluso la hiperglucemia leve va en detrimento para el feto. Deben cuantificarse con regularidad los valores preprandiales y posprandiales de glucemia en la madre. La vigilancia fetal depende del grado de riesgo para el feto. La frecuencia de las cuantificaciones del crecimiento y para detección del sufrimiento fetal depende de la tecnología disponible y de la edad gestacional. Todas las mujeres con DMG requieren orientación nutricional, puesto que la nutrición es la piedra angular del tratamiento. El plan nutricional debe aportar los nutrimentos necesarios para la salud materna y fetal, permitir la normoglucemia y una ganancia ponderal apropiada, y prevenir las cetosis. No todas las mujeres son capaces de mantener la normoglucemia sólo con el plan nutricional. Para quienes requieren apoyo adicional se justifica la administración de medicamentos.
La insulina ha sido durante mucho tiempo el tratamiento de elección cuando su producción endógena es insuficiente. Además, se considera que en la actualidad el fármaco oral gliburida es seguro para su consumo en la DMG. El automonitoreo de la glucemia resulta esencial.
Las mujeres con DMG tienen un riesgo del 35% al 65% de desarrollar diabetes tipo 2 en el transcurso de 20 años después de su embarazo. Los factores de predicción para la diabetes futura o la prediabetes incluyen la obesidad materna, la elevación de la GPP en la PTOG, y los antecedentes familiares. Las mujeres en quienes se diagnostica DMG deben recibir seguimiento tras el parto para detectar el desarrollo de diabetes en una fase temprana de su evolución.
Manifestaciones clínicas de la diabetes mellitus
La DM puede tener un inicio rápido o insidioso. En la diabetes tipo 1 los signos y los síntomas con frecuencia se desarrollan en forma súbita. La diabetes tipo 2 suele desarrollarse con mayor lentitud, y muchas veces existir durante años sin que se le detecte. Su presencia pudiera identificarse durante una valoración médica de rutina o cuando el individuo busca atención médica por otras razones.
Los signos y los síntomas de diabetes que se identifican con más frecuencia se conocen como «las 3 P»:
- Poliuria (es decir, micción excesiva).
- Polidipsia (es decir, sed excesiva).
- Polifagia (es decir, apetito excesivo).
Estos 3 síntomas guardan relación estrecha con la hiperglucemia y la glucosuria que son propios de la diabetes. La glucosa es una molécula pequeña con actividad osmótica. Cuando las concentraciones de la glucosa en la sangre se elevan en grado suficiente, la cantidad de azúcar que se filtra a través del glomérulo renal excede la que puede reabsorberse en los túbulos renales. Esto trae consigo la glucosuria, que se acompaña por grandes pérdidas de agua en la orina. La sed es consecuencia de la deshidratación intracelular que se presenta al tiempo que las concentraciones hemáticas de glucosa aumentan y atraen agua hacia fuera de los cuerpos celulares, lo que incluye a los ubicados en el centro de la sed hipotalámico. Este síntoma temprano puede pasarse por alto con facilidad en las personas con diabetes tipo 2, en particular quienes presentan un incremento gradual de la glucemia.
La polifagia no suele existir en individuos con diabetes tipo 2. En la diabetes tipo 1, quizá se deba a la inanición celular y a la disminución de las reservas celulares de carbohidratos, grasas y proteínas.
La pérdida ponderal no obstante la presencia de un apetito normal o intenso es un fenómeno común en personas con diabetes tipo 1 no controlada. La pérdida ponderal tiene 2 causas. En primer lugar, la pérdida de los líquidos corporales da origen a una diuresis osmótica. El vómito puede exagerar la pérdida hídrica en la cetoacidosis. En segundo lugar, los tejidos corporales se pierden debido a que la carencia de insulina obliga al organismo a utilizar sus reservas de grasa y las proteínas celulares como fuentes de energía. Desde la perspectiva de la pérdida de peso, existe con frecuencia una diferencia marcada entre la diabetes tipo 2 y la diabetes tipo 1. La pérdida ponderal es un fenómeno frecuente en individuos con diabetes tipo 1 no controlada, en tanto que muchas personas con diabetes tipo 2 no complicada presentan con frecuencia problemas de obesidad. A pesar de esto, quienes padecen diabetes tipo 2 no diagnosticada pudieran experimentar una pérdida ponderal inexplicable debido a que la insulina circulante no se está utilizando, lo que conduce a la disminución de las fuentes energéticas.
Otros signos y síntomas de la hiperglucemia son la visión borrosa recurrente, la fatiga y las infecciones cutáneas. En la diabetes tipo 2, estos son con frecuencia los síntomas que inducen al individuo a solicitar atención médica. La visión borrosa se desarrolla al tiempo que el cristalino y la retina se exponen a los fluidos hiperosmolares. La disminución del volumen plasmático induce debilidad y fatiga. Pueden ocurrir infecciones crónicas de la piel, y son más frecuentes en personas con diabetes tipo 2. La hiperglucemia y la glucosuria favorecen el crecimiento de las levaduras. Las infecciones por Candida son manifestaciones tempranas y frecuentes en mujeres con diabetes.
Pruebas diagnósticas
El diagnóstico de la DM se confirma por medio de la realización de pruebas de laboratorio que cuantifican las concentraciones de la glucosa en la sangre (tabla 50-2). Debe considerarse la solicitud de estudios de laboratorio para la detección de diabetes en todas las personas de 45 años o más. Debe valorarse la solicitud de detección en individuos menores de edad y obesos, con algún pariente en primer grado con diabetes, que pertenecen a un grupo de alto riesgo, en mujeres que parieron un neonato de más de 4,5 kg o en las que se diagnosticó DMG, en personas con hipertensión o hiperlipidemia, o en quienes cubren los criterios para IG o AGP (es decir, prediabetes) de acuerdo con análisis de laboratorio previos.
Análisis de sangre
Las cuantificaciones de la glucosa en la sangre se utilizan tanto para el diagnóstico como para el control de la diabetes. Las pruebas diagnósticas incluyen la GPP, la cuantificación aleatoria de glucosa en el plasma, y la prueba de tolerancia a la glucosa. A la lista de pruebas diagnósticas para la diabetes se agregó en 2009 la hemoglobina glucosilada (A1C, antes denominada HbA1c). Antes, la A1C se había utilizado sólo como medida para el control de la glucemia con el tiempo. Las pruebas de glucemia mediante laboratorio y con tubo capilar o punción digital se utilizan para el control de las personas con diagnóstico de diabetes. La tabla 50-5 enlista los valores de A1C en relación con las concentraciones promedio de glucosa en el plasma. Los pacientes con diabetes deben tener conocimiento sobre sus valores A1C, y la correlación y las asociaciones de éstos con el control glucémico a largo plazo.
Glucosa plasmática preprandial
La GPP ha sido por mucho tiempo la prueba diagnóstica preferida cuando se dispone de una muestra de sangre en ayuno. Las concentraciones de glucosa se cuantifican una vez que se difiere el consumo de alimentos durante por lo menos 8 h. Un valor de GPP inferior a 100 mg/dl (5,6 mmol/l) se considera normal (tabla 50-2). Una concentración de entre 100 mg/dl y 125 mg/dl (5,6 mmol/l y 6,9 mmol/l) es relevante y se define como una glucemia preprandial anómala. Si la concentración de GPP es de 126 mg/dl (7 mmol/l) o más, se diagnostica diabetes.
Prueba de glucemia aleatoria
La cuantificación aleatoria de la glucosa plasmática es aquélla que se realiza de manera independiente al tiempo transcurrido desde el último consumo de alimentos. Una concentración plasmática de glucosa que muestra elevación inequívoca (≥200 mg/dl [11,1 mmol/l]) en presencia de síntomas clásicos de diabetes como polidipsia, polifagia, poliuria y visión borrosa es diagnóstica de DM a cualquier edad.
Prueba de tolerancia oral a la glucosa
La PTOG es una prueba importante para la detección de la diabetes. El análisis cuantifica la capacidad del organismo para almacenar la glucosa al retirar la de la sangre. En los varones y las mujeres, el estudio cuantifica la respuesta de la glucosa plasmática a una carga con una solución concentrada con 75 g de glucosa a intervalos específicos, por lo general,después de 1 h y 2 h. En personas con tolerancia normal a la glucosa, la glucemia recupera la normalidad en el transcurso de 2 h o 3 h tras la ingestión de la carga, en cuyo caso puede asumirse que existe insulina suficiente para permitir que la glucosa deje la sangre e ingrese las células corporales. Debido a que la persona con diabetes carecen de capacidad para responder a un incremento del glucemia mediante la liberación de una cantidad suficiente de insulina que facilite su almacenamiento, las concentraciones del azúcar en la sangre se elevan por encima de los que se observan en personas normales y permanecen elevadas durante períodos mayores (tabla 50-2).
Vigilancia de la glucosa en sangre capilar
Los avances tecnológicos han provisto medios para monitorear la glucemia mediante el empleo de una gota de sangre capilar. Este procedimiento ha provisto a los profesionales de la salud con un medio rápido y económico para vigilar la glucemia, y ha dado a las personas con diabetes una alternativa para mantener valores de glucemia casi normales mediante el automonitoreo de la glucosa en la sangre. Estas técnicas recurren a una gota de sangre capilar obtenida por punción digital o antebraquial con una aguja especial o una lanceta pequeña. La gota de sangre capilar se coloca o se absorbe en una tira reactiva, y se determinan las concentraciones de glucosa por medios electrónicos gracias al empleo de un glucómetro. Debe recomendarse cautela al recurrir a sitios para toma de muestra distintos a los pulpejos durante los períodos en que se sospecha hipoglucemia, debido a que existe una discordancia amplia entre los valores cuando existen fluctuaciones rápidas de la glucemia.
Las pruebas de laboratorio que recurren al plasma para la cuantificación de la glucemia dan resultados entre el 10% y el 15% superiores en comparación con las técnicas de punción digital que recurren a sangre entera. La mayor parte de los monitores autorizados para emplear en casa calibran las lecturas de la glucemia con valores plasmáticos, con el objetivo de permitir una comparación más simple con los valores de laboratorio. Se están poniendo a disposición sistemas para monitoreo continuo de la glucemia, con el objetivo de afinar el control de la glucosa. Distintos sistemas cuentan con catéteres pequeños que se implantan en el tejido subcutáneo para obtener muestras frecuentes. Los centros de endocrinología recurren cada vez más a esta tecnología en personas específicas, con el objetivo de lograr un control óptimo de la glucemia. La variedad y la precisión de estos sistemas se encuentran en mejoramiento continuo. Sin embargo, el monitoreo de la glucemia mediante la punción digital sigue siendo el estándar de atención.
Prueba de hemoglobina glucosilada. La hemoglobina glucosilada, también conocida como glucohemoglobina, HbA1c o A1C (el término de preferencia), se refiere a la hemoglobina en la que se ha incorporado la glucosa. La hemoglobina de ordinario no contiene glucosa cuando se libera a partir de la médula ósea. Durante su ciclo de vida de 120 días en el eritrocito, la hemoglobina de ordinario se glucosila para dar origen a las hemoglobinas A1a y A1b (del 2% al 4%), y a la A1C (del 4% al 6%). Puesto que el ingreso de la glucosa a los eritrocitos no depende de la insulina, la velocidad a la cual se une la glucosa a la molécula de hemoglobina depende de las concentraciones del azúcar en la sangre. La glucosilación es en esencia irreversible, y la concentración de A1C en la sangre representa un índice de las concentraciones de glucosa en sangre durante las 6 a 12 semanas previas. En la diabetes no controlada o en la diabetes con hiperglucemia, existe un incremento de la concentración de A1C.
La ADA recomienda instaurar medidas correctivas cuando se identifican concentraciones de A1C superiores al 7%. Sin embargo, la meta se redefinió para disminuir los valores de A1C hasta menos del 7%, o incluso alcanzar los valores inferiores al 6% que corresponden a una glucemia normal. Las recomendaciones para los individuos en relación al control óptimo toman en consideración muchos factores, entre otros cualquier riesgo relacionado de lesión. La A1C haconstituido un indicador clave para el control a largo plazo, puesto que tiene un valor predictivo sólido para las complicaciones de la diabetes. Muchos profesionales reciben con bienestar la inclusión más reciente como una herramienta diagnóstica para la diabetes.
Análisis de orina
La facilidad, la precisión y la conveniencia de las técnicas para automonitoreo de la glucemia han hecho que los estudios en orina se vuelvan obsoletos para la mayor parte de las personas con diabetes. Estas pruebas sólo revelan las concentraciones de la glucosa en la orina y reciben influencia de factores como el umbral renal para la glucosa, el consumo de líquidos y la concentración de la orina, las técnicas para la realización de pruebas urinarias y algunos fármacos. Se recomienda que todos los individuos con diabetes recurran al automonitoreo de la glucemia. La detección de cetonas en la orina sigue siendo una parte importante de la vigilancia y control de la diabetes, en particular en individuos con diabetes tipo 1 que presentan riesgo de desarrollar cetoacidosis, y en las mujeres diabéticas embarazadas para verificar si son adecuados la nutrición y el control de la glucemia.
Tratamiento
El resultado deseado del control de la glucemia tanto en la diabetes tipo 1 como en la tipo 2 es la normalización de las concentraciones de glucosa como medio para prevenir las complicaciones a corto y a largo plazos. Los planes de tratamiento incluyen el tratamiento médico nutricional, el ejercicio y los fármacos hipoglucemiantes. Las personas con diabetes tipo 1 requieren tratamiento con insulina desde el momento del diagnóstico. La pérdida ponderal y el manejo dietético pueden resultar suficientes para controlar la glucemia en personas con diabetes tipo 2 que adoptan cambios del estilo de vida a largo plazo. Sin embargo, la mayor parte de los pacientes necesita atención de seguimiento debido a que la secreción de insulina a partir de las células β puede disminuir, o bien la resistencia a la insulina puede persistir o intensificarse, en cuyo caso se prescriben fármacos hipoglucemiantes orales.
Entre las estrategias para alcanzar estas metas terapéuticas se encuentran la instrucción para el autocontrol de la diabetes y la resolución de problemas. Las metas terapéuticas individuales deben tomar en consideración la edad de la persona y otras condiciones patológicas, así como la capacidad del individuo para comprender y seguir el régimen terapéutico, además de los factores socioeconómicos que pudieran influir sobre su apego al plan. El manejo a largo plazo de la glucemia resulta crítico para retrasar y prevenir las complicaciones de la diabetes, y depende en gran medida del conocimiento que tiene la persona sobre los componentes múltiples de los cuidados.
Manejo de la dieta
El manejo de la dieta es un componente fundamental del cuidado de la diabetes. El concepto de terapia médica nutricional, que introdujo la ADA en 1994, se define como el empleo de servicios nutricionales específicos para el manejo de una enfermedad, lesión o condición, e implica tanto a la valoración de la condición nutricional como a las medidas terapéuticas, lo que incluye al tratamiento nutricional, la asesoría y el empleo de complementos nutricionales especiales. Considerada antes rígida y compleja, el tratamiento médico nutricional (TMN) cuenta en la actualidad con una mayor base en la evidencia y ajuste individual. La dieta para el diabético ha sufrido cambios importantes en el transcurso de los años, en particular en cuanto a las recomendaciones para la distribución calórica entre carbohidratos, proteínas y grasas. Ya no existe una dieta específica para el diabético, sino más bien una prescripción en la dieta que se basa en la valoración nutricional y las metas terapéuticas. Se requiere un esfuerzo coordinado de equipo, lo que incluye al paciente con diabetes, para personalizar el plan nutricional.
Las metas y los principios del tratamiento en la dieta difieren entre la diabetes tipo 1 y la tipo 2, y entre personas delgadas y obesas. El plan prescrito del tratamiento nutricional es integral al manejo de la diabetes. Las metas terapéuticas incluyen el mantenimiento de valores de glucemia casi normales, el alcance de concentraciones lipídicas óptimas, el consumo adecuado de calorías para mantener y alcanzar pesos razonables, la prevención y el tratamiento de las complicaciones crónicas de la diabetes, y el mejoramiento de la salud en general por medio de una nutrición óptima. Las recomendaciones iniciales pueden incluir entre el 45% y el 60% de carbohidratos, del 20% al 35% de grasas y del 10% al 20% de proteínas.
En una persona con diabetes tipo 1, se valora el consumo usual de alimentos y se utiliza como base para ajustar el tratamiento de insulina, con el objetivo de adaptarse al estilo de vida del paciente.
Se recomienda el consumo de cantidades y tipos de alimentos constantes, con horarios específicos y rutinarios. La cuantificación de la glucemia en casa permite una retroalimentación inmediata en torno al consumo nutricional, la respuesta glucémica y la influencia de la actividad física. Para los individuos con diabetes tipo 1 los mejoramientos de los regímenes de insulina y el empleo creciente de bombas de insulina permiten una mayor flexibilidad para las comidas.
La mayor parte de los individuos con diabetes tipo 2 padece sobrepeso. Las metas del tratamiento nutricional se concentran en alcanzar los objetivos de glucemia, lipidemia y presión arterial, así como de pérdida ponderal si se encuentra indicada. La pérdida ponderal leve o moderada (del 5% al 10% del peso corporal total) ha demostrado mejorar el control de la diabetes, incluso si no se alcanza el peso deseable. Las cuestiones relativas a la dieta en relación con los factores de riesgo cardíaco también desempeñan un papel en la personalización de los cuidados para quienes padecen diabetes tipo 2. Las directrices nacionales para la dieta en cuanto a grasas saturadas, sodio y fibra, también influyen sobre la planificación en la dieta para las personas con diabetes. La dietista desempeña un papel esencial en el equipo de atención de la diabetes, y es capaz de seleccionar entre los distintos métodos, como el conteo de carbohidratos, el intercambio de alimentos, la elección de alimentos saludables, el índice glucémico y la glucosa total disponible para ajustar el plan de alimentación con el objetivo de cubrir las necesidades individuales. Las recomendaciones más simples se relacionan con una comprensión y un apego más adecuados a la dieta de parte del enfermo. El conteo de carbohidratos recurre a la información de la etiqueta del producto a la que pueden acceder con facilidad las personas con diabetes. De manera independiente a la fuente alimentaria, se contabilizan los gramos totales de carbohidratos para hacer énfasis en el nutrimento que afecta en mayor medida el control de la glucemia.
La TMN también es importante para prevenir el desarrollo de complicaciones o por lo menos para reducir la velocidad a la que se presentan. Puesto que la diabetes es un factor de riesgo para la enfermedad cardiovascular, se recomienda que se obtengan menos del 7% de las calorías diarias a partir de grasas saturadas, y que el consumo en la dieta de colesterol se limite a 200 mg o menos, al tiempo que se reduce al mínimo el consumo de grasas trans. Los perfiles lipídicos periódicos en ayuno permiten identificar trastornos concurrentes de los lípidos. Al tiempo que se desarrollan afecciones asociadas a la diabetes, la TMN persiste como un componente clave para optimizar los resultados. Problemas como hiperlipidemia, arteriopatía coronaria, insuficiencia renal, neuropatía e hipertensión requieren consideración adicional en torno al consumo de sodio y otros nutrimentos.
Ejercicio
Los beneficios del ejercicio son numerosos en relación con la diabetes y las condiciones asociadas.
El acondicionamiento cardiovascular y el bienestar psicológico son deseables en todas las personas, pero para muchos pacientes con diabetes tipo 2 los beneficios del ejercicio incluyen una disminución de la grasa corporal, un mejor control del peso y un incremento de la sensibilidad a la insulina. El ejercicio es tan importante para el manejo de la diabetes que un programa planificado de ejercicio regular suele considerarse parte integral del régimen terapéutico para todos los individuos con diabetes. En general, el ejercicio esporádico sólo trae consigo beneficios transitorios. Un programa regular de ejercitación o entrenamiento trae mayores beneficios; es mejor para el acondicionamiento cardiovascular y permite mantener una proporción músculo-grasa que fomenta la receptividad periférica a la insulina.
En individuos con diabetes los efectos benéficos del ejercicio se acompañan de un aumento del riesgo de hipoglucemia, en particular en quienes reciben inyecciones de insulina. Si bien se incrementa en grado significativo la captación muscular de glucosa, la capacidad para mantener la glucemia se dificulta por la incapacidad para suprimir la absorción de la insulina inyectada y activar los mecanismos contrarreguladoras que mantienen la glucemia. No sólo existe incapacidad para suprimir las concentraciones de insulina, sino que la absorción de la hormona puede aumentar. Esta absorción mayor es más pronunciada cuando la insulina se inyecta en el tejido subcutáneo sobre el músculo que se ejercita, pero ocurre incluso cuando la insulina se inyecta en otras regiones corporales. Incluso después de suspender el ejercicio persiste el efecto hipoglucemiante de la insulina.
En algunas personas con diabetes tipo 1 se desarrollan datos de hipoglucemia varias horas después de suspender el ejercicio, quizá debido a que las dosis subsecuentes de insulina (en quienes utilizan inyecciones diarias múltiples de insulina) no se ajustan para dar cabida a la disminución de la glucemia inducida por el ejercicio. La causa de la hipoglucemia en personas que no se aplican una dosis subsecuente de insulina no está clara. Pudiera guardar relación con el hecho de que el hígado y los músculos esqueléticos incrementan su captación de glucosa después del ejercicio como medio para restituir sus reservas de glucógeno, o que el hígado y los músculos esqueléticos se vuelven más sensibles a la insulina durante este período. Los pacientes con diabetes deben estar conscientes de que pueden presentar hipoglucemia tardía tras el ejercicio, y pudiera ser necesario que modifiquen las dosis de los medicamentos para el control de la diabetes, su consumo de carbohidratos o ambos.
Si bien trae beneficios a las personas con diabetes, el ejercicio debe ponderarse en una escala riesgo-beneficio. Antes de iniciar un programa de ejercitación, la persona diabética debe someterse a una valoración apropiada para descartar la enfermedad macrovascular y la microvascular. La meta del ejercicio es una participación segura en actividades congruentes con el estilo de vida de la persona. Al igual que con las directrices nutricionales, las recomendaciones para el ejercicio necesitan personalizarse. Cada individuo debe tener metas que consideren la cantidad de ejercicio, la duración del ejercicio, las concentraciones de glucemia antes de iniciar el ejercicio y las habilidades para resolución de problemas. Algunas consideraciones son el potencial de hipoglucemia, hiperglucemia, cetosis, isquemia cardiovascular y arritmias (en particular, cardiopatía isquémica silente), exacerbación de la retinopatía proliferativa y lesión en las extremidades inferiores. Para las personas con diabetes tipo 1 que se ejercitan durante los períodos con control deficiente (es decir, cuando la glucemia se encuentra elevada, las concentraciones de insulina exógena son bajas y existe cetonemia), la glucosa y las cetonas en la sangre aumentan hasta niveles más altos debido a que el estrés que genera el ejercicio se sobrepone a la insuficiencia preexistente de insulina y al aumento de la actividad de las hormonas contrarreguladoras.
Fármacos hipoglucemiantes orales e inyectables
Los últimos años no sólo han sido testigos del surgimiento de fármacos nuevos para el tratamiento de la diabetes, sino de nuevas clases. Las opciones ya no son sólo los fármacos hipoglucemiantes orales o la insulina. Los medicamentos para el manejo de la diabetes incluyen ahora nuevos fármacos hipoglucemiantes inyectables (es decir, análogos de la amilina y análogos del péptido similar al glucagón tipo 1 GLP-1). Puesto que las personas con diabetes tipo 1 presentan insuficiencia deinsulina, necesitan tratamiento de restitución con hormona exógena desde el inicio. Los individuos con diabetes tipo 2 pueden mostrar aumento de la síntesis hepática de glucosa, disminución de la utilización periférica de la glucosa, disminución de la utilización de los carbohidratos ingeridos y, al transcurrir el tiempo, compromiso para la secreción de insulina y secreción excesiva de glucagón a partir del páncreas (figura 50-7).
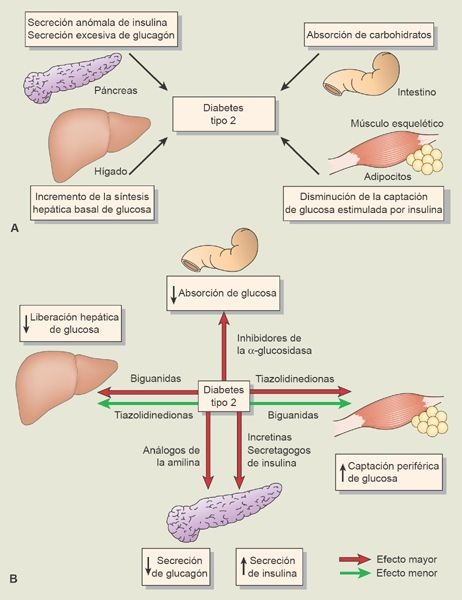
Los fármacos hipoglucemiantes que se utilizan para el tratamiento de la diabetes tipo 2 atacan cada una de estas áreas y en ocasiones todas. Si no es posible lograr un buen control de la glucemia con un fármaco o hipoglucemiantes una combinación de ellos, puede agregarse insulina o utilizarse sola.
Los fármacos hipoglucemiantes pertenecen a 5 categorías:
- secretagogos de la insulina (es decir, sulfonilureas, repaglinida y nateglinida),
- biguanidas,
- inhibidores de la α-glucosidasa,
- inhibidores de la enzima dipeptidilpeptidasa tipo 4 (DPP-4), y
- tiazolidinedionas (TZD; tabla 50-6).
Además, se utilizan ahora en forma amplia un agonista del GLP-1 y un agonista de la amilina en formulaciones inyectables.
Secretagogos de la insulina: sulfonilureas
Las sulfonilureas se descubrieron de manera accidental en 1942 cuando los científicos observaron que una de las sulfonamidas que se estaba desarrollando en la época inducía hipoglucemia. Estos medicamentos reducen la glucemia al estimular la liberación de insulina a partir de las células β del páncreas. Estos fármacos son efectivos sólo cuando existe cierta función residual en las células β. Las sulfonilureas actúan al unirse a un receptor específico de afinidad alta en la célula β, que se encuentra vinculado con un canal de potasio sensible al ATP.
Las sulfonilureas se utilizan para el tratamiento de la diabetes tipo 2 y no pueden sustituir a la insulina en personas con diabetes tipo 1, quienes tienen una insuficiencia absoluta de la hormona. Las sulfonilureas de manera tradicional se agrupan en fármacos de primera y segunda generación (tabla 50-6). Estos medicamentos difieren en cuanto a dosificación y duración de acción. Los fármacos de segunda generación (es decir, gliburida, glipizida y glimepirida) son bastante más potentes que los de primera generación, y se prescriben en forma más amplia.
Puesto que las sulfonilureas incrementan las concentraciones de insulina y la velocidad a la cual se extrae la glucosa de la sangre, es importante reconocer que pueden inducir reacciones hipoglucémicas. Este problema es más común en adultos mayores con trastornos de la función hepática y renal que reciben sulfonilureas de acción más prolongada. En algún momento las sulfonilureas fueron la base del tratamiento de la diabetes tipo 2. Al incrementarse las alternativas para el manejo farmacológico de la diabetes, resulta más deseable el consumo de fármacos que conllevan un riesgo menor de hipoglucemia.
Secretagogos de la insulina: repaglinida y nateglinida
La repaglinida y la nateglinida son secretagogos de insulina que no pertenecen al tipo de las sulfonilureas y requieren la presencia de glucosa para lograr su acción principal. Estos agentes actúan al cerrar el canal de potasio dependiente de ATP en las células β6. La liberación de insulina depende de la glucosa y disminuye cuando sus concentraciones son bajas. Estos fármacos, que se absorben con rapidez a partir del tubo gastrointestinal se administran poco antes de los alimentos (15 min a 30 min para la repaglinida, y 1 min a 30 min para la nateglinida), con el objetivo de actuar sobre la excursión posprandial de la glucemia, al ayudar a restaurar la respuesta de primera fase de la insulina. Tanto la repaglinida como la nateglinida pueden inducir hipoglucemia; así, resulta esencial su administración apropiada en relación con las comidas.
Biguanidas
En la actualidad el metformín es la única biguanida de esta categoría. El metformín inhibe la síntesis hepática de glucosa e incrementa la sensibilidad de los tejidos periféricos a las acciones de la insulina. Puesto que el fármaco no estimula la secreción de insulina no provoca hipoglucemia como efecto colateral. Algunos beneficios secundarios del tratamiento con metformín incluyen la pérdida ponderal y el mejoramiento de los perfiles lipídicos. En tanto la acción principal de las sulfonilureas es incrementar la secreción insulina, el metformín ejerce sus efectos benéficos sobre el control glucémico por medio del aumento del consumo periférico de glucosa y la disminución de la síntesis hepática del azúcar (efecto principal). Para reducir el riesgo de desarrollo de acidosis láctica, el metformín se encuentra contraindicado en personas con cifras elevadas de creatinina sérica (una prueba de función renal), evidencia clínica y de laboratorio de hepatopatía, y cualquier condición que se relacione con hipoxemia o deshidratación. Puesto que el metformín por lo general se tolera bien, es efectivo y tiene algunos efectos secundarios, se ha convertido en un fármaco de prescripción frecuente para la diabetes tipo 2. El metformín también se ha estudiado aunado a la modificación del estilo de vida para la prevención de la diabetes en poblaciones en riesgo.
Inhibidores de la α-glucosidasa
En personas con diabetes tipo 2, las sulfonilureas, las biguanidas o ambas pueden ejercer efectos benéficos sobre las concentraciones de GPP. Sin embargo, en más del 60% de estos individuos persiste la hiperglucemia posprandial, y quizá explique los valores altos sostenidos de A1C. Una estrategia alternativa para atender el problema de hiperglucemia posprandial es el consumo de fármacos como la acarbosa y el miglitol, inhibidores de la α-glucosidasa, que es una enzima del borde del cepillo del intestino delgado que degrada a los carbohidratos complejos.
Al retrasar la degradación de los carbohidratos complejos, los inhibidores de la α-glucosidasa retrasan la absorción de los carbohidratos en el intestino, y limitan el incremento posprandial de la glucosa plasmática y las concentraciones de insulina. Si bien no es un problema con la monoterapia o el tratamiento combinado con una biguanida, puede presentarse hipoglucemia si se administra tratamiento concurrente con sulfonilureas. En caso de que se presente hipoglucemia, debe manejarse con glucosa (dextrosa) y no con sacarosa (azúcar de mesa), cuya degradación pudiera encontrarse bloqueada por la acción de los inhibidores de la α-glucosidasa.
Tiazolidinedionas
Las TZD (o glitazonas) constituyen la única clase de fármacos que actúa de manera directa sobre la resistencia a la insulina, un defecto fundamental en la fisiopatología de la diabetes tipo 2. Las TZD mejoran el control de la glucemia al incrementar la sensibilidad a la insulina en los tejidos que responden a la hormona–hígado, músculo esquelético y tejido adiposo–y permiten que respondan a la insulina endógena de manera más eficiente, sin incrementar el gasto a partir de las células β ya disfuncionales. La pioglitazona y la rosiglitazona son los sensibilizadores a la insulina más potentes, y fueron autorizados por la U.S. Food and Drug Administration (FDA) en 1999. Debido al problema previo de toxicidad hepática en esta clase de fármacos, las enzimas hepáticas deben vigilarse de acuerdo con las directrices. Además, en la actualidad el consumo de rosiglitazona se encuentra restringido. Los estudios sobre rosiglitazona en los últimos años relacionaron al fármaco con un aumento del riesgo de infarto de miocardio. De hecho, en 2010 la FDA colocó el consumo de la rosiglitazona en restricción por efecto del aumento del riesgo de accidentes cardíacos en individuos que recibían el fármaco. Desde entonces su consumo ha disminuido en forma radical, y las personas que siguen utilizándolo deberán participar en un programa especial puesto que ya no estará a la venta en las farmacias ordinarias. Este fenómeno no se identificó con la pioglitazona, que sigue estando autorizada como monoterapia y tratamiento combinado. Sin embargo, la pioglitazona puede inducir retención hídrica, por lo que se encuentra contraindicada en individuos con insuficiencia cardíaca en estadios III y IV de la New York Heart Association.
El mecanismo de acción de las TZD es complejo y no se comprende en su totalidad. La acción de las TZD se relaciona con su unión al receptor activador del proliferador del peroxisoma tipo γ (RAPP-γ; figura 50-8).
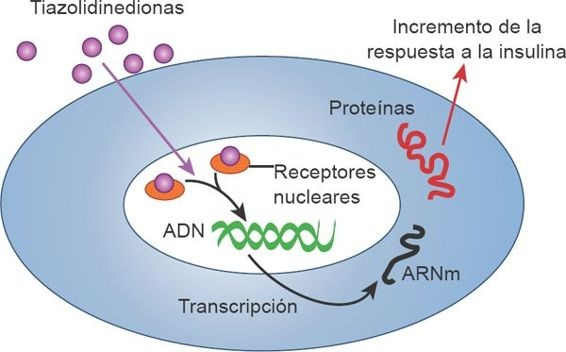
La adiponectina se sintetiza en los adipocitos y sensibiliza de manera directa al organismo a las acciones de la insulina, por lo que pudiera formar parte del eslabón faltante para explicar la resistencia a la insulina en las personas con diabetes tipo 2. Se piensa que las TZD actúan al disminuir la resistencia a la insulina, por lo menos en parte, por medio del incremento de la síntesis de adiponectina en los adipocitos. Las TZD tienen efectos adicionales numerosos, entre otros la corrección de muchas de las características metabólicas anómalas relacionadas con la diabetes tipo 2.
Inhibidores de la enzima dipeptidilpeptidasa tipo 4
Los inhibidores de la DPP-4 son una clase relativamente nueva y en surgimiento de fármacos que se agrupan en la categoría del tratamiento con incretina. Las incretinas son sustancias insulinotrópicas que se liberan hacia la circulación a partir del tubo gastrointestinal después de una comida, en particular si es rica en carbohidratos. Las incretinas actúan al estimular la secreción de insulina en la célula β. En las personas normales las incretinas inducen alrededor del 20% al 60% de la secreción de insulina después de una comida. Las incretinas principales que se secretan son el GLP-1 y el polipéptido insulinotrópico dependiente de glucosa (IDG). La enzima DPP-4 degrada con rapidez tanto al GLP-1 como al IDG. Los inhibidores de la DPP-4 actúan al inhibir a la enzima e incrementar las concentraciones de GLP-1 e IDG, que luego incrementan la liberación de insulina. El GLP-1 también ayuda a suprimir la liberación de glucagón. El primer agente oral de esta categoría, la sitagliptina, se introdujo en 2006 y se encuentra autorizado como monoterapia o tratamiento combinado con otros hipoglucemiantes orales. Desde entonces se han producido otros 2 agentes: la saxagliptina y, en fecha más reciente, la linagliptina.
Agonistas del péptido similar al glucagón tipo 1 (GLP-1)
Se sabe que las hormonas tipo incretina, entre otras el GLP-1, desempeñan un papel importante en el control endógeno de la glucosa. La acción de estas hormonas en respuesta al consumo de nutrimentos da origen a la secreción de insulina dependiente de glucosa, y a la disminución de la glucemia. Como análogo sintético del GLP-1, la exenatida fue el primer tipo de incretina disponible para el tratamiento de la diabetes. La exenatida se encuentra autorizada como monoterapia inyectable o para el tratamiento adyuvante combinado en individuos con diabetes tipo 2, junto con la dieta y el ejercicio. Se ha demostrado que el fármaco tiene acciones múltiples, como la potenciación de la liberación de insulina mediada por glucosa, la disminución de la velocidad del vaciamiento gástrico y la pérdida central del apetito relacionada con pérdida ponderal. La exenatida se inyecta por vía subcutánea 60 min antes de consumir un alimento. Sus efectos colaterales principales son las náuseas y la pérdida ponderal. La liraglutida es el segundo inhibidor del GLP-1 autorizado en Estados Unidos, y se esperan otros fármacos. Se están haciendo pruebas con innovaciones terapéuticas como la aplicación semanal de inhibidores del GLP-1 que pudiera hacer a los fármacos de esta categoría incluso más deseables.
Análogos de la amilina
La pramlintida, un análogo sintético de la amilina, es un fármaco hipoglucemiante inyectable que modula la glucemia posprandial y se encuentra autorizado para consumo en la diabetes tipo 1 y tipo 2. La amilina es un péptido con 37 aminoácidos que se sintetiza, almacena y secreta a la par de la insulina en respuesta a la glucosa y a otros estimulantes de las células β. Por ende, en la diabetes en que existen disminución o disfunción intensas de las células β y la secreción insulina, la secreción de amilina también se pierde o es disfuncional. La pramlintida se inyecta (en una aplicación independiente a la insulina) antes de los alimentos en las personas que no pueden alcanzar los niveles de glucemia posprandial es objetivo. La pramlintida, que tiene inicio de acción rápido, suprime la liberación de glucagón, reduce la velocidad de vaciamiento gástrico y tiende a disminuir el apetito.
El efecto colateral principal de la pramlintida son las náuseas.
Insulina
En la diabetes tipo 1 siempre se requiere el tratamiento con insulina, y muchas personas con diabetes tipo 2 con el tiempo también lo necesitan. La insulina exógena se sintetiza idéntica a la insulina humana. La insulina se destruye en el tubo gastrointestinal y debe administrarse mediante inyección subcutánea. Todas las insulinas se cuantifican en unidades (la unidad internacional de la insulina se define como la cantidad de hormona requerida para reducir la glucemia de un conejo de 2 kg en ayuno desde 145 mg/dl hasta 120 mg/dl). La mayor parte de los tipos de insulina se encuentran disponibles con potencias de 100 U (es decir, 100 U de insulina/1 ml).
Las preparaciones de insulina se catalogan de acuerdo con el tiempo para inicio de acción y para alcanzar la actividad máxima, y por la duración de su acción. Los científicos esperan encontrar alguna alternativa a la insulina inyectable, pero hasta la fecha ninguna ha probado ser efectiva. Una variedad inhalada de insulina se introdujo al mercado durante un período corto en Estados Unidos, pero se retiró por razones comerciales.
Los tipos de insulina se clasifican según la duración de su actividad y el tiempo que requieren para alcanzar la actividad máxima. Existen 4 tipos principales de insulina:
- De acción rápida.
- De acción corta.
- De acción intermedia.
- De acción prolongada (tabla 50-7).
Las insulinas de acción rápida (lispro, aspártica y glulisina) se producen mediante tecnología recombinante con sustitución de aminoácidos. Estas insulinas tienen un inicio de acción, actividad máxima y duración de efecto más rápido en comparación con la insulina regular de acción corta, de 5 min a 15 min. Las insulinas de acción rápida, que se utilizan en combinación con insulinas de acción intermedia o prolongada, suelen administrarse de inmediato antes de una comida. Por el efecto de inicio rápido de acción de esta categoría de insulinas también pueden administrarse durante una comida, o de inmediato después de la misma. Esto puede aportar gran beneficio a los individuos con consumo oral impredecible (ej. poblaciones pediátricas, adultos inestables).
La insulina de acción corta (regular) es una insulina cristalina, soluble, cuyos efectos comienzan en el transcurso de 30 min después de la inyección subcutánea y suelen perdurar entre 5 h y 8 h.
La insulina de acción intermedia es la IAC (protamina neutra hagedorn). Esta insulina tiene un inicio de acción más lento y una duración de acción más prolongada. Necesita varias horas para alcanzar niveles terapéuticos, de tal manera que su empleo en la diabetes tipo 1 hace necesaria la administración complementaria de una insulina de acción rápida o corta. Esta insulina, combinada con una insulina de acción corta, constituyó la base de la terapia de la diabetes tipo 1 y era común para el manejo de la población de pacientes con diabetes tipo 2 que requerían insulina para un control adecuado. Eran muy comunes las soluciones premezcladas de IAC e insulinas de acción corta. Este régimen no era óptimo puesto que no permitía la flexibilidad para las comidas (consumo de carbohidratos), y su acción máxima era menos predecible, lo que incrementaba el riesgo de hipoglucemia.
Las insulinas de acción prolongada, glargina y detemir, tienen un período de absorción más prolongado que la insulina IAC, e inducen una concentración relativamente constante a lo largo de 12 h a 24 h. Todas las variedades de insulina tienen el potencial de inducir hipoglucemia o «reacción insulínica» como efecto colateral. La ventaja de una insulina «sin pico máximo» es la provisión de una cobertura de base en la diabetes tipo 1, y de ser apropiado, en la diabetes tipo 2.
Regímenes terapéuticos intensivos con insulina
Los 2 regímenes terapéuticos intensivos—las inyecciones diarias múltiples (IDM) y la infusión subcutánea continua de insulina—simulan en gran medida el patrón normal de secreción de insulina en el organismo. Con cada una de estas técnicas se mantiene una concentración basal de insulina, y se aplican dosis en bolo de insulina de acción corta o rápida antes de los alimentos. La persona con diabetes determina la opción terapéutica en colaboración con el equipo de atención de la salud.
En el caso de las inyecciones diarias múltiples, los requerimientos basales de insulina se cubren con una insulina de acción intermedia o prolongada que se administra 1 o 2 veces al día. Antes de los alimentos se aplican bolos de insulina de acción rápida o corta. El desarrollo de dispositivos convenientes para inyección (ej. aplicadores de pluma) ha facilitado a las personas diabéticas ajustarse a los algoritmos de las insulinas que se administran antes de los alimentos. Esta dosificación prandial (relacionada con los alimentos) personalizada permite una flexibilidad mayor para el consumo de la dieta y el horario de las comidas.
La infusión subcutánea continua de insulina (ISCI) recurre a una bomba de insulina. Tanto la IDM como la ISCI buscan imitar la función pancreática por medio de la aplicación de dosis basales y en bolo de insulina. Con este método, los requerimientos basales de insulina se cubren mediante la infusión continua de insulina subcutánea, cuya velocidad puede modificarse para adaptarse a las variaciones del estilo de vida. La técnica ISCI implica la inserción de una aguja pequeña o catéter plástico en el tejido subcutáneo del abdomen. Los tubos provenientes del catéter se conectan a un equipo con jeringa de una bomba de infusión pequeña que se lleva sobre un cinturón o en la bolsa de una chaqueta. La bomba operada por ordenador aplica entonces la dosis basal de insulina. Además de la dosis basal que aplica la bomba, puede administrarse un bolo de insulina cuando se requiera (ej. antes de un alimento). Resultan vitales una selección de pacientes y un entrenamiento apropiados para tener éxito con la ISCI.
El automonitoreo de la glucemia es una necesidad para cualquier persona que utiliza insulina, en particular cuando se recurre a las técnicas para manejo IDM e ISCI. Cada dosis basal y en bolo se determina de manera individual y se programa en el ordenador de la bomba de infusión. Si bien la seguridad de la bomba ya se ha comprobado, debe prestarse atención estrecha a los signos de hipoglucemia. Otras complicaciones potenciales son los episodios de cetosis inducidos por el fallo de la bomba, el taponamiento del catéter y las infecciones en el sitio de punción. La selección de los candidatos resulta crucial para lograr un empleo exitoso de la bomba de insulina, y las personas que se seleccionan deben trabajar en cercanía a un profesional de la atención de la salud. De manera tradicional se pensaba que la ISCI era un tratamiento para las personas con diabetes tipo 1, pero tiene empleo creciente en individuos con diabetes tipo 2. Las bombas de insulina actuales son muy sofisticadas y permiten programaciones múltiples con base en las necesidades específicas de la persona. En el campo de la atención de la diabetes se está realizando un esfuerzo significativo para obtener una bomba de insulina de «asa cerrada», que tenga capacidad para detectar los niveles de glucemia y responder con una aplicación de insulina sin requerir la intervención manual.
Trasplante de páncreas o de células del islote
El trasplante de páncreas o de células del islote no cura la diabetes tipo 1. Sin embargo, confiere un potencial de mejoramiento significativo de la calidad de vida pues su característica sólo se encuentra disponible para quienes experimentan complicaciones a largo plazo. El trasplante de páncreas-riñón es un procedimiento que se utiliza para individuos con diabetes que padecen nefropatía en fase terminal. Los estudios actuales muestran mejoría de la evolución en estos individuos. Sin embargo, existe un riesgo significativo relacionado con esta cirugía. Al tiempo que se hacen mejoras continuas para la procuración de las frágiles células del islote y el tratamiento inmunosupresor, esta área de tratamiento pudiera ser una esperanza para el manejo futuro de la diabetes.
Complicaciones agudas de la diabetes
Las 3 complicaciones agudas principales de la diabetes son la cetoacidosis diabética, el estado hiperosmolar hiperglucémico (EHH) y la hipoglucemia. Todas son condiciones que ponen en riesgo la vida, y demandan un reconocimiento y tratamiento inmediatos. Estas complicaciones generan un número significativo de hospitalizaciones y el consumo de recursos para la atención de la salud.
Cetoacidosis diabética
La cetoacidosis diabética (CD) se identifica las más de las veces en personas con diabetes tipo 1, en quienes la carencia de insulina conduce a la movilización de los ácidos grasos a partir del tejido adiposo como consecuencia de la falta de supresión de la actividad de la lipasa de los adipocitos, que degrada los triglicéridos para obtener ácidos grasos y glicerol. El aumento de las concentraciones de ácidos grasos conduce a la síntesis de cetonas en el hígado (figura 50-9). Puede ocurrir al inicio de la enfermedad y con frecuencia antes de que se diagnostique.
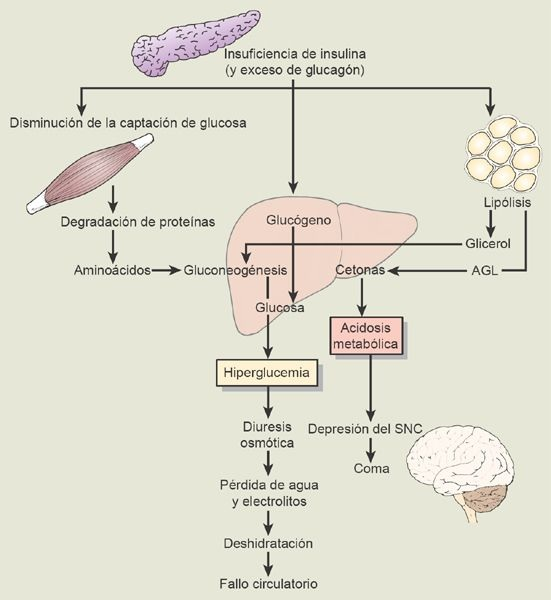
El estrés incrementa la liberación de hormonas gluconeogénicas y predispone al individuo al desarrollo de cetoacidosis. La CD con frecuencia va precedida de un estrés físico o emocional como la infección, el embarazo o la ansiedad extrema. Evidencia reciente sugiere que la hiperglucemia se relaciona con un estado de inflamación intensa. En la práctica clínica, la cetoacidosis también se desarrolla por la omisión o el consumo inadecuado de la insulina. Un ejemplo de esto es el adolescente con diabetes tipo 1 que decide dejar de aplicarse la insulina.
Etiología y patogénesis
Las 3 anomalías metabólicas principales en la CD son la hiperglucemia, la cetosis y la acidosis metabólica. El diagnóstico definitivo de la CD depende de la detección de hiperglucemia (concentraciones de glucosa en sangre >250 mg/dl [13,8 mmol/l]), concentraciones bajas de bicarbonato en suero (<15 mEq/l [15 mmol/l]) y disminución del pH (<7,3) con cetonemia (cetonas positivas con dilución 1:2) y cetonuria moderada. La hiperglucemia genera diuresis osmótica, deshidratación y una pérdida crítica de electrolitos.
La hiperosmolaridad de los líquidos extracelulares por la hiperglucemia determina un desplazamiento del agua y del potasio desde el compartimiento intracelular hasta el extracelular. La concentración extracelular de sodio con frecuencia es baja o normal no obstante las pérdidas intestinales de agua, como consecuencia del desplazamiento del líquido intracelular al extracelular. Este efecto de dilución se conoce como seudohiponatremia.
Las concentraciones séricas de potasio pueden ser normales o altas, a pesar de que existe disminución del potasio corporal total por la poliuria y el vómito prolongados. La acidosis metabólica se debe al exceso de cetoácidos, que hace necesario el amortiguamiento con iones bicarbonato. Esto conduce a una disminución marcada de las concentraciones séricas de bicarbonato. La gravedad de la CD se determina a partir de la intensidad de la acidosis metabólica.
Manifestaciones clínicas
Es común que a la CD la precedan un día o más con poliuria, polidipsia, náuseas, vómito y fatiga marcada, con estupor que con el tiempo puede evolucionar al coma. Pueden presentarse dolor e hipersensibilidad a la palpación abdominal sin que exista patología local. El aliento tiene un olor a frutas que es causado por el efecto de la presencia de cetoácidos volátiles.
Pueden existir hipotensión y taquicardia por una disminución del volumen sanguíneo. En la CD se presentan distintos signos y síntomas relacionados con los mecanismos compensatorios. La frecuencia cardíaca se incrementa al tiempo que el organismo compensa la pérdida del volumen sanguíneo, y la frecuencia y la profundidad de la respiración aumentan (es decir, respiración de Kussmaul), puesto que el organismo trata de impedir disminuciones adicionales del pH.
Tratamiento
Las metas del tratamiento de la CD son mejorar el volumen circulatorio y la perfusión tisular, reducir la glucemia, corregir la acidosis y resolver los desequilibrios electrolíticos.
Estos objetivos suelen alcanzarse con la administración de insulina y de soluciones intravenosas para la restitución de líquidos y electrolitos. Debido a que la resistencia a la insulina acompaña a la acidosis intensa, se utiliza el tratamiento con insulina en dosis bajas. Suele administrarse por vía intravenosa una dosis de carga inicial de insulina regular, seguida por una infusión continua en dosis baja. Se recurre a pruebas de laboratorio frecuentes para monitorear la glucemia y las concentraciones séricas de electrolitos, así como para orientar la restitución de líquidos y electrolitos. Es importante restituir los líquidos y los electrolitos y corregir el pH al mismo tiempo que se lleva la concentración de la glucosa en la sangre hasta un nivel normal. Una caída demasiado rápida de la glucemia pudiera inducir hipoglucemia. Un cambio súbito de la osmolaridad del líquido extracelular también es posible cuando las concentraciones de glucosa en la sangre se reducen con demasiada rapidez, y esto puede generar edema cerebral, que es más frecuente en niños que en adultos. Las concentraciones séricas de potasio suelen caer al tiempo que se corrige la acidosis y elion se desplaza del medio extracelular al compartimiento intracelular. Así, pudiera ser necesario agregar potasio a la infusión intravenosa. La identificación y el tratamiento de la causa subyacente como la infección, también son importantes. Las complicaciones más comunes por un tratamiento extremo de la CD son la hipoglucemia y la hipopotasemia. El empleo creciente de formatos de indicaciones que se basan en la evidencia han respaldado el manejo más seguro de la CD en los servicios para atención aguda.
Estado hiperosmolar hiperglucémico
El EHH se caracteriza por hiperglucemia (glucosa en sangre >600 mg/dl [33,3 mmol/l]), hiperosmolalidad (osmolaridad plasmática >320 mOsm/l) y deshidratación, ausencia de cetoacidosis y depresión del sensorio. El EHH puede presentarse en distintas condiciones como la diabetes tipo 2, la pancreatitis aguda, la infección grave, el infarto de miocardio y el tratamiento con soluciones para nutrición oral o parenteral. Se identifica las más de las veces en individuos con diabetes tipo 2.
Etiología y patogénesis
Una insuficiencia parcial o relativa de insulina puede desencadenar al síndrome, al limitar la utilización de la glucosa al tiempo que se genera hiperglucagonemia y aumenta la liberación hepática de glucosa. Cuando existe glucosuria masiva se presenta una pérdida de agua obligada. La deshidratación suele ser más grave que la CD. Al tiempo que se contrae el volumen plasmático se desarrolla insuficiencia renal, y la limitación resultante de las pérdidas renales de glucosa conduce al desarrollo de niveles de glucemia crecientes e intensificación del estado hiperosmolar. En los estados hiperosmolares, el incremento de la osmolaridad en el suero tiene como efecto la atracción de agua a partir de los cuerpos celulares, lo que incluye a las células cerebrales. La condición puede complicarse por accidentes tromboembólicos que se generan como consecuencia de la osmolaridad sérica alta.
Manifestaciones clínicas y tratamiento
Las manifestaciones más prominentes son debilidad, deshidratación, poliuria, signos y síntomas neurológicos, y sed excesiva. Pueden presentarse signos neurológicos que incluyan hemiparesia, convulsiones y coma. El EHH puede desarrollarse a lo largo de varios días o semanas, pero la aparición de síntomas neurológicos, en particular en adultos mayores, puede confundirse con un accidente cerebrovascular.
Para un tratamiento exitoso del EHH se requiere la regulación de la deshidratación, la hiperglucemia, el desequilibrio electrolítico y la vigilancia frecuente del paciente. El tratamiento del EHH requiere la observación y la atención médica juiciosas, y cuidado, puesto que el agua regresa hacia el interior de las células cerebrales, e impone una amenaza de edema cerebral. Las pérdidas abundantes de potasio durante la fase diurética del trastorno requieren regulación. Debido a que muchos pacientes con EHH tienen afecciones crónicas coexistentes, es importante la identificación de sucesos comórbidos precipitantes para el tratamiento de esta condición peligrosa.
Hipoglucemia
Por lo general, la hipoglucemia se define como la disfunción cognitiva con una concentración de glucosa sanguínea menor de 60 mg/dl 2; ocurre generalmente en individuos que reciben inyecciones de insulina, pero la hipoglucemia prolongada también puede ser producida por algunos fármacos hipoglucemiantes orales.
Etiología y patogénesis
Existen muchos factores que pueden precipitar la hipoglucemia en un individuo con diabetes tipo 1, lo que incluye un error en la dosificación de la insulina, la falta del consumo de alimentos, el incremento del ejercicio, la disminución de los requerimientos de insulina tras la terminación de una situación de estrés, los cambios de medicamentos y la modificación del sitio de aplicación de la insulina. El alcohol disminuye la gluconeogénesis hepática, y las personas con diabetes necesitan ser alertadas en torno al potencial que tiene de inducir hipoglucemia, en particular si se consume en grandes volúmenes o con el estómago vacío.
Manifestaciones clínicas
La hipoglucemia suele tener inicio rápido y progresión sintomática. Los signos y los síntomas de la hipoglucemia pueden dividirse en 2 categorías:
- aquéllos que derivan de la alteración de la función cerebral y
- los vinculados con la activación del sistema nervioso autónomo.
Toda vez que el cerebro depende de la glucosa sanguínea como fuente principal de energía, la hipoglucemia determina conductas relacionadas con las anomalías de la función cerebral.
Pueden presentarse cefalea, dificultad para la resolución de problemas, disturbios o alteración de la conducta, coma y convulsiones. Al inicio del cuadro de hipoglucemia, la activación del sistema nervioso parasimpático induce con frecuencia hambre. A la respuesta parasimpática inicial le sigue la activación del sistema nervioso simpático; esto induce ansiedad, taquicardia, sudoración y constricción de los vasos cutáneos (es decir, la piel se vuelve fría y húmeda).
Los signos y los síntomas de la hipoglucemia son muy variables y no todas las personas los manifiestan todos o incluso la mayoría. Los signos y los síntomas son en especial variables en niños y en adultos mayores. Los adultos mayores pudieran no mostrar respuestas autonómicas típicas relacionadas con la hipoglucemia, y con frecuencia desarrollan signos de anomalías de la función del sistema nervioso central, lo que incluye confusión. Algunas personas desarrollan falta de conciencia en torno a la hipoglucemia. La falta de conciencia en torno a la hipoglucemia debe sospecharse en individuos que no refieren síntomas cuando sus concentraciones hemáticas de glucosa son inferiores a 50 mg/dl a 60 mg/dl (2,8 mmol/l 3.3 mmol/l). Esto es más frecuente en individuos con diabetes de evolución más larga y concentraciones de A1C dentro del intervalo normal. Algunos medicamentos, como los bloqueadores β-adrenérgicos, interfieren con la respuesta simpática que de ordinario se observa en la hipoglucemia. Si la hipoglucemia se presenta al utilizar inhibidores de la α-glucosidasa, debe manejarse con glucosa (dextrosa) y no con sacarosa (azúcar de mesa), cuya degradación pudiera estar bloqueada por la acción de los inhibidores de la enzima.
Tratamiento
El tratamiento más efectivo de una reacción insulínica es la administración inmediata de 15 mg a 20 mg de glucosa a partir de una fuente concentrada de carbohidratos, misma que puede repetirse en tanto sea necesario. Los monosacáridos como la glucosa, que pueden absorberse y pasar en forma directa al torrente sanguíneo actúan mejor. Los carbohidratos complejos pueden administrarse una vez controlada la reacción aguda, para mantener las concentraciones de la glucosa en la sangre. Es importante no tratar en exceso la hipoglucemia e inducir hiperglucemia. Es posible identificar esto mediante la cuantificación de la glucemia 15 min después de la ingestión de glucosa, y de ser necesario, al repetir la administración de 15 g de carbohidratos concentrados (regla 15/15).
Pueden requerirse estrategias alternativas para incrementar la glucosa en la sangre cuando la persona que presenta una reacción se encuentra inconsciente o es incapaz de deglutir. Este cuadro se cataloga como hipoglucemia grave y requiere la intervención de otro individuo. Es posible aplicar glucagón por vía intramuscular o subcutánea. El glucagón actúa al estimular la glucogenólisis hepática para elevar la concentración de la glucosa en la sangre. Puede insertarse una cantidad pequeña de gel de glucosa (disponible en casi todas las farmacias estadounidenses) en un abatelenguas cuando el glucagón no se encuentra disponible. En caso de hipoglucemia grave o que pone en riesgo la vida, pudiera ser necesario administrar glucosa por vía intravenosa (20 ml a 50 ml de una solución al 50%).
Mecanismos contrarreguladores, efecto Somogyi y fenómeno de Dawn
El efecto Somogyi describe un ciclo de episodios poshipoglucémicos inducidos por la insulina. En 1924, Joslin y cols., observaron que la hipoglucemia se relacionaba con episodios alternantes de hiperglucemia. En personas con diabetes, la hipoglucemia inducida por insulina genera un incremento compensatorio de las concentraciones de catecolaminas, glucagón, cortisol y hormona del crecimiento en la sangre. Estas hormonas contrarreguladoras inducen una elevación de la glucosa sanguínea y genera cierto grado de resistencia a la insulina. El ciclo comienza cuando la hiperglucemia y la resistencia comienzan a manejarse con dosis más altas de insulina.
Desde la perspectiva clínica, las concentraciones altas de glucosa en la sangre durante la mañana pueden complicar el tratamiento médico de la diabetes si no se comprende por completo que se trata de un resultado de contrarregulación de la hipoglucemia. El cuadro de hipoglucemia ocurre con frecuencia durante la noche o en un momento en que no se reconoce, lo que dificulta más el diagnóstico del fenómeno. Sin una evaluación apropiada el incremento de la dosis farmacológica puede exacerbar la situación. Cuando se sospecha un fenómeno de Somogyi, puede solicitarse a las personas que se practiquen pruebas de glucosa en la sangre a la mitad de la noche para identificar la hipoglucemia potencial. La utilización de sensores continuos para insulina en pacientes específicos también puede ayudar a identificar el caso.
El fenómeno de dawn (del amanecer) se caracteriza por un incremento de las concentraciones preprandiales de glucosa o de los requerimientos de insulina, o ambos, entre las 5 a.m., y las 9 a.m., sin que exista antecedente de hipoglucemia (en contraste con el fenómeno de Somogyi). Ocurre en personas con diabetes tipo 1 o tipo 2. El fenómeno de dawn no se comprende bien pero se le ha atribuido a un incremento de la tasa de depuración de la insulina, disminución de la sensibilidad a la hormona o ambas situaciones. Varias hormonas como la del crecimiento, el cortisol y el glucagón, se han estudiado en relación con este fenómeno. Se ha detectado que el fenómeno de dawn ocurre en la mayor parte de los individuos con diabetes tipo 1. Su impacto varía con base en distintos factores, como el control de la glucemia y la calidad de la función de los sistemas contrarreguladores. Los avances en la atención de la diabetes, en particular las bombas de insulina avanzadas, pueden hacer frente a las distintas necesidades de insulina basal a horas tempranas de la mañana.
Complicaciones crónicas
Las complicaciones crónicas de la diabetes incluyen trastornos de la microvasculatura (ej. neuropatías, nefropatías y retinopatías), trastornos de la motilidad gastrointestinal, complicaciones macrovasculares (ej. enfermedad arterial coronaria, cerebrovascular y vascular periférica) y úlceras en pie (figura 50-10). El grado de hiperglucemia crónica es el factor concurrente mejor definido en relación con las complicaciones diabéticas.
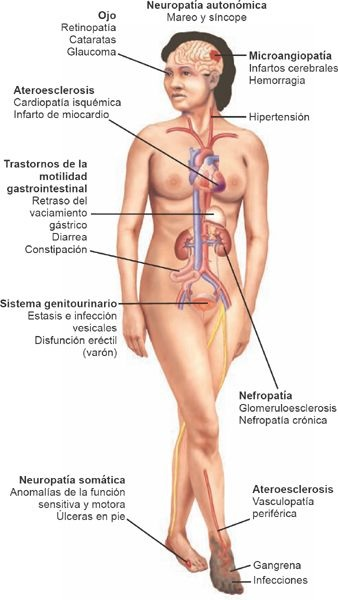
Las causas y el desarrollo de las complicaciones de la diabetes no se comprenden del todo pero pudieran guardar relación con distintos factores. Las cantidades excesivas de sorbitol pueden alterar la función celular. Las glucoproteínas anómalas pueden dañar las membranas basales propias de los ojos, los riñones y la circulación vascular. La oxigenación tisular inapropiada se considera una causa significativa de las complicaciones microvasculares como consecuencia de un defecto de la función eritrocitaria. Se propone que estas y otras anomalías inducen un aumento de las especies reactivas de oxígeno (es decir, radicales libres) en respuesta a la hiperglucemia crónica.
El Diabetes Control and Complications Trial (DCCT), que se realizó en 1.441 pacientes con diabetes tipo 1, reveló que la incidencia de retinopatía, nefropatía y neuropatía puede reducirse mediante un tratamiento intensivo de la diabetes. Resultados similares se identificaron en el United Kingdom Prospective Diabetes Study (UKPDS), realizado con 5.000 personas con diabetes tipo 2.
Estudios recientes también identificaron los beneficios de un control glucémico excelente durante la hospitalización, la cirugía y los cuadros de enfermedad aguda. Debe identificarse a todos los individuos diabéticos para atención aguda que ingresan a instituciones de atención de la salud, y solicitar en ellos el monitoreo de la glucemia. Las metas para el control de la glucemia en individuos hospitalizados consisten en la obtención de valores tan cercanos como sea posible a 110 mg/dl (5,6 mmol/l), y, por lo general, menos de 140 mg/dl (7,8 mmol/l) para pacientes con enfermedad crítica y menos de 180 mg/dl (10 mmol/l) para personas sin cuadros críticos.
Neuropatías
Se demostró que el riesgo de desarrollar neuropatías al igual que otras complicaciones crónicas, se eleva en presencia de hiperglucemia crónica. Los síntomas suelen evidenciarse en la segunda década de la evolución del padecimiento. Puesto que el desarrollo de la diabetes tipo 2 con frecuencia no se detecta, pueden existir complicaciones crónicas en el momento del diagnóstico. Si bien la incidencia de las neuropatías es alta entre individuos con diabetes, es difícil documentar con precisión el número de enfermos afectados por estos trastornos por efecto de la diversidad de las manifestaciones clínicas y puesto que la condición pudiera no reconocerse o informarse.
Se han observado 2 tipos de cambios patológicos en relación con las neuropatías diabéticas. El primero es un engrosamiento de las paredes de los vasos nutricios que irrigan al nervio, lo que conduce a asumir que la isquemia vascular desempeña un papel importante en el desarrollo de estos cambios neurales. El segundo hallazgo corresponde al proceso de desmielinización segmentaria que afecta a la célula de Schwann. Este proceso de desmielinización se acompaña de una disminución de la velocidad de la conducción nerviosa.
Si bien existen varias alternativas para clasificar las neuropatías diabéticas, un sistema simplificado las divide en neuropatías somáticas y neuropatías del sistema nervioso autónomo (recuadro 50-4).
Recuadro 50-4. Clasificación de neuropatías diabéticas
Somáticas:
- Polineuropatías (sensitivas bilaterales)
- Parestesias, con anestesia y disestesia.
- Anomalías de la sensibilidad al dolor, temperatura, tacto suave, discriminación entre 2 puntos y vibración.
- Disminución de los reflejos aquíleo y rotuliano.
- Mononeuropatías
- Afectación de un tronco nervioso mixto que genera pérdida de la sensibilidad, dolor y debilidad motora.
- Amiotrofia
- Relacionada con debilidad muscular, desgaste y dolor intenso en los músculos de la cintura pélvica y el muslo.
Autonómicas:
- Disfunción vasomotora
- Hipotensión postural.
- Disfunción gastrointestinal
- Gastroparesia.
- Diarrea, con frecuencia posprandial y nocturna.
- Disfunción genitourinaria
- Vejiga paralítica.
- Vaciamiento vesical incompleto.
- Disfunción eréctil.
- Eyaculación retrógrada.
- Afectación de los pares craneales.
- Parálisis de los músculos extraoculares.
- Anomalías de las respuestas pupilares.
- Anomalías de los sentidos.
Neuropatía somática
La variante más frecuente de neuropatía periférica es una polineuropatía simétrica distal, en la que se presenta pérdida de la función en un patrón de calcetín y guante. La afectación sensorial somática suele ocurrir en primer lugar, al ser bilateral y simétrica, y relacionarse con disminución de la percepción de la vibración, el dolor y la temperatura, en particular en las extremidades inferiores. Además de los malestares vinculados con la pérdida de la función sensitiva o motora, las lesiones del sistema nervioso periférico predisponen al individuo con diabetes a otras complicaciones. La neuropatía periférica muchas veces se relaciona con insensibilidad en el pie. La pérdida de sensibilidad, lo que incluye al tacto y el sentido de posición, incrementa el riesgo de caídas, quemaduras graves y lesiones en los pies. La neuropatía en las extremidades inferiores se relaciona con el 61% de las amputaciones de la extremidad inferior, y la tasa mortalidad a 5 años tras esas amputaciones varía entre el 39% y el 80%.
La neuropatía diabética dolorosa afecta a las neuronas somatosensoriales que conducen los impulsos del dolor. El tratamiento de este trastorno doloroso se logra con intervenciones farmacológicas y holísticas. El consumo de distintos fármacos, como los antidepresivos y los anticonvulsivos, puede tener efectos colaterales que limiten su utilidad. Además del dolor debilitante y del compromiso de la calidad de vida, el tratamiento de la neuropatía periférica y las intervenciones subsecuentes relacionadas con esta complicación generan una carga financiera sobre los recursos para atención de la salud. La pérdida del ingreso, la discapacidad, el tratamiento de la herida, la cirugía, las infecciones, los aparatos protésicos y otras cuestiones se relacionan con esta complicación crónica y frecuente.
Neuropatía autonómica
Las neuropatías autonómicas incluyen trastornos de la función de las divisiones simpática y parasimpática del sistema nervioso. Pueden existir trastornos de la función vasomotora, disminución de la respuesta cardíaca, incapacidad para vaciar la vejiga y disfunción sexual. Los defectos de los reflejos vasomotores pueden provocar mareo y síncope cuando la persona se moviliza de la posición supina a la erecta. En el varón, la disfunción sensitiva y del sistema nervioso autónomo puede generar disfunción sexual. La diabetes es la etiología fisiopatológica principal de la disfunción eréctil (DE), y se presenta tanto en la diabetes tipo 1 como la tipo 2. La disponibilidad actual de un tratamiento farmacológico para la DE permite ofrecer un mejor manejo de esta complicación frecuente, pero debe recibir un seguimiento individual apropiado por las complicaciones cardíacas y otras afecciones que se relacionan con la diabetes.
Trastornos de la motilidad gastrointestinal
Los trastornos de la motilidad gastrointestinal son comunes en individuos con diabetes de larga evolución. Si bien la patogénesis de estos trastornos no se conoce bien, se piensa que la neuropatía y las anomalías metabólicas secundarias a la hiperglucemia desempeñan un papel importante. Los síntomas varían en intensidad, e incluyen estreñimiento, diarrea e incontinencia fecal, náuseas y vómito, y malestar en el hemiabdomen superior que se refiere como dispepsia.
La gastroparesia (retraso para el vaciamiento gástrico) se observa con frecuencia en personas con diabetes. El trastorno se caracteriza por la referencia de malestar epigástrico, náuseas, vómito posprandial, distensión abdominal y saciedad temprana. Puede observarse una glucemia errática por efecto del retraso para la absorción de los alimentos. Las medidas diagnósticas incluyen el empleo de la endoscopia o la radiología barritada para excluir una obstrucción mecánica por enfermedad ulcerosa péptica o cáncer. El manejo incluye la administración de fármacos procinéticos (ej. metoclopramida, eritromicina), así como fármacos antieméticos. También se recomienda el control glucémico estricto junto con el consumo de comidas frecuentes con volumen bajo.
La diarrea es otro síntoma frecuente que se identifica de manera primordial en personas con diabetes tipo 1 mal controlada y neuropatía autonómica. Se piensa que su patogénesis es multifactorial. La diarrea del diabético es de manera característica intermitente, acuosa, indolora y nocturna, y puede relacionarse con incontinencia fecal o alternar con estreñimiento. Su manejo incluye la administración de fibra soluble en la dieta y el consumo de fármacos antidiarreicos (loperamida, difenoxilato). Se han utilizado clonidina (un agonista α 2 -adrenérgico) y octreótido (un análogo de la somatostatina de acción prolongada) con cierto éxito en personas con tránsito rápido.
Se utilizan antibióticos en personas con sobrecrecimiento bacteriano en el intestino delgado secundario al tránsito lento. Al igual que en la gastroparesia, el control estricto de la glucemia es importante.
Nefropatías
La nefropatía diabética es la causa principal de la enfermedad renal crónica, y genera el 40% de los casos nuevos. La complicación afecta a individuos con diabetes tipo 1 y tipo 2, y muchas personas que presentan nefropatía diabética también padecen cierto grado de retinopatía. El desarrollo de la nefropatía diabética también se relaciona con un aumento del riesgo cardíaco, y una causa principal de muerte en individuos con nefropatía diabética es la enfermedad cardiovascular.
El concepto de nefropatía diabética se utiliza para describir una combinación de lesiones que muchas veces tienen lugar de manera concurrente en el riñón del diabético. Las lesiones renales más comunes en individuos con diabetes son las que afectan al glomérulo. Pueden ocurrir distintos cambios glomerulares en las personas con nefropatía diabética, lo que incluye el engrosamiento de la membrana basal capilar, la esclerosis glomerular difusa y la glomeruloesclerosis nodular. Los cambios en la membrana basal capilar se manifiestan por engrosamiento de las membranas basales a lo largo del glomérulo.
La glomeruloesclerosis nodular es una variante de glomeruloesclerosis que implica el desarrollo de lesiones nodulares en los capilares glomerulares de los riñones, lo que genera compromiso del flujo sanguíneo y pérdida progresiva de la función renal y, con el tiempo, insuficiencia renal. Se piensa que la glomeruloesclerosis nodular sólo ocurre en individuos con diabetes. Los cambios en la membrana basal en la glomeruloesclerosis permiten que las proteínas del plasma escapen a la orina, lo que genera proteinuria y desarrollo de hipoproteinemia, edema y otros signos de compromiso de la función renal.
No todas las personas con diabetes desarrollan nefropatía con relevancia clínica; por esta razón, la atención se está concentrando en los factores de riesgo para el desarrollo de esta complicación.
Entre los factores de riesgo sugerido se encuentran la predisposición genética y la familiar, la elevación de la presión arterial, el control deficiente de la glucemia, el tabaquismo, la hiperlipidemia y la microalbuminuria. La nefropatía diabética ocurre en grupos familiares, lo que sugiere una predisposición familiar, esto no excluye la posibilidad de que existan factores ambientales compartidos por los hermanos. El riesgo de desarrollo de enfermedad renal es mayor entre indios estadounidenses, americanos hispanos (en particular mexicanos-estadounidenses) y afroamericanos.
En una fase temprana de la enfermedad se presentan aumento del volumen renal, hipertrofia de las nefronas e hiperfiltración, lo que evidencia el incremento del trabajo realizado por los riñones para reabsorber volúmenes excesivos de glucosa. Una de las primeras manifestaciones de la nefropatía diabética es el aumento de la excreción urinaria de albúmina (es decir, microalbuminuria), que se valora con facilidad mediante laboratorio. Cada año debe realizarse una prueba de orina con tira reactiva para detectar microalbuminuria en todas las personas con diabetes.
La microalbuminuria se define como una pérdida de proteínas en la orina entre 30 mg/día y 300 mg/día, o un índice albúmina/creatinina (índice A/C) de 30 μg/mg a 300 μg/mg (normal <30 μg/mg) en una muestra aleatoria de orina. Una vez que la enfermedad renal se establece la fase de la nefropatía se determina a partir de la tasa de filtración glomerular (TFG).
Las medidas para prevenir la nefropatía diabética o su progresión en personas con diabetes incluyen el establecimiento del control glucémico, el mantenimiento de la presión arterial (<130/80 mm Hg o <120/70 mm Hg en presencia proteinuria significativa), la prevención o la reducción del grado de proteinuria (mediante el empleo de inhibidores de la enzima convertidora de angiotensina o bloqueadores del receptor de angiotensina, o bien con restricción de proteínas en pacientes específicos), el tratamiento de la hiperlipidemia, y la suspensión del tabaquismo en fumadores.
El tabaquismo incrementa el riesgo de nefropatía crónica en personas con y sin diabetes. Los pacientes con diabetes tipo 2 que fuman tienen un riesgo más alto de desarrollar microalbuminuria, y su velocidad de progresión a la nefropatía crónica es casi del doble en relación con los no fumadores.
Retinopatías
La diabetes es la causa principal de pérdida de la visión y ceguera en Estados Unidos. Si bien los individuos con diabetes muestran aumento del riesgo de desarrollo de cataratas y glaucoma, la retinopatía es el patrón más frecuente de oftalmopatía. Se calcula que la retinopatía diabética es la causa más frecuente de ceguera de diagnóstico reciente en estadounidenses de entre los 20 y 74 años.
La retinopatía diabética se caracteriza por una permeabilidad vascular retiniana anómala, formación de microaneurismas, neovascularización, y hemorragia, cicatrización y desprendimiento retiniano asociados. La retinopatía se desarrolla en distintos grados en casi todos los enfermos con diabetes. Embarazo, pubertad y cirugía de cataratas pueden acelerar estos cambios. Entre en los factores de riesgo sugeridos en relación con la retinopatía diabética se encuentran el control deficiente de la glucemia, la elevación de la presión arterial y la hiperlipidemia. El caso más sólido para respaldar el control de la glucemia deriva de los estudios DCCT y UKPDS, que demostraron una reducción de la retinopatía al mejorar el control glucémico.
Por efecto del riesgo de retinopatía, es importante que las personas con diabetes se sometan a exploraciones oftálmicas con dilatación pupilar con regularidad. Deben someterse a una exploración inicial para descartar la retinopatía poco después de establecerse el diagnóstico de diabetes. La recomendación para las exploraciones de seguimiento depende del tipo de exploración realizada y los hallazgos de la misma. Por lo general, todas las personas con diabetes deben someterse a una exploración oftálmica anual, con exploraciones más frecuentes en personas con persistencia del control glucémico deficiente o evidencia de oftalmopatía.
Los individuos con edema de la mácula, retinopatía moderada o grave no proliferativa, o retinopatía proliferativa de cualquier tipo deben recibir atención con un oftalmólogo con conocimiento y experiencia en el control y el tratamiento de la retinopatía diabética. Las técnicas que se utilizan para el tratamiento de la retinopatía diabética incluyen la destrucción y la cicatrización de las lesiones proliferativas mediante la fotocoagulación con láser. La fotocoagulación se aplica en áreas con fuga crónica con el objetivo de disminuirla en quienes presentan edema macular.
Complicaciones macrovasculares
La DM es un factor de riesgo importante para la arteriopatía coronaria, la enfermedad cerebrovascular y la vasculopatía periférica. La prevalencia de estas complicaciones macrovasculares se incrementa entre 2 y 4 veces en personas con diabetes. Alrededor del 50% al 75% de los individuos con diabetes tipo 2 muere por algún problema de origen macrovascular.
Es frecuente la identificación de factores de riesgo múltiples para enfermedad macrovascular en individuos con diabetes, entre otros obesidad, hipertensión, hiperglucemia, hiperinsulinemia, hiperlipidemia, anomalías de la función plaquetaria, disfunción endotelial, inflamación sistémica (como lo evidencia el incremento de la PCR) y aumento de las concentraciones de fibrinógeno. Al parecer existen diferencias entre la diabetes tipo 1 y la tipo 2 desde la perspectiva de la duración de la enfermedad y el desarrollo de la enfermedad macrovascular. Las personas con diabetes tipo 1 tienen un aumento del riesgo de accidentes cardiovasculares, pero pudieran carecer de otros factores de riesgo clásicos, como la obesidad. En personas con diabetes tipo 2 puede existir enfermedad macrovascular en el momento del diagnóstico. El aumento del riesgo de accidentes cardiovasculares en este grupo pudiera vincularse con los componentes del síndrome metabólico. El manejo agresivo de los factores de riesgo cardiovasculares debe incluir la cesación del tabaquismo, la hipertensión, la disminución de los lípidos, el control de la diabetes y la administración de fármacos antiagregantes (ácido acetilsalicílico o clopidogrel) cuando no existe contraindicación. Deben recomendarse con insistencia los cambios del estilo de vida: que disminuyen los factores de riesgo cardiovascular, y recibir respaldo del equipo de atención de la salud. Dieta, ejercicio, pérdida ponderal y control de la glucemia pueden ayudar a limitar la incidencia de accidentes cardiovasculares.
Úlceras del pie diabético
Los problemas en los pies son comunes en personas con diabetes, y pueden adquirir gravedad suficiente para inducir ulceración, infección y, con el tiempo, obligar a una amputación. En personas con diabetes, las lesiones de los pies corresponden a los efectos de la neuropatía y la insuficiencia vascular. Entre el 60% y el 70% de las personas con úlceras del pie diabético presenta neuropatía sin vasculopatía, entre el 15% y el 20% padece vasculopatía, y del 15% al 20% muestra neuropatía y vasculopatía.
La neuropatía simétrica distal es un factor de riesgo importante para las úlceras del pie. Las personas con neuropatía sensitiva tienen anomalías de la sensibilidad al dolor y con frecuencia no están conscientes de traumatismo constante a los pies que generan los zapatos mal ajustados, el apoyo inapropiado del peso, la presencia de objetos duros o piedras en el calzado, o las infecciones como el pie de atleta. La neuropatía impide que las personas detecten el dolor; así, se pasan por alto las lesiones y las infecciones. La neuropatía motora con debilidad de los músculos intrínsecos del pie es capaz de generar deformidad del pie, que dé origen a regiones localizadas de alta presión. Cuando un foco de compresión anómala se combina con la pérdida de la sensibilidad puede desarrollarse una úlcera en el pie. Algunos sitios en que se presenta traumatismo con frecuencia son la parte posterior del talón, y la planta en la región del metatarso o el primer ortejo en que se apoya el peso al caminar (figura 50-11).
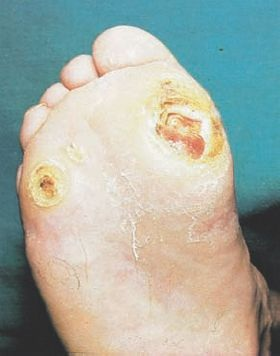
Todas las personas con diabetes deben someterse a una exploración completa de los pies por lo menos una vez al año. Esta revisión debe incluir la valoración de la sensibilidad protectora, la estructura y la biomecánica del pie, la condición vascular y la integridad cutánea. La evaluación de la función neurológica debe incluir una prueba somatosensorial, ya sea con el empleo del monofilamento de Semmes-Weinstein o un dispositivo vibratorio. El monofilamento de Semmes-Weinstein es un dispositivo simple y económico para verificar la condición de la sensibilidad (figura 50-12). El monofilamento se sostiene con la mano o se monta en un mango por uno de sus extremos.
Cuando el extremo libre del monofilamento se comprime contra la piel hasta que se enrolla o se dobla un poco, genera una presión de 10 g en el punto de contacto. La prueba consiste en solicitar a la persona que se somete a la prueba que refiera la sensación al ser tocada con el monofilamento.
Por efecto del riesgo constante de problemas en el pie, resulta crítica la prevención de la lesión o su detección temprana. Es importante que los individuos con diabetes utilicen zapatos con ajuste adecuado y se inspeccionen todos los días los pies, para identificar la formación de ampollas, las heridas abiertas y la infección micótica (es decir, pie de atleta) entre los dedos. Si su visión es baja, un miembro de su familia debe hacerlo por ellos. Se requiere instrucción que dé respaldo a la solicitud rápida de atención médica de existir lesiones cutáneas, con el objetivo de prevenir las complicaciones graves. Debe evitarse el tabaquismo, puesto que genera vasoconstricción y contribuye a la vasculopatía. Debido a que el frío induce vasoconstricción debe recurrirse a cubiertas apropiadas para el pie con el objetivo de mantenerlo caliente y seco. Las uñas de los pies deben cortarse rectas, para prevenir su encarnación. Las uñas de los pies con frecuencia se engrosan y deforman, por lo que se requieren los servicios de un podólogo. El automanejo de los problemas de los pies en esta población debe ser fuertemente desalentado, como en el caso de las dificultades relacionados con las uñas de los pies, los callos y otras cuestiones.
Los avances en el campo de la atención de las heridas crónicas han multiplicado las opciones terapéuticas para esta población. Las úlceras que son refractarias al tratamiento estandarizado pudieran responder a la aplicación de factores de crecimiento. Los factores de crecimiento aportan un medio por el cual las células se comunican entre si, y pueden tener efectos profundos sobre la proliferación celular, la migración y la síntesis de la matriz extracelular. El empleo del tratamiento con oxígeno hiperbárico, los servicios especializados para atención de las heridas y las cirugías de invasión mínima constituyen alternativas para la atención de las heridas, pero intensifican la carga financiera que genera la diabetes sobre los recursos para atención de la salud.
Infecciones
Si bien no se trata de una complicación aguda o crónica en si misma, la infección es una problemática frecuente en las personas con diabetes. Ciertos tipos de infecciones se presentan con mayor frecuencia en los individuos diabéticos: infecciones de los tejidos blandos en las extremidades, osteomielitis, infecciones de las vías urinarias bajas y pielonefritis, infecciones candidiásicas en la piel y en las superficies mucosas, caries dental y enfermedad periodontal. La respuesta subóptima a la infección en personas con diabetes deriva de la presencia de complicaciones crónicas, como vasculopatía y neuropatía, y por la presencia de hiperglucemia y anomalías de la función de los neutrófilos. Los defectos sensoriales pueden hacer que la persona con diabetes ignore los traumatismos menores y la infección, y la vasculopatía pudiera alterar la circulación y la llegada de las células hemáticas y otras sustancias necesarias para permitir una respuesta inflamatoria adecuada y lograr la cicatrización. La hiperglucemia y la glucosuria pueden influir sobre el crecimiento de los microorganismos e intensificar la infección. En los cuadros agudos, los esfuerzos mayores para el control de la glucemia en pacientes quirúrgicos y con condiciones médicas tienen impacto sobre las infecciones.
Una vez que se diagnostica diabetes, de manera independiente de su tipo, el afectado debe trabajar junto con un equipo de atención de la salud para lograr un control óptimo de la glucemia y someterse con regularidad a la detección de complicaciones. Estas recomendaciones incluyen la realización de cuantificaciones de A1C entre 2 y 4 veces por año de acuerdo con el grado de control, y la exploración oftálmica con dilatación pupilar, la exploración de los pies, y la determinación del perfil lipídico, la microalbuminuria, la creatinina sérica, la presión arterial y el peso una vez al año.
La prevención y la postergación de las complicaciones es posible mediante el apego a intervenciones del estilo de vida que respalden la salud, como una nutrición adecuada, el ejercicio y la atención preventiva.