03. Inmunidad adaptativa
Antígenos
Los antígenos, o inmunógenos, son sustancias o moléculas extrañas al organismo, pero que cuando se introducen desencadenan la producción de anticuerpos en los linfocitos B, lo que origina la destrucción final del invasor. Suelen ser macromoléculas grandes (>10.000 Da), como proteínas, polisacáridos, lípidos y ácidos nucleicos libres. Los antígenos son reconocidos por receptores específicos existentes en la superficie de los linfocitos, y por los anticuerpos o inmunoglobulinas que se secretan en respuesta al antígeno. Pueden tomar la forma de cualquier sustancia extraña, entre otras, bacterias, hongos, virus, protozoarios, parásitos y agentes distintos a los microbios, como pólenes, veneno de insectos y órganos trasplantados.
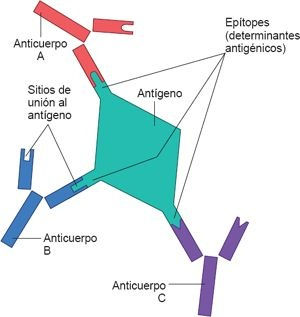
Desde la perspectiva inmunológica, los antígenos poseen sitios activos denominados determinantes antigénicos, o epítopes. Se trata de componentes más pequeños y discretos del antígeno, que tienen una configuración molecular única, a la que puede reconocer y unirse un receptor de Ig específico ubicado en la superficie del linfocito o el sitio de unión a antígenos de un anticuerpo secretado (figura 13-4). No es inusual que un solo antígeno posea varios determinantes antigénicos y, por ende, sea capaz de estimular a varios linfocitos T y B distintos. Por ejemplo, diversas proteínas que conforman al virus de la gripe pueden actuar como antígenos independientes (antígenos A, B, C, H y N); cada uno de éstos contienen varios determinantes antigénicos. En estructuras como la pared celular bacteriana se encuentran cientos de determinantes antigénicos.
Las moléculas de peso molecular bajo (<10.000 Da) pueden contener determinantes antigénicos, pero en forma aislada rara vez son capaces de estimular una respuesta inmunitaria. Estas moléculas se conocen como haptenos. Cuando forman un complejo con algún portador inmunogénico (por lo general, una proteína), tienen capacidad para actuar como antígenos. Existen muchos haptenos en la naturaleza y con frecuencia generan problemas a los humanos. El urushiol es una toxina que se encuentra en los aceites de la hiedra venenosa; es responsable de desencadenar una reacción alérgica.
Una respuesta alérgica a la penicilina constituye un ejemplo de reacción con importancia médica derivada de la formación de complejos hapteno-portador. La molécula de la penicilina es muy pequeña (350 Da) y por lo general no es antigénica. Sin embargo, en personas susceptibles puede formar complejos con proteínas portadoras en el organismo, que entonces se reconocen como «ajenas» y pueden provocar una reacción antígeno-anticuerpo.
Células de la inmunidad adaptativa
Las principales células del sistema inmunitario adaptativo son los linfocitos, las CPA y las células efectoras.
Linfocitos
Constituyen alrededor del 36% del conteo leucocitario total y son las células primordiales de la respuesta inmunitaria adaptativa. Derivan de la línea de células troncales linfoides en la médula ósea; se diferencian en 2 tipos celulares distintos, pero interrelacionados: los linfocitos B y los linfocitos T. Los primeros son responsables de la síntesis de los anticuerpos que proveen la inmunidad humoral, en tanto que los linfocitos T se encargan de la inmunidad mediada por células. Los linfocitos T y B son únicos, en el sentido de que son las únicas células del organismo capaces de reconocer antígenos específicos presentes en las superficies de los agentes microbianos y otros patógenos. En consecuencia, los procesos inmunitarios adaptativos son específicos contra el microorganismo y poseen la capacidad de tener memoria.
El reconocimiento de antígenos de superficie específicos por los linfocitos es posible gracias a la presencia de receptores específicos o anticuerpos en la superficie de los linfocitos B y T. Los científicos han podido identificar estas proteínas específicas y correlacionarlas con una función celular específica. Esto ha llevado al desarrollo de un sistema de clasificación para estas moléculas de superficie que se conocen como «cúmulos de diferenciación» (CD). La nomenclatura para las proteínas de superficie recurre a las letras CD seguidas por un número que especifica las proteínas de superficie que definen a un tipo celular específico o a una fase de diferenciación celular, y que son reconocidas por un cúmulo o grupo de anticuerpos. La utilización de esta nomenclatura se ha extendido a otras células inmunitarias y citosinas. Todas ellas contribuyen a la respuesta inmunitaria adquirida.
Los leucocitos implicados en la respuesta inmunitaria innata, como los macrófagos y las CDN, también desempeñan un papel clave en la inmunidad adaptativa, ya que actúan como CPA. Son capaces de procesar antígenos complejos en epítopes, que luego se presentan en sus membranas celulares a fin de activar a los linfocitos apropiados. Desde el punto de vista funcional, existen 2 tipos de células inmunitarias: las reguladoras y las efectoras. Las células reguladoras ayudan a organizar y controlar la respuesta inmunitaria, mientras que las células efectoras llevan a cabo la eliminación del antígeno (microbiano, no microbiano o toxina). En el organismo, los linfocitos T cooperadores activan a otros linfocitos y fagocitos, en tanto que las células T reguladoras mantienen a estas células en línea, para evitar que se presente una respuesta inmunitaria exagerada. Los linfocitos T citotóxicos, los macrófagos y otros leucocitos actúan como células efectoras en distintas respuestas inmunitarias.
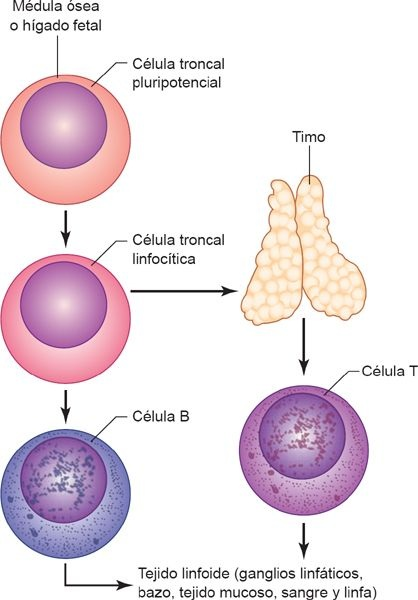
Los linfocitos T y B se generan a partir de las células troncales linfoides en la médula ósea, pero no permanecen en ella para madurar. Los linfocitos inmaduros indiferenciados migran hacia los tejidos linfoides, donde se desarrollan para constituir tipos distintos de linfocitos maduros (figura 13-5). Los linfocitos T migran primero hacia el timo, donde se dividen con rapidez y desarrollan una gran diversidad en relación con su capacidad para reaccionar contra distintos antígenos. Cada linfocito T desarrolla especificidad contra un antígeno determinado. Una vez que tiene lugar esta diferenciación, los linfocitos dejan el timo y migran por el torrente sanguíneo hacia el tejido linfoide periférico. En ese momento se encuentran programados para no atacar los tejidos propios del organismo. Desafortunadamente, se piensa que en muchos trastornos autoinmunitarios este proceso muestra algún defecto. Los linfocitos B maduran sobre todo en la médula ósea; son esenciales para la inmunidad humoral, o mediada por anticuerpos. A diferencia de los linfocitos T, cuya célula entera participa en la respuesta inmunitaria, los linfocitos B segregan anticuerpos, que luego actúan como un agente reactivo en el proceso inmunitario. Por ende, los linfocitos se distinguen por su función y respuesta contra el antígeno, sus moléculas y receptores de membrana celular, los tipos de proteínas que segregan y su localización tisular. En el tejido linfoide de todo el cuerpo se identifican concentraciones elevadas de linfocitos maduros, como en los ganglios linfáticos, el bazo, la piel y los tejidos mucosos.
Los linfocitos T y B poseen todas las características necesarias para la respuesta inmunitaria adaptativa: especificidad, diversidad, memoria y reconocimiento de lo propio y lo ajeno. Cuando los antígenos entran en contacto con los linfocitos en los tejidos linfoides del cuerpo, las células T específicas se activan y las células B específicas son estimuladas para sintetizar anticuerpos. Una vez que tiene lugar el primer encuentro, estas células pueden reconocer con exactitud a un microorganismo específico o una molécula extraña, puesto que cada linfocito T es capaz de dirigirse contra un antígeno específico y diferenciar al invasor de lo propio o de otras sustancias que pudieran ser similares a aquél. La inmunidad mediada por células y de tipo humoral es capaz de responder a millones de antígenos cada día, puesto que existe una enorme variedad de linfocitos programados y seleccionados durante el desarrollo celular. Una vez que la sustancia o el microorganismo invasor se eliminan, los linfocitos «recuerdan» al antígeno presentado y pueden responder con rapidez durante el encuentro siguiente. Estos linfocitos se denominan linfocitos T y B de «memoria». Permanecen en el organismo durante un período mayor que sus predecesores y, en consecuencia, pueden responder con más rapidez si se repite la exposición. El sistema inmunitario suele responder con tal eficiencia contra microorganismos que se encuentran con frecuencia, que nunca nos percatamos de la respuesta.
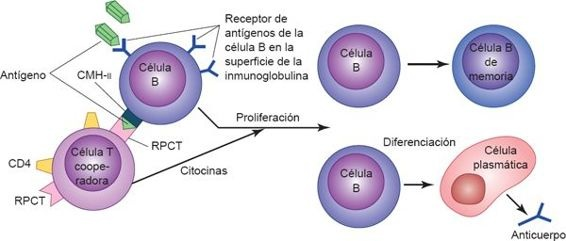
La activación de los linfocitos B y T se desencadena por la presentación de antígenos a receptores de superficie únicos (figura 13-6). El receptor de antígenos que existe en el linfocito B está constituido por moléculas de Ig unidas a la membrana, que pueden enlazarse con un epítope específico. Sin embargo, para que los linfocitos B sinteticen anticuerpos se requiere la ayuda de linfocitos T específicos, denominados células T cooperadoras. Mientras que los linfocitos B se unen a un determinante (o hapteno) en una molécula antigénica, la célula T cooperadora específica contra el antígeno lo reconoce y se une a otro determinante conocido como «portador». El portador es una CPA que recogió antes el antígeno especificado. Esta interacción (célula B-célula T-CPA) se restringe ante la presencia de productos celulares codificados por vía genética a manera de una proteína de reconocimiento de lo propio, denominada complejo mayor de histocompatibilidad (CMH), lo que permite al linfocito diferenciar entre lo propio y los péptidos extraños.
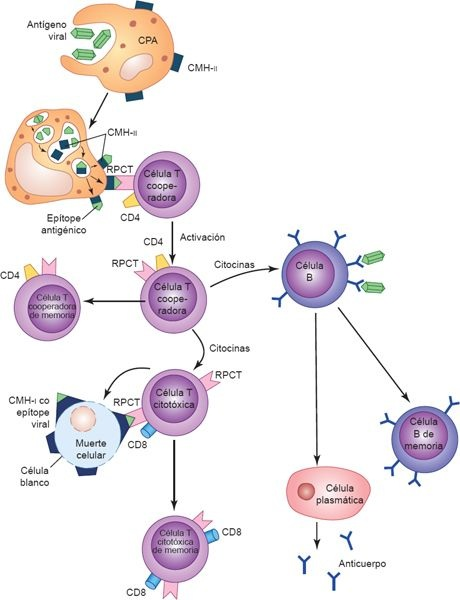
Una vez que los linfocitos B y T se activan y amplifican por efecto de las citocinas liberadas como parte de la respuesta innata, los linfocitos se dividen varias veces para constituir poblaciones o clonas de células que continúan diferenciándose en varios tipos de células efectoras y de memoria. En la respuesta inmunitaria adaptativa, las células efectoras destruyen a los antígenos y las células de memoria retienen la capacidad para dirigirse contra el antígeno en encuentros futuros.
Moléculas del complejo mayor de histocompatibilidad
Para que la respuesta inmunitaria adaptativa funcione de manera apropiada, debe ser capaz de discriminar entre las moléculas que son nativas del organismo y las que son extrañas o dañinas. Los linfocitos T están diseñados para responder contra un número ilimitado de antígenos, pero al mismo tiempo deben ser capaces de ignorar a los antígenos propios expresados en los tejidos. Las moléculas del CMH permiten a los linfocitos hacer justo esto. El CMH es un cúmulo grande de genes ubicado en el brazo corto del cromosoma 6. El complejo ocupa alrededor de 4 millones de pares de bases y contiene 128 genes diferentes, de los cuales sólo algunos desempeñan algún papel en la respuesta inmunitaria. Los genes del CMH se dividen en 3 clases: I , II y III , de acuerdo con su función subyacente (figura 13-7).
Los genes de las clases I y II del CMH son responsables de codificar los antígenos leucocitarios humanos (ALH): proteínas que se ubican en las superficies celulares y definen el tipo tisular de la persona. Estas moléculas se encuentran en las glucoproteínas de superficie celular que forman la base para la tipificación del tejido humano. Cada persona cuenta con una acumulación única de proteínas del CMH que corresponde a una serie única de polimorfismos. Los polimorfismos del CMH modifican las respuestas inmunitarias y, también, la susceptibilidad a distintas enfermedades. Ante el número de genes del CMH y la posibilidad de que existan varios alelos para cada gen, es casi imposible que dos individuos tengan un perfil de CMH idéntico.
Además, los genes de las clases I y II del CMH codifican proteínas que desempeñan un papel importante en la presentación de antígenos. Fragmentos de proteína que provienen del interior de la célula se presentan en el complejo CMH en la superficie celular, lo que permite al sistema inmunitario diferenciar entre los tejidos propios del cuerpo y las sustancias extrañas. Las células que presentan fragmentos peptídicos en la superficie celular que no resultan familiares son atacadas y destruidas por los linfocitos B y T. Los genes de la clase III del CMH codifican muchos de los componentes del sistema del complemento y tienen un papel significativo en el proceso de la inmunidad innata.
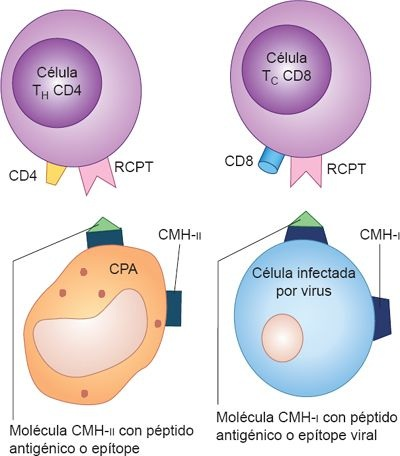
Los complejos moleculares del CMH de clase I (CMH-I) tienen una hendidura que da cabida a un fragmento peptídico. Las células T citotóxicas sólo pueden activarse si se les presenta un péptido antigénico extraño. Los complejos CMH-I pueden presentar fragmentos degradados de proteínas virales que obtienen de células infectadas. Las moléculas de clase II del CMH (CMH-II) se encuentran sólo en las CPA fagocíticas, células inmunitarias que endocitan partículas extrañas, como bacterias y otros microbios. Esto incluye a los macrófagos, las CDN y a los linfocitos B, que se comunican con el receptor de antígeno y la molécula CD4 en los linfocitos T cooperadores.
Al igual que las proteínas de clase I del CMH, las de clase II tienen una hendidura o zanja que se une a un fragmento del antígeno. Sin embargo, en ellas se unen fragmentos de patógenos que fueron endocitados y digeridos durante el proceso de fagocitosis. El patógeno endocitado se degrada para obtener fragmentos peptídicos libres dentro de las vesículas citoplásmicas, y luego se utilizan para formar complejos con las moléculas CMH-II en la superficie de las células. Las células T cooperadoras reconocen a estos complejos en la superficie de las CPA y se activan.
Las primeras proteínas humanas del CMH descubiertas se conocen como antígenos leucocitarios humanos (ALH); se llaman así porque se identificaron en la superficie de los leucocitos. Los ALH son un blanco central que participa en el rechazo del trasplante de órganos; en consecuencia, en ellos se concentra gran parte de la investigación sobre la inmunología. El análisis reciente de los genes de las moléculas de los ALH ha permitido una comprensión más precisa de las proteínas que participan en esta respuesta. Las moléculas CMH-I clásicas del humano se dividen en los tipos ALH-A, ALH-B y ALH-C, mientras que las moléculas CMH-II se identifican como ALH-DR, ALH-DP y ALH-DQ (tabla 13-3). Alelos múltiples o genes alternativos pueden ocupar cada uno de los locus genéticos que codifican las moléculas de ALH. Se han identificado más de 350 alelos posibles para el locus A, 650 alelos para el locus B y 180 alelos para el locus C. Estos genes y las moléculas del CMH que se expresan, se designan utilizando una letra y números (ej. ALH-B27).
| Propiedades | Antígenos ALH | Distribución | Funciones |
|---|---|---|---|
| CMH clase 1 | ALH-A, ALH-B, ALH-C | Casi todas las células nucleadas | Presentan antígeno procesado a las células T CD8+ citotóxicas; restringen la citólisis a las células infectadas por virus, las células tumorales y las células trasplantadas |
| CMH clase II | ALH-DR, ALH-DP, ALH-DQ | Células inmunitarias, células presentadoras de antígenos, células B y macrófagos | Presentan fragmentos antigénicos procesados a las células T CD4+; necesarias para la interacción efectiva entre las células inmunitarias |
Los genes ALH se heredan como una unidad completa; se denomina haplotipo, puesto que los genes CMH-I y II se encuentran formando un vínculo estrecho en un cromosoma. Ya que cada persona hereda un cromosoma de cada progenitor, cuenta con dos haplotipos ALH. En la medicina forense y en el trasplante de órganos la tipificación de los tejidos incluye la identificación de estos haplotipos.
En el trasplante de órganos o tejidos, entre mayor correspondencia exista entre los tipos de ALH, mayor será la probabilidad de que cuente con antígenos idénticos, y menor la posibilidad de que se presente el rechazo. Sin embargo, no todas las personas que experimentan el rechazo de órganos tras el trasplante desarrollan anticuerpos contra ALH. Existen antígenos blanco que no son del tipo del ALH, lo que incluye a los antígenos de cadena tipo A relacionados con la clase I del CMH (CMH class I chain-related antigens A, MICA por sus siglas en inglés). Estos antígenos se expresan en las células epiteliales, los monocitos, los fibroblastos y las células endoteliales; por tanto, estos anticuerpos específicos del donador no se detectan antes de la tipificación del tejido orgánico que se realiza previo al trasplante, pues no se expresan en los leucocitos estudiados.
Células presentadoras de antígeno
Durante la respuesta inmunitaria adaptativa, la activación de los linfocitos T requiere el reconocimiento de un péptido extraño (antígeno) unido a una molécula propia del CMH. Este proceso necesita que se emitan señales estimuladoras en forma simultánea al linfocito T a partir de otra célula especializada, conocida como célula presentadora de antígeno (CPA). Por ende, las CPA desempeñan un papel clave al formar un puente entre los sistemas inmunitarios innato y adaptativo mediante la regulación positiva de las moléculas CMH-II conducida por las citocinas. Las células que actúan como CPA deben ser capaces de expresar las 2 clases de moléculas CMH, e incluyen a las CDN, los monocitos, los macrófagos y los linfocitos T que residen en los folículos linfoides. Bajo ciertas condiciones, las células endoteliales también pueden actuar como CPA. Se ha demostrado que éstas juegan un papel importante en el desarrollo de trastornos autoinmunitarios y la ateroesclerosis. Los linfocitos T activados parecen ser proaterógenos; en modelos experimentales la disminución de CPA y células T se ha relacionado con una reducción de la ateroesclerosis de hasta el 80%.
Los macrófagos actúan como una CPA importante. Son células clave del sistema fagocítico mononuclear, y endocitan y digieren a los microbios y a otras sustancias extrañas que logran acceder al cuerpo. Dado que los macrófagos derivan de los monocitos en la sangre, pueden desplazarse con libertad por todo el organismo hasta un sitio de acción apropiado. Los macrófagos tisulares se encuentran diseminados en el tejido conectivo o se acumulan en órganos como los pulmones (es decir, macrófagos alveolares), el hígado (es decir, células de Kupffer), el bazo, los ganglios linfáticos, el peritoneo, el sistema nervioso central (es decir, células de la microglía) y en otras áreas.
Los macrófagos se activan durante la respuesta inmunitaria innata, caso en que endocitan y degradan los antígenos complejos para obtener fragmentos peptídicos. Estos elementos pueden entonces asociarse a las moléculas CMH-II para presentarse a las células de la respuesta «mediada por células», de tal modo que pueda darse el reconocimiento de lo propio y lo ajeno a la par de la activación de la respuesta inmunitaria.
Las CDN también son responsables de la presentación de antígenos procesados a los linfocitos T activados. La estructura similar a la de una estrella que poseen las CDN define un área de superficie amplia, rica en moléculas CMH-II , así como otras moléculas que no pertenecen al ALH y son importantes para el inicio de la inmunidad adaptativa. Las CDN se ubican en todo el organismo, en los tejidos por los que el antígeno ingresa al cuerpo y en los tejidos linfoides periféricos. Tanto las CDN como los macrófagos son capaces de «especializarse», lo que depende de su ubicación en el organismo. Por ejemplo, las células de Langerhans son CDN especializadas en la piel, en tanto que las CDN foliculares se encuentran en los ganglios linfáticos. Las células de Langerhans trasportan antígenos que se ubican en la piel hasta los ganglios linfáticos cercanos, para ser destruidos. Además, participan en el desarrollo de las reacciones inmunitarias mediadas por células, como en la dermatitis por contacto alérgica tipo IV. Por último, las CDN se encuentran en el recubrimiento mucoso del intestino, y se les ha relacionado en el desarrollo de trastornos intestinales inflamatorios, como la enfermedad de Crohn y la colitis ulcerosa, en los que presentan antígenos a los linfocitos B y T mediante la producción de citocinas proinflamatorias.
Linfocitos B e inmunidad humoral
La respuesta inmunitaria humoral es mediada por anticuerpos sintetizados por los linfocitos B. Las funciones principales de éstos son la eliminación de microbios extracelulares y toxinas, y la «memoria» subsecuente para lograr una respuesta más intensa en los encuentros posteriores. En la defensa contra los microbios con cápsulas ricas en polisacáridos y toxinas lipídicas la inmunidad humoral es más importante que la celular, ya que sólo los linfocitos B pueden responder y sintetizar anticuerpos específicos contra muchos de estos tipos de moléculas. Las células T, mediadoras de la inmunidad celular, responden sobre todo a los antígenos proteicos de superficie.
Los linfocitos B se producen en la médula ósea y se clasifican con base en sus proteínas CMH-II , Ig y receptores del complemento que expresan en la membrana celular. Durante el desarrollo tiene lugar un reacomodo de los genes para Ig, a fin de asegurar que sólo los linfocitos B sean capaces de producir anticuerpos (Ig). En cada fase del desarrollo se expresa un patrón de genes para Ig específico de la célula, que luego actúa como marcador fenotípico de esas fases de maduración. Las células progenitoras de los linfocitos B se conocen como pro-B y pre-B, y se desarrollan tanto en linfocitos B maduros como vírgenes en la médula ósea. Los linfocitos B vírgenes (o inmaduros) muestran IgM en su superficie celular. Estas células inmaduras responden a los antígenos de manera distinta a como lo hace la célula B madura. Pueden sufrir una eliminación funcional del organismo al presentar una interacción con un antígeno propio, al sufrir muerte celular programada (apoptosis) o por el proceso de anergia, en el que dejan de responder en presencia del antígeno. Los linfocitos B vírgenes pueden salir de la médula ósea y migrar hacia tejidos periféricos o linfoides secundarios, como el bazo y los ganglios linfáticos, donde terminan su proceso de maduración. Una vez que los linfocitos B maduran del todo, pueden expresar IgD, además de la IgM que existe en la superficie de su membrana celular. Los linfocitos B maduros tienen capacidad para responder en forma completa contra los antígenos y para interactuar con las células T.
La asignación de una línea de células B contra un antígeno específico se hace evidente por la expresión de los receptores Ig unidos a su membrana, que reconocen al antígeno específico. Al inicio, cuando los linfocitos B maduros encuentran antígenos complementarios a su receptor Ig de superficie codificado, y ante la presentación de antígenos por los linfocitos T, sufren una serie de cambios de conformación que los transforma en células plasmáticas secretoras de anticuerpos o en células B de memoria (figura 13-8). Los 2 tipos celulares son necesarios para el éxito definitivo de la respuesta humoral. Los anticuerpos que sintetizan las células plasmáticas se liberan hacia la linfa y la sangre, donde pueden unirse y eliminar su antígeno específico con la ayuda de otras células efectoras inmunitarias y moléculas. Los linfocitos B de memoria tienen un período de vida mayor y se distribuyen hacia los tejidos periféricos a fin de prepararse para la exposición subsecuente a antígenos.
Inmunoglobulinas
Los anticuerpos son moléculas proteicas que también se conocen como inmunoglobulinas. Con base en el papel que desempeñan en los mecanismos de defensa humoral, las Ig se clasifican en 5 categorías distintas: IgG, IgA, IgM, IgD e IgE. La estructura clásica de las Ig está conformada por 4 cadenas polipeptídicas con por lo menos 2 sitios de unión al antígeno idénticos (figura 13-9). Cada Ig se compone de 2 cadenas ligeras (L) idénticas y 2 cadenas pesadas (P) idénticas, que constituyen una molécula característica en forma de «Y». Los extremos en «Y» de la molécula de Ig alojan los sitios de unión para el antígeno y se denominan fragmentos de unión a antígeno (FUA). La cola de la molécula, que se conoce como fragmento Fc, determina las características biológicas y funcionales de la clase de Ig.
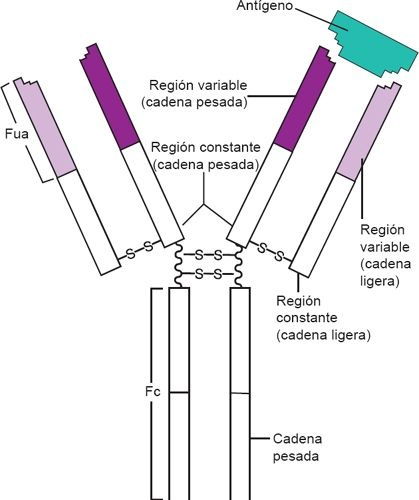
Las cadenas pesadas y ligeras de la Ig cuentan con ciertas secuencias de aminoácidos que muestran regiones constantes (C) y variables (V). Las primeras tienen secuencias de aminoácidos que varían poco entre los anticuerpos de una clase específica de Ig y determinan la clasificación de la Ig particular (ej. IgG, IgE). De esta manera, las regiones constantes determinan la función efectora de un anticuerpo determinado. Por ejemplo, la IgG puede marcar a un antígeno para que sea reconocido y destruido por los fagocitos. En contraste, las secuencias de aminoácidos de las regiones variables difieren de un anticuerpo a otro. También contienen los sitios de unión al antígeno de la molécula específica. Las distintas secuencias de aminoácidos que se encuentran en estos sitios de unión permiten que esta región del anticuerpo reconozca a su epítope complementario (antígeno). La secuencia variable de aminoácidos determina la configuración del sitio de unión, para conformar una bolsa tridimensional complementaria al antígeno específico. Cuando los linfocitos B se dividen, forman clonas que producen anticuerpos con regiones de unión al antígeno idénticas. Durante elcurso de la respuesta inmunitaria es posible que se presente un cambio de clase (ej. de IgM a IgG), lo que hace que la clona de células B sintetice un tipo distinto de Ig.
La IgG (gammaglobulina) es la más abundante entre las Ig, y constituye hasta el 75% de los anticuerpos circulantes totales. Es una molécula grande, con un peso molecular aproximado de 150 kDa, y está compuesta por 2 tipos distintos de cadena polipeptídica. La IgG posee propiedades antivirales, antibacterianas y contra toxinas. Se encuentra en todos los fluidos corporales, ingresa con facilidad en los tejidos y es capaz de atravesar la placenta, para conferir inmunidad al feto. Para un funcionamiento integral de la IgG se requiere la ayuda de las CPA. Se une a las células blanco y también a los receptores Fc de las células NK y los macrófagos, lo que conduce a la lisis de la célula blanco. Existen 4 subtipos de IgG (IgG1, IgG2, IgG3 e IgG4), con especificidad contra ciertas clases de antígenos. Por ejemplo, la IgG2 parece responder ante bacterias encapsuladas con una capa de lipopolisacáridos, como la Streptococcus pneumoniae, Neisseria gonorrhoeae y varias cepas de Salmonella.
La IgA posee una estructura dimérica, es la segunda Ig más común en el suero y constituyealrededor del 15% de todos los anticuerpos. Es sobre todo una Ig secretora; se encuentra en saliva, lágrimas y calostro (es decir, la primera leche que produce la madre en lactancia), y en secreciones bronquiales, gastrointestinales, prostáticas y vaginales. Dado que se halla especialmente en las secreciones, su función primordial es la inmunidad local en las superficies mucosas. La IgA evita la adherencia de los virus y las bacterias a las células epiteliales.
La IgM corresponde a cerca del 10% de todos los anticuerpos circulantes. De manera habitual existe en forma de pentámero, con cadenas pesadas y cadenas ligeras idénticas. Por efecto de su estructura, es una Ig eficiente para la fijación del complemento, además de fundamental en la lisis final de los microorganismos. También actúa como un anticuerpo aglutinante efectivo, capaz de formar cúmulos de organismos para su lisis y eliminación eventuales. Es el primer anticuerpo que se sintetiza en el feto en desarrollo y en los linfocitos B inmaduros.
La IgD es un monómero que se encuentra sobre todo en las membranas celulares de los linfocitos B, donde actúa como receptor para el antígeno. Circula en el suero, en concentraciones en extremo bajas. Ahí, su función es en esencia desconocida. La IgD en la superficie de los linfocitos B contiene aminoácidos adicionales en su extremo C-terminal, de tal manera que puede anclarse con éxito la membrana. También se asocia a las cadenas de Ig α y β.
La IgE es la Ig menos frecuente en el suero, dado que se une con gran solidez a los receptores Fc en los basófilos y las células cebadas. Participa en la inflamación y las respuestas alérgicas, al inducir la desgranulación de las células cebadas y liberar mediadores químicos como la histamina. La IgE también es esencial para combatir las infecciones parasitarias.
Inmunidad humoral
La inmunidad humoral requiere la presencia de linfocitos B maduros capaces de reconocer antígenos, y que al final puedan convertirse en células plasmáticas secretoras de anticuerpos. La respuesta última de la formación del complejo antígeno-anticuerpo puede tomar varias formas, entre otras, la precipitación del complejo antígeno-anticuerpo, la aglutinación de los patógenos, la neutralización de las toxinas, la fagocitosis o la lisis de los organismos invasores, la activación de células inmunitarias y la activación del complemento.
En el desarrollo de la inmunidad humoral tienen lugar 2 respuestas interrelacionadas, pero independientes: una respuesta primaria y una secundaria (figura 13-10). Se desarrolla una respuesta inmunitaria primaria cuando el cuerpo encuentra al antígeno por vez primera. El antígeno entra en contacto con diferentes CPA, lo que incluye a macrófagos, CDN y linfocitos B. El antígeno se procesa en estas células al asociarse a las moléculas CMH-II en la superficie celular, y luego se presenta a los linfocitos (es decir, células T cooperadoras CD4+) para iniciar el proceso inmunitario.
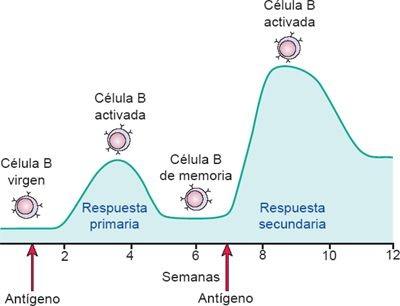
Células presentadoras de antígenos como los macrófagos también secretan IL, esenciales para la activación de las células T cooperadoras CD4+. Las células T cooperadoras CD4+ activadas inducen a las células B para proliferar y diferenciarse en clonas de células plasmáticas que sintetizan anticuerpos. La respuesta inmunitaria primaria requiere entre 1 y 2 semanas para integrarse, pero una vez que se genera las concentraciones detectables de anticuerpos siguen elevándose durante varias semanas, incluso si el proceso infeccioso se ha resuelto. La fase de memoria o respuesta inmunitaria secundaria tiene lugar ante la exposición subsecuente al antígeno. Durante la respuesta secundaria, el aumento del anticuerpo se da con más rapidez y alcanza una concentración mayor debido a la disponibilidad de células de memoria.
Durante la respuesta primaria, los linfocitos B proliferan y se diferencian en células plasmáticas secretoras de anticuerpos. Una fracción de las células B activadas no sufre diferenciación, permanece intacta para constituir una reserva de linfocitos B de memoria que luego se mantienen disponibles para responder con eficiencia a la invasión durante una exposición subsecuente. Las células T activadas también generan respuestas inmunitarias primarias y secundarias mediadas por células, al tiempo que inducen el desarrollo concurrente de células T de memoria.
El proceso de inmunización apela a las respuestas inmunitarias primaria y secundaria. La vacunación inicial genera la producción tanto de células plasmáticas como de células de memoria.
Las primeras destruyen al organismo o a la toxina invasores; por su parte, las células de memoriaaportan la defensa contra alguna exposición posterior. Las vacunaciones de «refuerzo» provocan una respuesta inmediata antígeno-anticuerpo, que estimula el incremento inmediato de las concentraciones de anticuerpos. Estudios clínicos actuales de fase I sobre inmunización clínica para el tratamiento del cáncer revelan la infiltración densa de linfocitos T CD4+ y CD8+ y células plasmáticas en tumores preexistentes, tras la vacunación con células malignas irradiadas.
Linfocitos T e inmunidad celular
Los linfocitos T tienen muchas funciones en el sistema inmunitario, como la activación de otras células T y células B, el control de las infecciones virales intracelulares, el rechazo del injerto de tejido ajeno, la activación de los procesos autoinmunitarios y la activación de las reacciones de hipersensibilidad tardía. Estos procesos constituyen la inmunidad celular o mediada por células del organismo. Los linfocitos T y los macrófagos llevan a cabo la fase efectora de la inmunidad mediada por células.
Los linfocitos T derivan de células troncales linfoides en la médula ósea, pero a diferencia de los linfocitos B migran hacia el timo, donde tiene lugar su proceso de maduración. El timo tiene inervación rica y produce varias hormonas peptídicas, como la timulina y la timopoyetina que, se piensa, participan en la maduración de las células T. Las precursoras de éstas son atraídas por el timo, por efecto de la timotaxina, un factor quimiotáctico que secretan las células epiteliales de este órgano.
Una vez que el protimocito ingresa a la corteza del timo, se expresa la transferasa del desoxinucleotidilo terminal (TdT), que genera un reacomodo genético y un incremento en la diversidad de los RPCT. Los prelinfocitos T se designan CD3+, CD4+ , CD8+ y células con doble negatividad. La mayoría de estas células experimenta un reacomodo de sus segmentos genéticos de cadenas α y β. El segmento β se expresa primero, lo que origina la formación de un pre-RPCT. Esto detiene el reacomodo adicional de los genes, incrementa el reacomodo de los genes de la cadena α e induce la maduración completa y la expresión de linfocitos CD4+ (cooperadores) y CD8+ (citotóxicos), los linfocitos predominantes en el cuerpo humano. Los linfocitos T maduros dejan el timo y migran hacia los tejidos linfoides periféricos, donde se multiplican y diferencian en células T de memoria y varios linfocitos maduros más al encontrarse con un antígeno.
En el linfocito maduro el RPCT se compone de 2 polipéptidos, que se pliegan para constituir una hendidura que reconoce a los complejos formados por el antígeno peptídico procesado y la molécula CMH. Está conformado por 2 moléculas transmembrana, la RPCT-α y la RPCT-β, que derivan de un reacomodo, en primer lugar del gen para la RPCT-β y luego del de la RPCT-α. La mayor parte de los RPCT reconocen péptidos antigénicos que se encuentran unidos a las moléculas derivadas del CMH. El RPCT se relaciona con distintas moléculas de superficie, como CD4 y CD8. La CD4 se asocia a la célula T cooperadora, y la CD8 se asocia a la célula T citotóxica. CD4 y CD8 ayudan a estabilizar al complejo RPCT-antígeno-CMH durante la activación de las células T. El RPCT también se asocia a otras moléculas de superficie conocidas como complejo CD3, que también ayudan en la señalización celular.
Células T cooperadoras y citocinas en la inmunidad adaptativa
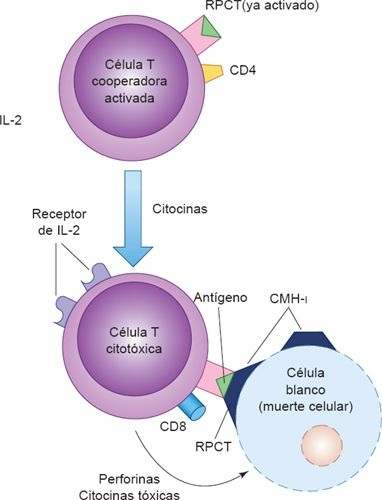
La activación de las células T cooperadoras es el suceso central para que dé inicio la respuesta inmunitaria humoral y mediada por células. Las células T cooperadoras CD4+ (TH) fungen como reguladoras maestras para el sistema inmunitario. Se activan cuando sus RPCT interactúan con antígenos que forman complejos con las moléculas CMH de clase II en la superficie de las CPA. Una vez que se activan las células CD4+ , las citocinas que secretan en respuesta influyen sobre la funciónde casi todas las demás células del sistema inmunitario. Según la citocinas específica que libera la célula T CD4+ , se activa la respuesta inmunológica subsecuente. Estas citocinas son capaces de activar y regular las células B, los linfocitos T citotóxicos, las células NK, los macrófagos y otras células inmunitarias. La primera citocina que se produce en las células T CD4+ después de su activación es la IL-2, necesaria para la proliferación y la función de las células T cooperadoras, las células T citotóxicas, las células B y las células NK. La IL-2 interactúa con los linfocitos T al unirse a receptores de membrana específicos que existen en las células T activadas pero no en las células T en reposo.
La amplificación de las células T depende de la presencia de la IL-2 y de receptores específicos para ésta.
Existen otras citocinas que no son sintetizadas por las células CD4+ , pero son esenciales para su funcionamiento. La IL-1 se sintetiza en las células inflamatorias y es responsable de incrementar la expresión de las moléculas de adhesión en las células endoteliales, lo que permite la migración de los leucocitos, y estimula la producción de anticuerpos. Otra citocina fundamental para la función de las células CD4+ es la IL-6, que influye sobre las funciones efectoras de las células T al promover la diferenciación de las células T cooperadoras (T2H) por medio de la regulación positiva de NFATc2 y c-maf.
La célula T cooperadora CD4+ activada puede diferenciarse en 2 subpoblaciones distintas de células T cooperadoras (T1H y T2H), de acuerdo con la citocinas que segregan las CPA en el sitio de la activación. Los macrófagos y las CDN sintetizan IL-12, que dirige la maduración de las células T cooperadoras CD4+ para convertirse en el subtipo T1H; en tanto, las células cebadas y las células T sintetizan IL-4, que induce su diferenciación hacia el subtipo T2H.
Las células T2H dirigen a los linfocitos B para cambiar de clase y sintetizar los anticuerpos tipo IgE, necesarios para activar una respuesta alérgica o de hipersensibilidad. El patrón distinto de secreción de citocinas que se observa en las células T1H y T2H maduras define con más detalle a estas subpoblaciones de células TH y determina si finalmente tendrá lugar una respuesta humoral o mediada por células.
Las células T1H activadas sintetizan las citocinas IL-2 e IFN-γ, mientras que las células T2H producen IL-4 e IL-5. Esta última es una activadora de los eosinófilos que, junto con la IgE, actúa en el control de las infecciones por helmintos (parásitos intestinales). Algunas de las citocinas (ej. IL-10) que sintetizan las células T2H son antiinflamatorias, inhiben la activación de los macrófagos y suprimen otras respuestas T1H.
Células T reguladoras
Las células T reguladoras (TR) son un subgrupo de linfocitos T que actúan para controlar las respuestas del sistema inmunitario. Se han identificado distintas poblaciones de células TR en el timo, lo que incluye a las que expresan CD4 y CD25 en su superficie. Estas células representan a un subgrupo de células CD4+ , que actúan como «reguladoras negativas» del proceso inmunitario.
Suprimen las respuestas inmunitarias al inhibir la proliferación de otros linfocitos autorreactivos con potencial lesivo. La producción de células T reguladoras depende en gran medida de la presencia de antígeno, la activación de un RPCT por la acción de un antígeno, y la liberación de la citocina IL-10 y el factor de crecimiento transformador β (TGF-β, por sus siglas en inglés). Estas citocinas inhiben la proliferación y la activación de los linfocitos y los macrófagos. Existe evidencia reciente de la existencia de células T CD8+ reguladoras, que pueden ejercer una regulación negativa selectiva sobre las células T activadas por antígenos propios o extraños. Estas células se diferencian en células reguladoras durante la respuesta inmunitaria primaria y actúan para suprimir la respuesta inmunitaria secundaria. Por ende, las reguladoras CD8+ se encuentran involucradas de manera primordial en la discriminación de lo propio y lo ajeno. La capacidad de las células T reguladoras para controlar muchos aspectos de la respuesta inmunitaria tiene implicaciones significativas para la práctica clínica.
Existen hallazgos promisorios en el control de la enfermedad intestinal inflamatoria, la encefalitis alérgica experimental y la diabetes de origen autoinmunitario.
Células T citotóxicas
La función principal de las células T citotóxicas (CD8+) es vigilar la actividad de todas las células del organismo y destruir a cualquiera que amenace su integridad. Las células T CD8+ reconocen antígenos que se presentan en la superficie celular por medio de las moléculas derivadas del CMH clase I , que toman muestras de péptidos producidos a partir de la degradación de proteínas que se da al interior de las células infectadas por virus o transformadas por el cáncer (figura 13-11). La capacidad de las células CD8+ de reconocer los complejos CMH de clase i-antígeno en las células blanco infectadas asegura que las células vecinas del hospedero que no presentan infección y expresan moléculas de CMH clase I solas o con péptidos propios, no se destruyan de manera indiscriminada. Los linfocitos T citotóxicos CD8+ destruyen a las células blanco mediante diversos mecanismos, entre otros, la liberación de enzimas citolíticas, citocinas tóxicas o moléculas formadoras de poros (es decir, perforinas), o al activar a moléculas de la membrana y la apoptosis intracelular. La apoptosis es un proceso biológico normal que elimina a las células que se encuentran en exceso, son peligrosas o causan daño en el organismo. Las células T CD8+ tienen un papel relevante en el control de los virus en multiplicación y las bacterias intracelulares, puesto que los anticuerpos no pueden penetrar con facilidad la membrana de las células vivas.
Inmunidad mediada por células
A fin de que la respuesta inmunitaria mediada por células realice su función, se requieren linfocitos T saludables CD4+ y CD8+ . Las células T cooperadoras CD4+ activadas liberan distintas citocinas (ej. IFN-γ), que reclutan y activan otras células T citotóxicas CD8+ , macrófagos y células inflamatorias. Las citocinas (ej. quimiocinas) estimulan la migración de distintos tipos de células inflamatorias, como macrófagos, neutrófilos y basófilos, lo que potencia aún más las funciones fagocíticas, metabólicas y enzimáticas de la respuesta inmunitaria mediada por células. Lo anterior tiene como consecuencia una destrucción más rápida y eficiente de las células infectadas. Este tipo de defensa es importante contra muchos patógenos intracelulares, como las especies de micobacterias y Listeria monocytogenes, aunque desafortunadamente participa en las reacciones de hipersensibilidad tardía.
La dermatitis alérgica por contacto (hipersensibilidad tardía tipo iv) deriva de la activación de precursoras de células T CD4+ y CD8+ en los ganglios linfáticos que drenan el sitio donde se presenta el antígeno. Estos «péptidos haptenados» estimulan el reclutamiento de células T en el sitio de la presentación de antígenos, al inducir señales inflamatorias y la apoptosis de las células epidérmicas, lo que conduce al desarrollo de inflamación, liberación de mediadores químicos y manifestación de síntomas clínicos.
En las respuestas inmunitarias mediadas por células predominan las acciones de los linfocitos T y los macrófagos efectores. El fagocito más agresivo y abundante, el macrófagos, se activa tras exponerse a las citocinas de las células T, en particular el IFN-γ. Las fases iniciales de la inmunidad mediada por células se desencadenan cuando una CPA presenta un complejo antígeno peptídico-CMH clase I o II a la célula T cooperadora CD4+ y la activa. La célula T cooperadora activada sintetiza entonces IL-2, IL-4 y otras citocinas que estimulan el aumento en la producción de células T cooperadoras CD4+ y luego amplifican la respuesta. La liberación adicional de citocinas promueve la actividad de las células T citotóxicas y los macrófagos efectores.
Órganos linfoides
Los órganos linfoides centrales y periféricos son responsables de la producción, maduración y almacenamiento de un gran número de células sistémicas inmunitarias, entre otras, linfocitos B y T.
Estos órganos y tejidos tienen distribución amplia en todo el organismo y cumplen funciones distintas, pero con frecuencia sobrepuestas (figura 13-12). Los órganos linfoides centrales son la médula ósea y el timo, responsables de la producción de células inmunitarias y su maduración. Los tejidos y las células del sistema linfoide periférico almacenan las células del sistema inmunitario, donde actúan para concentrar y procesar antígenos, y para dar soporte a los procesos celulares necesarios para el desarrollo de respuestas inmunitarias adaptativas con funcionalidad completa. Los tejidos linfoides periféricos incluyen a los ganglios linfáticos, el bazo, las amígdalas, el apéndice, las placas de Peyer en el intestino, y los tejidos linfoides relacionados con la mucosa en los sistemas respiratorio, gastrointestinal y reproductor. Redes de canales linfáticos, vasos sanguíneos y capilaresconectan a los órganos linfáticos y transportan a células inmunitarias, antígenos y detritos celulares por todo el organismo.
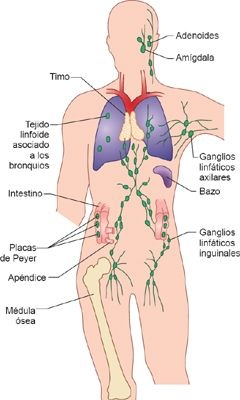
Timo
Es una estructura elongada, bilobulada, que se ubica en el mediastino, por encima del corazón, y sirve como un órgano sistémico inmunitario especializado. Cada lóbulo está circundado por una cápsula de tejido conectivo y se divide en lobulillos; éstos pueden dividirse en una corteza externa y una médula central, que desempeñan papeles distintos en el proceso de la maduración de los linfocitos T. La corteza externa contiene una población densa de linfocitos T inmaduros (timocitos).
La médula interna es un área menos densa de tejido que contiene un menor número de linfocitos, pero con una histología más madura. La médula está conformada por corpúsculos de Hassall, pero también alberga CDN y macrófagos (figura 13-13).
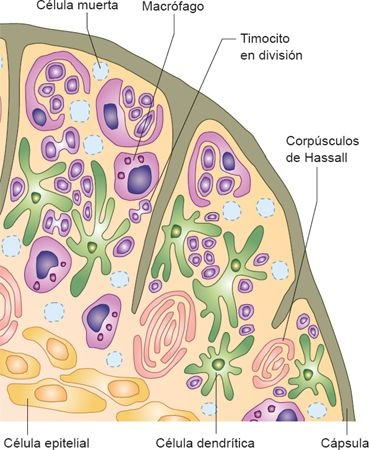
El timo es esencial para el desarrollo del sistema inmunitario, ya que es responsable de la producción de linfocitos T maduros e inmunocompetentes. Es un órgano con desarrollo completo en el momento del nacimiento, y pesa alrededor de 15 g a 20 g. Tiene mayor actividad durante los períodos neonatal y previo a la adolescencia. Durante la pubertad, cuando las células inmunitarias se encuentran establecidas en los tejidos linfoides periféricos, el timo comienza a atrofiarse y es sustituido por tejido adiposo. A pesar de esto, la producción de linfocitos T persiste en forma residual durante toda la vida adulta.
Las células T precursoras (pre-T) ingresan al timo como células T funcionales con fenotipo inmaduro. A partir de entonces, maduran durante distintos ciclos y luego se desplazan de la corteza hacia la médula, hasta que se liberan para dirigirse hacia los tejidos linfoides periféricos. En la corteza se presentan una división celular rápida, la maduración y la selección bajo la influencia de las hormonas del timo y las citocinas. Al tiempo que las células T maduran, desarrollan RPCT que las diferencian de otros tipos de células T.
La mayoría de los timocitos mueren en la corteza durante el proceso de reacomodo genético y maduración, dado que falla en ellos el desarrollo de tipos de receptores apropiados en su membrana celular. Sólo se permite la maduración de las células T capaces de reconocer antígenos extraños presentados por las CMHpropias. Este proceso se denomina selección tímica. Las células T citotóxicas y cooperadoras inmunocompetentes dejan el timo en 2 o 3 días, y viajan a los tejidos linfoides periféricos por medio de la sangre.
Ganglios linfáticos
Los ganglios linfáticos son cúmulos pequeños de tejido linfoide ubicados a lo largo de los vasos linfáticos en todo el cuerpo. Los vasos linfáticos llevan linfa, un líquido claro, en ocasiones con coloración amarillenta, que contiene distintos leucocitos (linfocitos en forma predominante) y transporta detritos celulares y organismos hacia los ganglios linfáticos, para eliminarlos del organismo. Cada ganglio linfático procesa la linfa que proviene de un sitio anatómico limitado y adyacente. Los ganglios linfáticos se congregan en las axilas y la región inguinal, y a lo largo de los grandes vasos del cuello, tórax y abdomen. Reciben la linfa de los conductos colectores, que por último drenan en el conducto torácico ubicado en el lado izquierdo del tórax a la altura de la vena subclavia. Los ganglios linfáticos tienen 2 funciones: eliminar el material extraño de la linfa antes de que ingrese al torrente sanguíneo, y fungir como centros para la proliferación y la respuesta de las células inmunitarias.
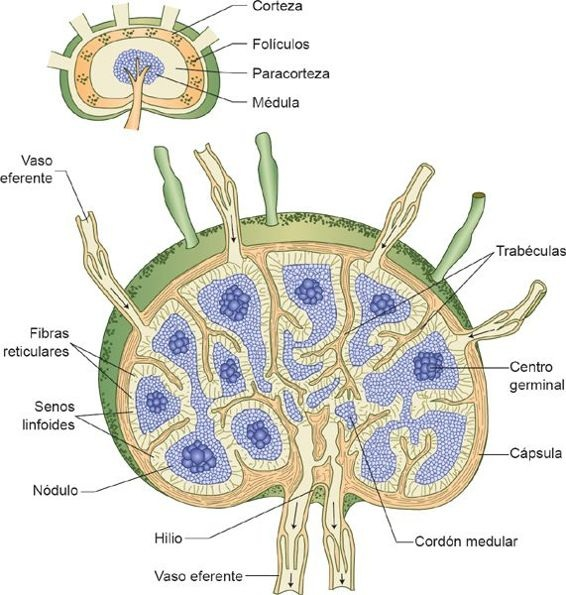
Los linfáticos son tejidos encapsulados con forma de frijol, con alrededor de 0,5 cm a 1 cm de diámetro. La linfa ingresa al ganglio a través de los canales linfáticos aferentes y sale por los vasos linfáticos eferentes que se ubican en la indentación profunda ubicada en el hilio. Los linfocitos y los macrófagos se desplazan con lentitud por los ganglios linfáticos, de tal manera que cuentan con tiempo suficiente para engullir a los microorganismos e interactuar con el antígeno circulante. El sistema linfático provee una superficie amplia sobre la cual los macrófagos y las CDN pueden presentar con más facilidad antígenos a los linfocitos T.
Los ganglios linfáticos se dividen en 3 regiones diferentes y especializadas: una corteza externa, una paracorteza y una médula interna (figura 13-14). Los linfocitos T predominan en la paracorteza, mientras que los linfocitos B son más abundantes en los folículos y los centros germinales en la corteza externa. Los linfocitos T proliferan cuando los antígenos entran a la paracorteza de un ganglio linfático. Migran entonces hacia la corteza externa; así, pueden interactuar con los linfocitos B que están almacenados ahí. Dentro de los folículos, los linfocitos siguen madurando, multiplicándose e interactuando con las CPA que existen en los ganglios (macrófagos y CDN foliculares). Las células T activadas migran en este momento hacia la médula del ganglio linfático, donde completan su maduración para convertirse en células plasmáticas. Se liberan entonces grandes cantidades de anticuerpos hacia la circulación sistémica.
Bazo
Es un órgano linfoide secundario grande y ovoide; se ubica en la parte alta del cuadrante superior izquierdo de la cavidad abdominal, entre el diafragma y el estómago. Filtra los antígenos de la sangre y juega un papel importante en la respuesta a las infecciones sistémicas. Se divide en 2 sistemas: la pulpa blanca y la pulpa roja. Esta última tiene una provisión abundante de arterias y sinusoides venosos; es el área en que se eliminan los eritrocitos senescentes y lesionados. La pulpa blanca contiene nódulos linfáticos y tejido linfoide difuso, donde existen áreas de concentración de linfocitos B y T permeadas por macrófagos y CDN. Los linfocitos (en particular, células T) que circundan las arteriolas centrales constituyen un área denominada manguito linfoide periarterial.
También existe una zona marginal difusa que contiene folículos y centros germinales, y es rica en células B. Ésta separa a la pulpa blanca de la pulpa roja, y permite a los linfocitos desplazarse con facilidad entre la sangre y el tejido linfático. Una secuencia de sucesos de activación similar a la que se observa en los ganglios linfáticos tiene lugar en el bazo.
Otros tejidos linfoides secundarios
Otros tejidos linfoides secundarios son los tejidos linfoides asociados a la mucosa, conformados por cúmulos no encapsulados de tejido linfoide que se disponen en torno a las membranas que recubren las vías respiratoria, digestiva y urogenital. De manera constante, estos sistemas orgánicos entran en contacto con patógenos y toxinas y, por ende, requieren la presencia de células inmunitarias para responder a la invasión potencial de los patógenos y las sustancias dañinas. En algunos tejidos, los linfocitos se organizan en cúmulos laxos y mal definidos, pero en otros, como en las amígdalas, las placas de Peyer en el intestino y el apéndice, su estructura muestra una mayor organización. Estos tejidos contienen todos los componentes celulares (es decir, células T, células B, macrófagos y CDN) que se requieren para montar una respuesta inmunitaria. La inmunidad en las capas mucosas ayuda a excluir a muchos patógenos del organismo y, como resultado, protege a las estructuras internas de mayor importancia vital.
Comparación entre inmunidad activa y pasiva
El objetivo del sistema inmunitario consiste en proteger al hospedero contra la invasión de patógenos con potencial peligroso, sustancias extrañas y otras fuentes de antígenos lesivos. Las respuestas inmunitarias adaptativas logran esta meta mediante la activación de respuestas mediadas por células y tumorales. Este tipo de protección puede inducirse por 1 de 2 mecanismos:
- Tras la exposición a la sustancia agresora y la activación de los linfocitos B y T (inmunidad activa).
- Mediante la transferencia directa al hospedero de anticuerpos contra un antígeno (inmunidad pasiva).
La inmunidad activa se adquiere cuando el hospedero monta una respuesta inmunitaria contra un antígeno, ya sea mediante el proceso de vacunación o por una exposición ambiental. Se denomina inmunidad activa debido a que requiere que el propio sistema inmunitario del hospedero desarrolle una respuesta inmunológica que incluya el desarrollo de memoria. La inmunidad activa suele ser duradera, pero se necesitan algunos días o semanas después de la primera exposición para desarrollar en grado suficiente una respuesta inmunológica apropiada que culmine en la destrucción del antígeno que se presenta. Sin embargo, ante la exposición subsecuente, el sistema inmunitario se activa por completo con rapidez ante la presencia de linfocitos B y T de memoria y anticuerpos circulantes.
El proceso por el que se desarrolla inmunidad activa a partir de la administración de una vacuna se denomina inmunización. Una respuesta inmunitaria adquirida puede mejorar tras la exposición repetida a un antígeno inyectado (vacunas de refuerzo) o a una infección natural.
La inmunidad pasiva es aquélla que se transfiere a partir de otra fuente. La variante más frecuente de inmunidad pasiva es la que confiere la madre al feto. Durante el desarrollo fetal se transfieren anticuerpos tipo IgG de la madre al feto a través de la placenta. Después del nacimiento, el neonato también recibe anticuerpos IgG de la madre en la leche materna o el calostro con lo que consiguen cierto grado de protección contra la infección durante un período que va de 3 a 6 meses, lo que da a su sistema inmunitario tiempo para madurar. La administración de mezclas de Ig obtenidas a partir de fuentes humanas o animales puede asimismo proveer cierto grado de protección contra las enfermedades infecciosas. La inmunidad pasiva permite una protección a corto plazo, que dura de semanas a meses.
Regulación de la respuesta inmunitaria adaptativa
Para que un organismo hospedero permanezca saludable, el sistema inmunitario debe tener una función apropiada. Una respuesta inmunitaria debilitada puede conducir al desarrollo de inmunodeficiencia, pero una respuesta inadecuada o excesiva puede inducir reacciones alérgicas y enfermedades autoinmunitarias. De esta manera, el sistema inmunitario debe ser capaz de regularse.
El proceso por el que el organismo se regula no está lo suficientemente claro, pero debe implicar todos los aspectos de las respuestas inmunitarias innatas y adaptativas.
Cada exposición a un antígeno induce una respuesta predecible a partir del sistema inmunitario. Una vez que éste se activa, la respuesta se amplifica hasta que alcanza un máximo y cede en forma eventual. Esto es así porque las respuestas inmunitarias normales del cuerpo son autolimitadas. Una vez que el antígeno se destruye y la acción de los mediadores químicos termina, la respuesta inmunitaria cesa. Se piensa que las citocinas anti-inflamatorias y los linfocitos T reguladores desempeñan algún papel en este proceso.
La tolerancia también desempeña un papel en la autorregulación de la respuesta inmunitaria. Es la capacidad del sistema inmunitario para reaccionar contra antígenos extraños y para permanecer sin reacción ante los antígenos propios. La tolerancia a los antígenos propios protege al cuerpo de respuestas autoinmunitarias lesivas. Esto es en extremo importante en los órganos vitales, como cerebro, testículos, ovarios y ojos, donde un daño inmunitario pudiera ser mortal para el organismo.
Muchas enfermedades autoinmunitarias, como la tiroiditis de Hashimoto y la diabetes mellitus dependiente de insulina, se producen por una disfunción de los linfocitos B y T (en forma específica, los linfocitos citotóxicos) que genera daño celular directo porque el sistema inmunitario ya no es capaz de distinguir lo «propio» de lo «ajeno».