02. Inmunidad innata
El sistema inmunitario innato está compuesto por 2 líneas de defensa independientes, pero interrelacionadas: la capa epitelial, que actúa como la barrera física contra las sustancias y los organismos invasores, y la respuesta inflamatoria. La respuesta de inmunidad innata recurre a las barreras epiteliales naturales del cuerpo y, de manera simultánea, a las células fagocíticas (en particular, neutrófilos y macrófagos), las células NK y distintas proteínas plasmáticas, entre otras cininas, factores de la coagulación y las que constituyen el sistema del complemento, para mantener la homeostasis interna. La respuesta inmunitaria innata depende de la capacidad del organismo para identificar las estructuras que se conservaron por vía evolutiva en los patógenos y que se conocen como PMAP, a fin de distinguirlas de las estructuras de las células humanas.
La respuesta del sistema inmunitario innato es rápida, verificándose por lo general en el transcurso de minutos u horas, e impide el establecimiento de la infección y la penetración de los microorganismos hasta tejidos más profundos; suele ser muy eficaz contra la mayoría de los patógenos. Sin embargo, cuando la respuesta innata es rebasada, las respuestas inmunitarias adaptativas se activan como línea final de defensa contra los organismos invasores. Los mecanismos inmunitarios innatos siempre se encuentran presentes en el organismo, antes de algún encuentro con un agente infeccioso, y se activan con rapidez ante el contacto con microorganismos y sustancias extrañas. Por ende, las defensas del cuerpo se encuentran en pleno despliegue antes del desarrollo de una respuesta inmunitaria adaptativa. El sistema inmunitario innato también interactúa con las respuestas inmunitarias adaptativas, y las dirige.
En condiciones normales, la respuesta inmunitaria innata es esencial para la conservación de la salud y el bienestar del organismo. Sin embargo, en períodos de respuesta excesiva o insuficiente, el sistema inmunitario innato participa en la patogénesis de la enfermedad. Una de las funciones fundamentales del sistema inmunitario innato es dar inicio a la respuesta inflamatoria, que incluye la activación de una cascada compleja de acontecimientos y mediadores químicos. Como parte de la respuesta inmunitaria innata, la inflamación juega un papel clave en la patogénesis de muchas condiciones fisiopatológicas comunes, entre otras, la ateroesclerosis y la arteriopatía coronaria, el asma bronquial, la diabetes mellitus no dependiente de insulina, la artritis reumatoide, la esclerosis múltiple y el lupus eritematoso sistémico.
Barreras epiteliales
En todos los portales comunes de entrada al organismo se encuentran barreras físicas, mecánicas y bioquímicas contra la invasión microbiana, lo que incluye a la piel y a las vías respiratorias, gastrointestinales y urogenitales. Debido a su diseño, la piel íntegra es por mucho la barrera física más formidable de que se dispone contra la infección. Está compuesta por células con disposición estrecha, que se organizan en capas múltiples y se desprenden de manera continua. Además, la piel está cubierta por una capa protectora de proteína, conocida como queratina, y cuenta con químicos simples que generan un ambiente inespecífico, salado y ácido, así como proteínas antibacterianas, como la enzima lisozima, que impiden la colonización por microorganismos y facilitan su destrucción. La complejidad de la piel se hace evidente en los casos de dermatitis por contacto en que aumenta la susceptibilidad a la infección cutánea como consecuencia de las anomalías de la respuesta inmunitaria innata, que incluyen defectos, tanto de la capa epitelial misma como de la señalización, la expresión, o ambas, de las respuestas innatas.
Capas de células epiteliales dispuestas en unión estrecha cubren y protegen las vías gastrointestinales, respiratorias y urogenitales, e impiden por medios físicos el ingreso de los microorganismos al cuerpo. Estas células destruyen a los organismos invasores al secretar enzimas, proteínas y péptidos con actividad antimicrobiana. Células especializadas en estas cubiertas, como las células caliceales en el tubo digestivo, secretan material viscoso constituido por glucoproteínas de peso molecular alto, conocidas como mucinas, que al hidratarse dan origen al moco. Las mucinas se unen a los patógenos, con lo que atrapan y arrastran a los invasores potenciales. En las vías respiratorias inferiores protruyen estructuras móviles similares al pelo, denominadas cilios, a partir de las células epiteliales, y que desplazan a los microbios atrapados en el moco en dirección proximal por el árbol traqueobronquial y hacia la faringe. Las respuestas fisiológicas de tos y estornudo facilitan en gran medida su eliminación del cuerpo.
Los microorganismos que quedan atrapados en el moco se sujetan entonces a la acción de distintas defensas químicas que existen en todo el organismo. La lisozima es una enzima hidrolítica que se encuentra en las lágrimas, la saliva y la leche humana, capaz de escindir las paredes de las células bacteriales mediante la hidrólisis de los enlaces 1,4-β entre los residuos de peptidoglucano. El complemento se encuentra en la sangre y resulta esencial para la actividad de los anticuerpos. Está compuesto por 20 proteínas distintas, muchas de las cuales actúan como precursoras de enzimas. Este sistema se activa por medio de un complejo antígeno-anticuerpo. La activación del sistema del complemento fomenta la agregación bacteriana, que hace a los microorganismos más susceptibles a la fagocitosis por efecto de la activación de las células cebadas y los basófilos, y por la liberación directa de complejos líticos que rompen las membranas celulares de los microorganismos invasores (figura 13-1). Además, una investigación reciente demostró que el complemento desempeña un papel clave en la comunicación entre las respuestas inmunitarias innatas y las adaptativas, por efecto de la liberación de los componentes C3 y C5 a partir de las CDN. En el estómago y el intestino, los microbios mueren a consecuencia de la acción de enzimas digestivas, las condiciones ácidas y la secreción de defensinas, péptidos catiónicos pequeños, que en pocos minutos eliminan tanto a microorganismos grampositivos como gramnegativos mediante la disrupción de su membrana celular.
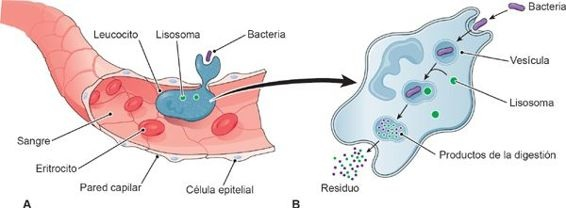
Cuando los patógenos rebasan las defensas epiteliales, los leucocitos del organismo activan la respuesta inmunitaria innata mediante el reconocimiento de los receptores de superficie comunes que existen en los microorganismos invasores.
Células de la inmunidad innata
Las células de la respuesta inmunitaria innata son capaces de reconocer microbios que comparten características comunes en sus receptores de superficie, y en respuesta dan inicio a una gran diversidad de acciones que tienen como blanco a los microorganismos invasores. Las células clave de la inmunidad innata incluyen a neutrófilos, macrófagos, CDN, células NK y linfocitos intraepiteliales.
Neutrófilos y macrófagos
Los leucocitos implicados en la respuesta inmunitaria innata derivan de células progenitoras mieloides y se subdividen en 2 grupos distintos, con base en la presencia o la ausencia de gránulos con tinción específica en su citoplasma. Los leucocitos que contienen gránulos se clasifican como granulocitos, e incluyen a neutrófilos, eosinófilos y basófilos. Las células que carecen de gránulos se definen como agranulocitos, e incluyen a linfocitos, monocitos y macrófagos.
Los neutrófilos, denominados de esa manera por sus gránulos con tinción neutral, son los granulocitos más abundantes en el organismo y constituyen alrededor del 55% de todas las células blancas de la sangre. También se conocen como neutrófilos polimorfonucleares (NPM). Son células fagocíticas capaces de tener movimiento ameboide. Actúan como células de respuesta temprana en la inmunidad innata. Son raras en los tejidos y en las cavidades corporales, y permanecen de manera predominante en estado de latencia en la sangre y la médula ósea hasta que se les requiere en la respuesta inmunitaria. Los eosinófilos cuentan con grandes gránulos gruesos, y en general comprenden sólo entre el 1% y el 4% del conteo leucocitario total. En contraste con los neutrófilos, estas células no ingieren detritos celulares, sino más bien complejos antígeno-anticuerpo y virus. Con frecuencia se activan en las infecciones parasitarias y en las respuestas alérgicas. Los basófilos constituyen menos del 1% del conteo leucocitario total, y contienen gránulos que liberan un gran número de sustancias, entre otras, histamina y enzimas proteolíticas. Su función no se conoce del todo, pero se piensa que desempeñan algún papel en la alergia y en la infección parasitaria.
Los agranulocitos vinculados con la inmunidad innata forman parte del sistema fagocítico mononuclear, e incluyen a monocitos y macrófagos. Los monocitos son las células blancas de la sangre de mayor dimensión, pero sólo constituyen entre el 3% y el 7% del conteo leucocitario total. Se liberan a partir de la médula ósea hacia el torrente sanguíneo, a partir del cual emigran hacia los tejidos, y maduran para convertirse en macrófagos y CDN, para participar en la respuesta inflamatoria y fagocitar las sustancias extrañas y los detritos celulares. Los macrófagos tienen un período de vida prolongado, residen en los tejidos y actúan como el primer fagocito que encuentran los organismos invasores al ingresar al hospedero. Los neutrófilos y los macrófagos trabajan de manera concertada, y son vitales para la defensa del hospedero contra todos los patógenos intracelulares y extracelulares.
Los macrófagos son esenciales para la eliminación de las bacterias que atraviesan la barrera epitelial en el intestino y otros sistemas orgánicos. También tienen una plasticidad notable, que les permite responder en forma eficiente a las señales ambientales y modificar sus características funcionales. Esto los convierte en células fagocíticas más eficientes que los neutrófilos más abundantes. Una vez que se activan, estas células endocitan y digieren a los microbios que se unen a su membrana celular. La capacidad de estas células fagocíticas para dar inicio a esta respuesta depende del reconocimiento de estructuras de superficie patogénica que se conocen como PMAP o RRP, entre las que los RTT se han estudiado con mayor detalle. La fagocitosis de los microorganismos invasores ayuda a limitar la diseminación de la infección hasta que las respuestas inmunitarias adaptativas logran activarse del todo.
Además de la fagocitosis, los macrófagos y las CDN procesan y presentan los antígenos al inicio de la respuesta inmunitaria, para actuar como un desencadenante central de la respuesta inmunitaria adaptativa. Estas células secretan sustancias que inician y coordinan la respuesta inflamatoria o activan a los linfocitos. Los macrófagos también pueden eliminar los complejos antígeno-anticuerpo o, bajo la influencia de las células T, destruir células malignas del hospedero o las células infectadas por virus.
Células dendríticas
Las CDN son leucocitos especializados derivados de la médula ósea que se encuentran en el tejido linfoide y constituyen el puente entre los sistemas de inmunidad innata y adaptativa. Las CDN derivan su nombre de las dendritas que se ubican en el sistema nervioso central, puesto que cuentan con proyecciones de superficie que les determinan un aspecto similar. Las CDN son células más bien raras que se localizan sobre todo en los tejidos expuestos a ambientes externos, como los sistemas respiratorio y gastrointestinal. Sobre todo, se encuentran presentes en una forma inmadura que está disponible para detectar de manera directa a los patógenos, capturar agentes extraños y transportarlos hacia tejidos linfoides secundarios. Una vez activadas, las CDN sufren un proceso de maduración complejo para desempeñarse como células presentadoras de antígeno (CPA) capaces de desencadenar la inmunidad adaptativa. Son responsables del procesamiento y la presentación de antígenos extraños a los linfocitos. Al igual que los macrófagos, las CDN liberan varias moléculas para comunicación, que determinan la naturaleza de las respuestas inmunitarias adaptativas.
Células asesinas naturales y linfocitos intraepiteliales
Las células NK y las células intraepiteliales son otras variedades celulares involucradas en larespuesta inmunitaria innata. Las células asesinas naturales se denominan así debido a su capacidad para eliminar de modo espontáneo a microorganismos blanco. Los 2 tipos de células dependen del reconocimiento de PMAP específicos relacionados con el tipo celular del microorganismo.
Las células NK son una población heterogénea de linfocitos de la inmunidad innata que median la toxicidad espontánea contra las células infectadas. Se asemejan a linfocitos granulosos grandes y son capaces de eliminar a ciertos tipos de células tumorales o infectadas sin exposición previa a antígenos de superficie. Las células NK recibieron su nombre tomando en cuenta su capacidad para mediar la citotoxicidad espontánea durante las 2 respuestas inmunitarias innatas. Sin embargo, se ha demostrado que desempeñan un papel de la misma importancia al limitar la diseminación de la infección y facilitar el desarrollo de las respuestas inmunitarias adaptativas por medio de la síntesis de citocinas. Las células NK dan asistencia para la maduración de las CDN y el control mediante inmunidad innata de las infecciones virales; son capaces de eliminar en forma directa a la célula del hospedero infectada por microorganismos intracelulares (virales) o bacterianos patógenos. Comprenden entre el 10% y el 15% de los linfocitos en la sangre periférica, pero no muestran receptores propios de células T (RPCT) o inmunoglobulinas (Ig) de superficie celular. Se identificaron 2 moléculas de superficie celular, CD16 y CD56, que se utilizan en forma amplia para reconocer la actividad de las células NK. El CD16 funge como un receptor para la molécula de IgG, que confiere a las células NK la capacidad para lisar a células blanco recubiertas con IgG.
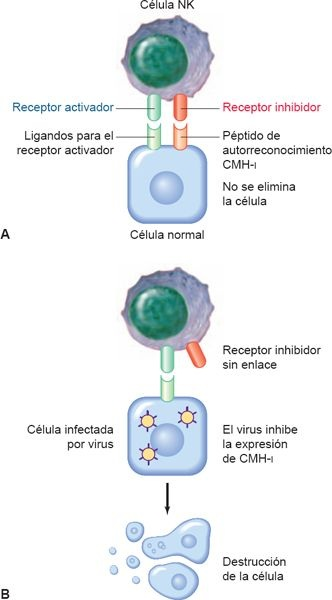
Las células NK pueden dividirse en 2 subgrupos principales, de acuerdo con su capacidad para excretar citocinas proinflamatorias. Además, difieren en cuanto a su expresión de receptores inhibidores y activadores. Las células que expresan receptores activadores (ej. NKG2D) se inducen en respuesta a la presencia de células infectadas por patógenos o que muestran estrés; en tanto, los receptores inhibidores de las células NK reconocen patrones (complejo mayor de histocompatibilidad (CMHi, lectinas) en células normales del hospedero y su función es inhibir la acción de las células NK . Esto asegura que sólo se destruyan células «extrañas» (figura 13-2). Además de su papel como fagocitos, las células NK ayudan durante la polarización de las células T, la maduración de las CDN y el control inmunitario innato de la infección viral, por medio de la secreción de moduladores inmunitarios y citocinas antivirales. La investigación actual analiza el empleo de estas propiedades de las células NK para el desarrollo de vacunas capaces de modular y dirigir la respuesta inmunitaria por medio de un incremento de la actividad de la citocinas.
Reconocimiento de patógenos
La respuesta inmunitaria innata desempeña un papel vital en la respuesta proinflamatoria ante la infección, y depende de la capacidad de las defensas del hospedero para diferenciar lo propio de lo ajeno, de tal forma que sólo se enfrenta a los organismos invasores. Los leucocitos involucrados en esta respuesta reconocen ciertos patrones que se conservaron a lo largo de la evolución y se ubican en la superficie de los patógenos, y en respuesta a ello se unen a la membrana y destruyen al organismo invasor mediante un proceso de fagocitosis (figura 13-3).
Patrón de reconocimiento
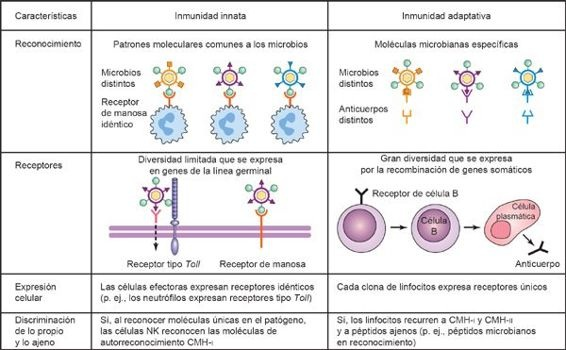
Los patógenos invasores contienen estructuras conservadas en sus membranas celulares denominadas patrones moleculares asociados a patógenos (PMAP), que son reconocidos por las células del sistema inmunitario innato, puesto que poseen un número limitado de receptores de reconocimiento de patrones (RRP) codificados en su línea germinal. Una vez que se reconoce un PMAP, los RRP entran en contacto con la superficie celular, y envían señales intracelulares al hospedero, lo que desencadenarespuestas proinflamatorias y antimicrobianas que incluyen la síntesis y la liberación de citocinas, quimiocinas y moléculas de adhesión celular. Los PMAP que reconocen los RRP del hospedero están constituidos por una combinación de azúcares, moléculas lipídicas, proteínas o patrones de ácidos nucleicos modificados, y resultan esenciales para el funcionamiento y la infectividad del patógeno. Puesto que los PMAP son fundamentales para el funcionamiento del microorganismo, su mutación no puede ayudarle a evitar el reconocimiento inmunitario. El complemento humano para los RRP es muy extenso (alrededor de 1.000 componentes), de tal modo que las clases de patógenos a los que reconocen son muy diversas. Por ende, se reconocen patógenos de composición bioquímica muy diversa por medio de mecanismos más bien similares que dependen de los RRP del hospedero, y no existe una sola clase de patógenos que se identifique a partir de un solo tipo de RRP. En consecuencia, el código genético del hospedero permite que los receptores únicos implicados tanto en la inmunidad innata como en la adaptativa reconozcan detalles finos de la estructura molecular.
La capacidad de la respuesta inmunitaria innata para limitar a los microbios en una fasetemprana del proceso infeccioso deriva de la unión de los patógenos a los RRP ubicados en los leucocitos, que a su vez da inicio a los sucesos de señalización que conducen a la activación del complemento, la fagocitosis y la autofagia. Una vez que inician, las células blancas de la sangre, los neutrófilos y los monocitos migran de la sangre a los tejidos, junto con otros fluidos corporales, para inducir edema periférico. Los monocitos de la sangre maduran para convertirse en macrófagos, al tiempo que atraviesan los tejidos y se unen a los macrófagos y a las CDN que ya se encuentran en los tejidos. Los RRP que existen en estas células se activan, lo que amplifica la respuesta inflamatoria por medio del incremento de la secreción de todos los mediadores químicos, lo que incluye a las citocinas y al complemento.
Receptores tipo Toll
Los RRP más estudiados vinculados con la respuesta inmunitaria innata son los receptores tipo Toll (RTT), cuyo nombre deriva del estudio de la proteína Toll de la Drosophila melanogaster, responsable de la resistencia de esa mosca a las infecciones bacterianas y micóticas. Desde la perspectiva estructural, los RTT son glucoproteínas integrales que poseen un sitio de unión al ligando extracelular o luminal que contiene repeticiones ricas en leucina y un dominio citoplásmico de señalización Toll/interleucina 1 (IL-1). La unión de un PMAP a un RTT induce un cambio de conformación en el receptor, que de manera subsecuente desencadena la transducción de señales intracelulares y la activación de procesos celulares, como la inducción de factores de transcripción como el factor nuclear κβ (FN-κβ). El FN-κβ regula la síntesis de distintas proteínas que son componentes importantes de la inmunidad innata. Los RTT pueden encontrarse en casi todas las células de la médula ósea, lo que incluye a macrófagos, CDN, neutrófilos, células T y células B, y células que no pertenecen a la médula ósea, entre otras, las epiteliales y los fibrocitos. En el humano se han identificado 11 RTT distintos; cada uno reconoce diferentes PMAP derivados de varios microorganismos, como bacterias, virus, hongos y protozoarios.
Los RTT del humano pueden dividirse en subfamilias que reconocen de manera primordial a PMAP relacionados. RTT1, RTT2, RTT4 y RTT6 reconocen a lípidos y lipopolisacáridos (LPS); en tanto, RTT3, RTT7, RTT8 y RTT9 reconocen a ácidos nucleicos. Los RTT también pueden clasificarse con base en su distribución celular, de tal manera que RTT1, RTT2, RTT4, RTT5, RTT6, RTT10 y RTT11 tienen expresión extracelular, mientras que la expresión primordial de RTT3, RTT7, RTT8 y RTT9 corresponde a compartimientos intracelulares. Estos receptores están implicados en las respuestas a tipos muy divergentes de moléculas que con frecuencia se expresan en los tipos celulares microbianos, pero no en los mamíferos. Por ejemplo, RTT4 es esencial para el reconocimiento fagocítico y la respuesta contra el LPS que existe en las bacterias gramnegativas. El RTT2 se une al peptidoglucano, un componente esencial de la pared celular de las bacterias grampositivas. Por último, el RTT5 puede reconocer a la proteína flagelina presente en las bacterias flageladas. Además de su papel en la respuesta inmunitaria, se ha demostrado que los RTT juegan un papel patológico en afecciones como la ateroesclerosis, las alergias y ciertos trastornos autoinmunitarios.
Mediadores solubles de la inmunidad innata
Si bien las células blancas del sistema inmunitario innato comunican información vital sobre los microorganismos invasores y el reconocimiento de estructuras ajenas por medio de contacto directo entre células, los mediadores solubles también son esenciales para muchos otros aspectos de la respuesta inmunitaria innata. El desarrollo de esta respuesta depende en gran medida de la secreción de moléculas solubles, como opsoninas, citocinas y proteínas de la fase aguda.
Opsoninas
Son moléculas que recubren a las partículas con carga negativa ubicadas en las membranas celulares y que, en consecuencia, facilitan el reconocimiento y la unión de las células fagocíticas a los microorganismos. El proceso por el cual se recubren las partículas celulares de los microbios se denomina opsonización. Una vez que la opsonina se une al microbio es capaz de activar al fagocito tras su unión a un RRP en la célula fagocítica. Existen varias opsoninas relevantes para la inmunidad innata y el proceso inflamatorio agudo, entre otras, proteínas de la fase aguda, lectinas y complemento. Los componentes de la respuesta inmunitaria adaptativa también pueden actuar como opsoninas. Por ejemplo, cuando la respuesta humoral se activa, los anticuerpos IgG e IgM pueden recubrir a partículas celulares ubicadas sobre los patógenos y unirse a los receptores Fc en los neutrófilos y los macrófagos, lo que potencia la función fagocítica de las células de la inmunidad innata.
Citocinas inflamatorias
Las citocinas son proteínas con peso molecular bajo que fungen como mensajeros químicos solubles y median la interacción entre las células inmunitarias y tisulares. Forman parte de una red de señales integrada con funciones amplias, tanto en las defensas inmunitarias innatas (inespecíficas) como en las adaptativas. Las citocinas involucradas en la inmunidad innata incluyen al FNT-α y a la linfotoxina, a interferones (IFN-γ, IFN-α, IFN-β), interleucinas (IL-1, IL-6 e IL-12) y quimiocinas (tabla 13-2). Estas sustancias modulan la inmunidad innata al estimular el desarrollo de células que participan tanto en este tipo de inmunidad como en la adaptativa, al inducir la quimiotaxis de los leucocitos, estimular la síntesis de proteínas de la fase aguda e inhibir la multiplicación viral. Una vez que un fagocito de la inmunidad innata se activa por la vía RRPPMAP ante un patógeno, las citocinas se liberan en los tejidos circundantes, donde ejercen su efecto. Si se activa un número mayor de células, las citocinas pueden ser capaces de estimular procesos inflamatorios en los tejidos alejados del sitio de infección inicial. En circunstancias normales, la actividad de las citosinas tiene una duración relativamente corta, lo que impide una respuesta inmunitaria prolongada.
El FNT-α y las linfotoxinas son citocinas cuya estructura está relacionada, y muestran actividades citotóxicas similares. Las dos citocinas difieren en el sentido de que el FNT-α puede ser secretado por distintas células inmunitarias, en tanto que las linfotoxinas son secretadas de manera predominante por linfocitos activados y células NK. Estas citocinas regulan el desarrollo de los tejidos linfoides y el proceso inflamatorio mediante la inducción de moléculas de adhesión y otras citocinas y quimiocinas. Los IFN son otra familia de citocinas con implicación fundamental en la iniciación y la potenciación de la respuesta inmunitaria celular ante la infección viral de las células del hospedero. Además, desempeñan un papel clave en la amplificación de la presentación de los antígenos a células T específicas. Los interferones tipo I (IFN-α e IFN-β) son secretados por células infectadas por virus, mientras que el tipo II , el interferón inmunitario o gamma (IFN-γ) es secretado más sobre todo por las células T, la células NK y los macrófagos. Cuando los IFN activados interactúan con receptores celulares específicos generan la expresión de genes antivirales y para modulación inmunitaria. Los IFN activan a macrófagos, inducen a las células B para modificar su tipo de Ig, alteran la respuesta de las células T cooperadoras, inhiben el crecimiento celular, promueven la apoptosis e inducen un estado antiviral en las células sin infección. Por último, las IL ayudan a regular la respuesta inmunitaria al incrementar la expresión de moléculas de adhesión en las células endoteliales, estimular la migración de los leucocitos hacia los tejidos infectados y promover la síntesis de anticuerpos en las células de la respuesta inmunitaria adaptativa.
Proteínas de la fase aguda
Dos proteínas de la fase aguda que tienen que ver con la defensa contra las infecciones son el ligando de unión a la manosa (mannose-binding ligand, MBL por sus siglas en inglés) y la proteína C reactiva (PCR). El MBL y la PCR se sintetizan en el hígado en respuesta a la activación de citocinas proinflamatorias. El MBL se une de manera específica a los residuos de manosa, en tanto que la PCR liga tanto a fosfolípidos como a azúcares que se encuentran en la superficie de los microbios. Estas sustancias actúan como opsoninas «coestimuladoras» y favorecen la unión de las células fagocíticas a los microorganismos invasores que muestran opsonización por debajo de lo óptimo. También actúan como activadores de la vía alterna del complemento.
Sistema del complemento
Es un poderoso mecanismo efector, tanto de la inmunidad innata como de la adaptativa, que permite al organismo localizar la infección y destruir a los microorganismos invasores. Está compuesto por un grupo de proteínas que se encuentran en la circulación y en distintos fluidos extracelulares. De manera habitual, las proteínas del sistema del complemento circulan como precursores inactivos. Al activarse dan inicio a una serie de interacciones proteolíticas y entre proteínas, que al final culmina en la opsonización de los patógenos invasores, la migración de los leucocitos hasta el sitio de la invasión, el inicio de una reacción inflamatoria localizada y la lisis definitiva del patógeno. Las proteínas del sistema del complemento son sobre todo enzimas proteolíticas y constituyen entre el 10% y el 15% de las proteínas plasmáticas. Para que se presente una reacción mediada por el complemento, sus componentes deben activarse en secuencia apropiada. Proteínas inhibidoras y la inestabilidad de las proteínas del complemento activadas en cada paso del proceso impiden la activación descontrolada del sistema del complemento.
Existen 3 vías paralelas pero independientes que originan la activación del sistema del complemento en la respuesta inmunitaria innata: la clásica, la de la lectina y vía alterna. Las reacciones del sistema del complemento pueden dividirse en 3 fases:
- Inicio o activación.
- Amplificación o inflamación.
- Respuesta de ataque a la membrana.
Las vías difieren por las proteínas que se utilizan en la fase temprana de la activación, pero al final todas convergen en la proteína clave del complemento C3, que es esencial para la fase de la amplificación. Activada la C3 activa entonces todas las moléculas del complemento subsecuentes (C5 a C9), lo que permite la lisis final de las células.
La vía clásica se activa por un complejo antígeno-anticuerpo (ya sea de tipo IgG o IgM), lo que propicia que un sitio reactivo específico en el anticuerpo se «destape» para que sea capaz de unirse de manera directa a la molécula C1 del sistema del complemento. Una vez que se activa la C1, se pone en movimiento una «cascada» de reacciones secuenciales. Al inicio se sintetiza una escasa cantidad de enzima, pero con la sucesiva activación de proteínas del complemento, dada en forma progresiva y creciente, se generan concentraciones cada vez mayores de enzimas proteolíticas. Este proceso se conoce como amplificación. En la vía de la lectina o la vía alterna se activan proteínas del complemento circulantes inactivas cuando se exponen a polisacáridos de la superficie del microbio, MBL, PCR y otros mediadores solubles, que son parte integral de la inmunidad innata. Al igual que la vía clásica, las vías de la lectina y la alterna generan una serie de reacciones enzimáticas que rompen proteínas sucesivas del complemento.
Durante la fase de activación de la cascada del complemento, la ruptura de C3 da origen a los productos C3a y C3b. C3b es una opsonina clave que recubre a las bacterias y permite que sean fagocitadas tras su unión al receptor del complemento tipo I en los leucocitos. La presencia de C3 desencadena la migración de los neutrófilos hacia los tejidos, para fomentar la respuesta inflamatoria. La producción de C3a, C4a y C5a también conduce a la activación de las células cebadas y los basófilos, lo que les induce a liberar histamina, heparina y otras sustancias. Estos mediadores de la respuesta inflamatoria aumentan el flujo sanguíneo tisular e incrementan la permeabilidad capilar de manera localizada; lo anterior permite un incremento de la fuga de líquidos y proteínas hacia el área. Además, estimulan cambios en las células endoteliales para favorecer la quimiotaxis de los neutrófilos y los macrófagos hacia el sitio de la inflamación. Durante la fase tardía de la cascada del complemento, la ruptura de C5 propicia el ensamblaje del complejo de ataque a la membrana a partir de las proteínas C5 a C9. El complejo que resulta genera una estructura similar a un tubo, que penetra la membrana de la célula microbiana y permite el paso de iones, moléculas pequeñas y agua hacia el interior de la célula, lo que provoca que ésta estalle. Las funciones múltiples y complementarias del sistema del complemento lo constituyen en un componente integral de la inmunidad innata y la inflamación. También actúa como puente esencial entre las respuestas innata y humoral. Las manifestaciones fisiopatológicas relacionadas con las insuficiencias del complemento van del aumento de la susceptibilidad a las infecciones, a los trastornos tisulares inflamatorios y autoinmunitarios, que derivan de una eliminación anómala de factores de complemento del complemento activados.