01. Insuficiencia Cardíaca
La insuficiencia cardíaca se ha definido como un síndrome complejo resultado de cualquier alteración funcional o estructural del corazón que provoca o incrementa el riesgo de desarrollar manifestaciones de bajo gasto cardíaco o congestión pulmonar o sistémica. En Estados Unidos, la insuficiencia cardíaca afectó alrededor de cinco millones de personas en 2007. La insuficiencia cardíaca puede ocurrir a cualquier edad, pero afecta principalmente a adultos de edad avanzada. A pesar de que las tasas de morbilidad y mortalidad debidas a otras enfermedades cardiovasculares han disminuido durante las últimas décadas, la incidencia de insuficiencia cardíaca ha aumentado a una tasa alarmante. Cerca de 400.000 a 700.000 personas se diagnostican con insuficiencia cardíaco cada año.
El síndrome de insuficiencia cardíaca puede producirse por cualquier afección cardíaca que reduce la capacidad de bombeo del corazón. Entre las causas más frecuentes de insuficiencia cardíaca se encuentran la cardiopatía coronaria, la hipertensión, la cardiomiopatía dilatada y la cardiopatía valvular. Debido a que varios de estos procesos que provocan insuficiencia cardíaca son de larga evolución y progresan de manera gradual, con frecuencia puede prevenirse la insuficiencia cardíaca o hacerse más lenta su progresión con la detección e intervención tempranas. La importancia de estas estrategias se enfatiza por las directrices del American College of Cardiology (ACC)/American Heart Association (AHA), las cuales han incorporado un sistema de clasificación de insuficiencia cardíaca que incluye 4 etapas:
- Etapa A: alto riesgo para desarrollar insuficiencia cardíaca, pero ninguna anomalía estructural identificada y ningún signo de insuficiencia cardíaca.
- Etapa B: presencia de cardiopatía estructural, pero sin antecedentes de signos o síntomas de insuficiencia cardíaca.
- Etapa C: síntomas actuales o previos de insuficiencia cardíaca con cardiopatía estructural.
- Etapa D: cardiopatía estructural avanzada y síntomas de insuficiencia cardíaca al reposo con tratamiento médico al máximo.
Esta clasificación por etapas reconoce que hay factores de riesgo y anomalías estructurales establecidos que son característicos de las 4 etapas de la insuficiencia cardíaca. En circunstancias comunes, la enfermedad progresa de una etapa a otra a menos que se haga más lenta la progresión o se detenga mediante tratamiento.
Fisiopatología de la insuficiencia cardíaca
El gasto cardíaco es la cantidad de sangre que los ventrículos eyectan cada minuto. El corazón tiene una capacidad asombrosa para ajustar el gasto cardíaco para satisfacer las necesidades variables del organismo. Durante el sueño, el gasto cardíaco disminuye, y durante el ejercicio, se incrementa de manera marcada. La capacidad para aumentar el gasto cardíaco durante un mayor grado de actividad se denomina reserva cardíaca. Por ejemplo, los nadadores de competencia y los corredores de largas distancias tienen reservas cardíacas grandes. Durante el ejercicio, el gasto cardíaco de estos atletas se incrementa con rapidez hasta 5 o 6 veces su nivel en reposo. En un marcado contraste con estos atletas saludables, con frecuencia las personas con insuficiencia cardíaca utilizan su reserva cardíaca en reposo. Para ellos, sólo subir un tramo de escaleras puede provocar dificultad para respirar debido a que han excedido su reserva cardíaca.
Control del desempeño y gasto cardíacos
El gasto cardíaco, que se considera el factor determinante principal del desempeño cardíaco, refleja la frecuencia con la que el corazón late por minuto (frecuencia cardíaca) y cuánta sangre bombea con cada latido (volumen latido); esto puede expresarse como el producto de la frecuencia cardíaca y el volumen latido (es decir, gasto cardíaco = frecuencia cardíaca × volumen latido). La frecuencia cardíaca está regulada por un equilibrio entre la actividad del sistema nervioso simpático, que produce un incremento de la frecuencia cardíaca, y el sistema nervioso parasimpático, que lo hace más lento, mientras que el volumen latido es una función de la precarga, la poscarga y la contractilidad miocárdica.
Precarga y poscarga
El trabajo que realiza el corazón consiste en su mayoría en eyectar la sangre que ha regresado a los ventrículos durante la diástole hacia la circulación pulmonar o sistémica. Se determina en gran parte por las condiciones de carga o lo que se denomina como precarga y poscarga.
La precarga refleja el volumen o condiciones de carga del ventrículo al final de la diástole justo antes del inicio de la sístole. Es el volumen de sangre que expande el músculo cardíaco al final de la diástole y, por lo general, se determina por el retorno venoso al corazón. Durante cualquier ciclo cardíaco dado, el volumen máximo de sangre que llena los ventrículos se encuentra presente al final de la diástole. Conocido como volumen telediastólico (al final de la diástole), este volumen provoca un incremento de la longitud de las fibras de músculo miocárdico. Dentro de los límites, conforme el volumen telediastólico o precarga se incrementan, el volumen latido aumenta en concordancia con el mecanismo de Frank-Starling.
La poscarga representa la fuerza que el músculo cardíaco en contracción debe generar para eyectar la sangre del corazón lleno. Los componentes principales de la poscarga son la resistencia vascular sistémica (periférica) y la tensión de la pared ventricular. Cuando la resistencia vascular sistémica es elevada, como en la hipertensión arterial, debe generarse una presión intraventricular izquierda incrementada para abrir primero la válvula aórtica y luego mover la sangre fuera del ventrículo y hacia la circulación sistémica. Esta presión incrementada equivale a un aumento del estrés o tensión de las paredes ventriculares. Como resultado, una poscarga excesiva puede alterar la eyección ventricular e incrementar la tensión de la pared.
Contractilidad miocárdica
La contractilidad miocárdica, también conocida como inotropismo, se refiere al desempeño contráctil del corazón. Representa la capacidad de los elementos contráctiles (filamentos de actina y miosina) del músculo cardíaco para interactuar y acortarse contra una carga. La contractilidad incrementa el gasto cardíaco de modo independiente a la precarga y poscarga.
La interacción entre los filamentos de actina y miosina durante la contracción del músculo cardíaco (es decir, el enlace y desenlace de puentes cruzados) requiere el empleo de energía proporcionada por la degradación de trifosfato de adenosina (ATP) y la presencia de iones de calcio (Ca++). El ATP proporciona la energía necesaria para la formación de puentes cruzados durante la contracción del músculo cardíaco y para desenlazar dichos puentes durante la relajación muscular.
Como en el músculo esquelético, cuando un potencial de acción pasa a través de la fibra demúsculo cardíaco, el impulso se disemina hacia el interior de la fibra muscular a lo largo de las membranas de los túbulos transversos (T). Los potenciales de acción del túbulo T a su vez actúan para provocar la liberación de Ca++ desde el retículo sarcoplásmico (figura 34-1). Estos iones de Ca++ difunden hacia las miofibrillas y catalizan las reacciones químicas que promueven el deslizamiento de los filamentos de actina y miosina entre sí para producir el acortamiento muscular.
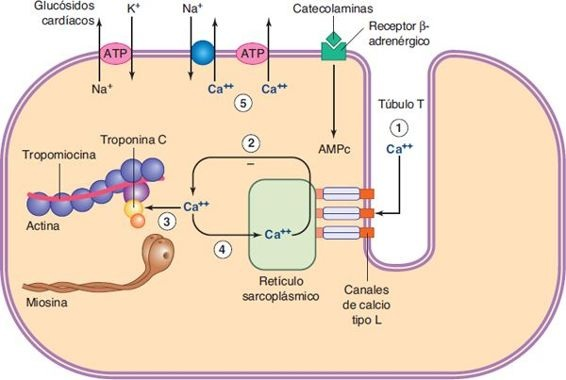
Además de los iones Ca++ liberados por el retículo sarcoplásmico, una gran cantidad de Ca++ extracelular también difunde hacia el sarcoplasma a través de los canales tipo L de Ca++ dependientes de voltaje en los túbulos T al momento del potencial de acción. Sin el Ca++ adicional que entra a través de los canales de Ca++ tipo L, la fuerza de la contracción cardíaca sería considerablemente más débil. La abertura de los canales de Ca++ tipo L se facilita por el segundo mensajero monofosfato de adenosina cíclico (AMPc), cuya formación está acoplada con receptores β-adrenérgicos. Las catecolaminas (norepinefrina y adrenalina) ejercen sus efectos inotrópicos al unirse a estos receptores. Los canales de calcio tipo L también contienen otros tipos de receptores farmacológicos.
Los fármacos bloqueadores dihidropiridínicos de los canales de Ca++ (ej. nifedipina) ejercen sus efectos al unirse a un sitio, mientras que el diltiazem y el verapamil parecen unirse a receptores muy relacionados pero no idénticos, en otra región. El bloqueo de los canales de Ca++ en el músculo cardíaco por estos fármacos provoca una disminución de la contractilidad a través del corazón y una reducción de la frecuencia del marcapasos en el nódulo sinusal y en la velocidad de conducción del nódulo auriculoventricular.
Otro mecanismo que puede modular el inotropismo es la bomba de intercambio de iones sodio (Na+)/Ca++ y la bomba de Ca++ dependiente de ATP en la membrana de las células miocárdicas (figura 34-1). Esta bomba transporta Ca++ fuera de la célula, lo que evita que la célula se sobrecargue con Ca++. Si se inhibe la extrusión de Ca++, el incremento de Ca++ intracelular puede aumentar el inotroposmo. Los digitálicos y los glucósidos cardíacos relacionados son fármacos inotrópicos que ejercen sus efectos al inhibir la bomba de iones Na+ /potasio (K +)-ATPasa, lo cual incrementa el Na+ intracelular; esto a su vez provoca un aumento de Ca++ intracelular gracias a la bomba de intercambio de Na+ /Ca++.
Disfunción sistólica frente a diastólica
La clasificación divide la fisiopatología de la insuficiencia cardíaca en insuficiencia o disfunción sistólica y diastólica con base en la fracción de eyección ventricular. La fracción de eyección es el porcentaje de sangre bombeada fuera de los ventrículos con cada contracción. Una fracción de eyección normal es entre el 55% y el 70%. En la disfunción ventricular sistólica, se afecta la contractilidad miocárdica, lo que ocasiona una disminución de la fracción de eyección y del gasto cardíaco. La disfunción ventricular diastólica se caracteriza por una fracción de eyección normal y una relajación ventricular diastólica alterada, lo que produce una disminución del llenado ventricular y, con el tiempo, una reducción de la poscarga, el volumen latido y el gasto cardíaco. Numerosas personas con insuficiencia cardíaca tienen elementos combinados de disfunción ventricular tanto sistólica como diastólica y la división entre estos tipos de disfunción puede ser un tanto artificial, en particular respecto a las manifestaciones y tratamiento. Es importante notar que la disfunción ventricular no es sinónimo de insuficiencia cardíaca. Sin embargo, puede provocar insuficiencia cardíaca. En la disfunción ventricular sistólica y diastólica, por lo general los mecanismos compensatorios son capaces de mantener una función cardíaca en reposo hasta las etapas más graves de la insuficiencia cardíaca.
Disfunción sistólica
La disfunción sistólica se define principalmente como una disminución de la contractilidad miocárdica, caracterizada por una fracción de eyección menor del 40%. Un corazón normal eyecta alrededor del 65% de la sangre que se encuentra en el ventrículo al final de la diástole.
En la insuficiencia cardíaca sistólica, la fracción de eyección disminuye de manera progresiva según aumenta el grado de disfunción miocárdica. En las formas muy graves de la insuficiencia cardíaca, la fracción de eyección puede disminuir a un porcentaje de un solo dígito. Con el decremento de la fracción de eyección, se incrementa el volumen telediastólico (precarga), la dilatación ventricular y la tensión de la pared del ventrículo, y aumenta la presión telediastólica ventricular. El volumen incrementado, aunado a un retorno venoso normal, provoca un incremento de la precarga ventricular. Se piensa que el aumento de la precarga es un mecanismo compensatorio para ayudar a mantener el volumen latido a través del mecanismo de Frank-Starling a pesar de la disminución de la fracción de eyección. A pesar de que funciona como mecanismo compensatorio, la precarga incrementada también puede provocar una de las consecuencias más deletéreas de la disfunción ventricular sistólica, la acumulación de sangre en las aurículas y el sistema venoso (que se vacía en las aurículas), lo cual provoca edema pulmonar o periférico.
Es frecuente que la disfunción sistólica sea resultado de afecciones que alteran el desempeñocontráctil del corazón (ej. cardiopatía isquémica y cardiomiopatía), que producen sobrecarga de volumen (ej. insuficiencia valvular y anemia), o que generan una sobrecarga de presión (ej. hipertensión y estenosis valvular) sobre el corazón. La extensión de la disfunción ventricular sistólica puede estimarse con la medición del gasto cardíaco y la fracción de eyección, además de la evaluación en busca de manifestaciones de insuficiencia cardíaca del lado izquierdo, en particular congestión pulmonar.
Disfunción diastólica
Pese a que la insuficiencia cardíaca tiene una relación frecuente con una función sistólica alterada, en alrededor de 55% de los casos, la función sistólica se ha encontrado preservada y la insuficiencia cardíaca ocurre de manera exclusiva con base en la disfunción diastólica del ventrículo izquierdo. Aunque dichos corazones se contraen con normalidad, la relajación es anómala. El llenado anómalo del ventrículo compromete el gasto cardíaco, en especial durante el ejercicio. Para un volumen ventricular dado, las presiones ventriculares se incrementan, lo que provoca signos de congestión pulmonar y venosa sistémica idénticos a los observados en personas con un corazón dilatado que se contrae poco. La prevalencia de insuficiencia diastólica se incrementa con la edad y es mayor en mujeres que en hombres y en personas con hipertensión y fibrilación auricular.
Entre los padecimientos que provocan disfunción diastólica se encuentran aquellos que impiden la expansión de los ventrículos (ej. efusión pericárdica, pericarditis constrictiva), aquellos que incrementan el grosor de las paredes y disminuyen el tamaño de las cámaras (ej. hipertrofia miocárdica, cardiomiopatía hipertrófica), y aquellos que retrasan la relajación diastólica (ej. envejecimiento, enfermedad cardíaca isquémica). El envejecimiento se acompaña con frecuencia por un retraso de la relajación del corazón durante la diástole, de tal modo que el llenado diastólico comienza cuando el ventrículo aún está rígido y resistente al estiramiento para aceptar un aumento de volumen. Un retraso similar ocurre en la isquemia miocárdica, consecuencia de la falta de energía para romper la dureza que se forma entre los filamentos de actina y miosina, y para mover el Ca++ fuera del citosol y de regreso hacia el retículo sarcoplásmico.
La función diastólica recibe influencia de la frecuencia cardíaca, la cual determina de cuánto tiempo se dispone para el llenado ventricular. Un incremento de la frecuencia cardíaca acorta el tiempo de llenado diastólico. De tal manera, la disfunción diastólica puede agravarse por la taquicardia o por una arritmia y mejorar con la disminución de la frecuencia cardíaca, lo cual permite al corazón llenarse durante un período más prolongado.
Con la disfunción diastólica, la sangre es incapaz de moverse con libertad hacia el ventrículo izquierdo, lo que provoca un aumento de la presión intraventricular con cualquier volumen dado. Las presiones elevadas se transfieren desde el ventrículo izquierdo hasta la aurícula izquierda y el sistema venoso pulmonar, lo que ocasiona una disminución de la distensibilidad pulmonar, aumenta el trabajo de respiraración y evoca los síntomas de disnea. El gasto cardíaco disminuye, no debido a una fracción de eyección ventricular disminuida como se observa en la disfunción sistólica, sino debido a una reducción del volumen (precarga) disponible para un gasto cardíaco adecuado. El gasto cardíaco inadecuado durante el ejercicio puede provocar fatiga de las piernas y de los músculos accesorios de la respiración.
Disfunción ventricular derecha frente a izquierda
La insuficiencia cardíaca se ha clasificado según el lado del corazón (ventricular derecha o ventricular izquierda) que se afecta de manera primaria (figura 34-2).
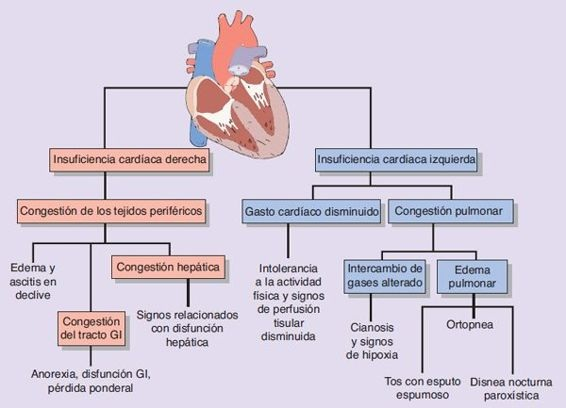
A pesar de que el accidente inicial que provoca la insuficiencia cardíaca puede tener un origen principal en el ventrículo derecho o izquierdo, por lo general la insuficiencia cardíaca de larga evolución implica ambos lados.Los cambios fisiopatológicos que ocurren en el miocardio, incluidas las respuestas compensatorias en condiciones como el infarto de miocardio, no tienen diferencias significativas entre la disfunción ventricular derecha e izquierda, y no se explican a detalle en esta sección.
Disfunción ventricular derecha
La insuficiencia cardíaca afecta la capacidad para mover la sangre desoxigenada desde la circulación sistémica hasta la circulación pulmonar. En consecuencia, cuando el ventrículo derecho tiene un fallo, hay una disminución de la cantidad de sangre transportada hacia la circulación pulmonar y luego hacia el lado izquierdo del corazón, lo que resulta en una reducción del gasto cardíaco ventricular izquierdo. Además, si el ventrículo derecho no mueve la sangre de modo anterógrado, hay una acumulación o congestión de sangre en el sistema venoso sistémico. Esto causa un incremento de las presiones telediastólica ventricular derecha, auricular derecha y venosa sistémica. Un efecto importante de la insuficiencia cardíaca del lado derecho es el desarrollo de edema periférico (figura 34-2). Debido a los efectos de la gravedad, el edema es más pronunciado en las partes en declive del organismo. Cuando la persona está de pie, el edema se observa en las extremidades inferiores; cuando la persona se encuentra en posición supina, el edema se observa en el área sobre el sacro. La acumulación de líquido de edema se evidencia por una ganancia ponderal (es decir, 568 ml de líquido acumulado ocasiona una ganancia ponderal de 0,45 kg). La medición diaria del peso puede utilizarse como un medio para valorar la acumulación de líquido en una persona con insuficiencia cardíaca crónica. Como regla, la ganancia de peso de más de 0,90 kg en 24 horas o de 2,27 kg en una semana se considera un signo de insuficiencia que está empeorando.
La insuficiencia cardíaca del lado derecho también produce congestión visceral. Conforme progresa la distensión venosa, la sangre se estanca en las venas hepáticas que drenan hacia la vena cava inferior y el hígado se ingurgita. Esto puede ocasionar hepatomegalia y dolor en el cuadrante superior derecho. En casos graves y prolongados de insuficiencia cardíaca derecha, la función hepática se altera y las células del hígado pueden morir. La congestión de la circulación porta también puede provocar ingurgitación del bazo y el desarrollo de ascitis. La congestión del tracto gastrointestinal puede interferir con la digestión y la absorción de nutrientes, y provocar anorexia y malestar abdominal. Las venas yugulares, que se encuentran sobre el nivel del corazón, se observan normales en la posición de pie o en posición sedente con la cabeza en un ángulo mayor de 30 grados.
En la insuficiencia derecha grave, las venas yugulares externas se distienden y pueden visualizarse cuando la persona se encuentra de pie o sentada.
Las causas de disfunción ventricular derecha incluyen afecciones que impiden el flujo de sangre a los pulmones o comprometen la efectividad de bombeo del ventrículo derecho. La insuficiencia ventricular izquierda es la causa más frecuente de insuficiencia ventricular derecha. La hipertensión pulmonar persistente también ocasiona disfunción e insuficiencia ventricular derecha. La hipertensión pulmonar ocurre en personas con enfermedad pulmonar crónica, neumonía grave, embolia pulmonar o estenosis de válvula aórtica o mitral. Cuando se presenta insuficiencia cardíaca derecha en respuesta a una enfermedad pulmonar crónica, se denomina cardiopatía pulmonar. Otras causas frecuentes incluyen estenosis o regurgitación de las válvulas tricúspide o pulmonar, infarto del ventrículo derecho y cardiomiopatía. La disfunción ventricular derecha con insuficiencia cardíaca también es resultado de defectos cardíacos congénitos, como tetralogía de Fallot y defecto del tabique ventricular.
Disfunción ventricular izquierda
La insuficiencia cardíaca del lado izquierdo afecta el movimiento de la sangre desde la circulación pulmonar con presión baja hacia el lado arterial con presión elevada de la circulación sistémica. Con la alteración de la función del lado izquierdo del corazón, hay una disminución del gasto cardíaco hacia la circulación sistémica. La sangre se acumula en el ventrículo izquierdo, la aurícula izquierda y la circulación pulmonar, lo que provoca un incremento de la presión venosa pulmonar (figura 34-2). Cuando la presión en los capilares pulmonares (en condiciones normales es cercana a 10 mm Hg) excede a la presión osmótica capilar (alrededor de 25 mm Hg en condiciones normales), hay un cambio del líquido intravascular hacia el intersticio de los pulmones y desarrollo de edema pulmonar (figura 34-3).
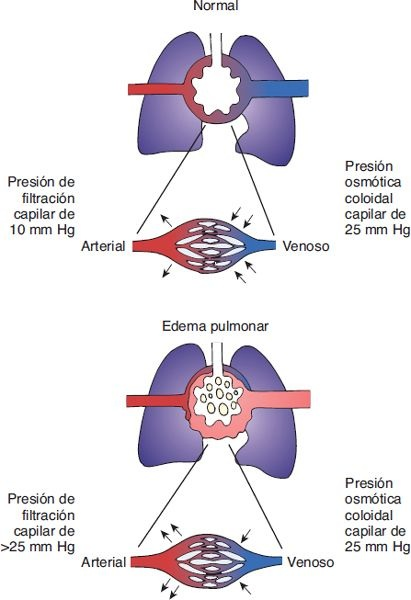
Con frecuencia, los episodios de edema pulmonar ocurren por la noche, después de que la persona se ha reclinado por cierto tiempo y las fuerzas gravitacionales se han retirado del sistema circulatorio. Entonces es cuando el líquido de edema que se había secuestrado en las extremidades inferiores durante el día regresa al compartimento vascular y se redistribuye a la circulación pulmonar.
Las causas más frecuentes de disfunción ventricular izquierda son la hipertensión y el infarto de miocardio agudo. La insuficiencia cardíaca ventricular izquierda y la congestión pulmonar pueden desarrollarse con gran rapidez en personas con infarto de miocardio agudo. Incluso cuando el área infartada es pequeña, puede haber un área circundante de tejido isquémico. Esto puede ocasionar áreas grandes de hipocinesia o acinesia de la pared ventricular y el inicio rápido de congestión o edema pulmonares. La estenosis o regurgitación de las válvulas aórtica o mitral crea el nivel de flujo retrógrado en el lado izquierdo que provoca congestión pulmonar. Conforme la presión pulmonar se incrementa como resultado de la congestión, puede progresar hasta producir insuficiencia cardíaca derecha.
Insuficiencia de gasto alto frente a de gasto bajo
La insuficiencia cardíaca de gasto alto y de gasto bajo se describe en términos del gasto cardíaco. La insuficiencia de gasto alto es un tipo poco frecuente de insuficiencia cardíaca ocasionado por una necesidad excesiva de gasto cardíaco. En la insuficiencia de gasto elevado, la función del corazón puede ser supranormal e inadecuada debido a las necesidades metabólicas excesivas. Las causas de insuficiencia de gasto alto incluyen anemia grave, tirotoxicosis, padecimientos que provocan desviaciones/cortocircuitos arteriovenosos y la enfermedad de Paget.
La insuficiencia de gasto bajo es consecuencia de padecimientos que alteran la capacidad de bombeo del corazón, como en la cardiopatía isquémica y la cardiomiopatía. La insuficiencia de gasto bajo se caracteriza por evidencia clínica de vasoconstricción sistémica con extremidades pálidas, frías y en ocasiones cianóticas. En las formas avanzadas de insuficiencia de gasto bajo, la reducción marcada del volumen latido se evidencia por el estrechamiento de la presión de pulso. En contraste, en la insuficiencia de gasto elevado, es usual que las extremidades estén calientes y enrojecidas, además de que la presión de pulso está ensanchada o, por lo menos, normal.
Mecanismos compensatorios
En la insuficiencia cardíaca, la reserva cardíaca se mantiene en gran parte a través de respuestas compensatorias o adaptativas, como el mecanismo de Frank-Starling, la activación de influencias neurohumorales como los reflejos del sistema nervioso simpático, el mecanismo de renina-angiotensina-aldosterona, péptidos natriuréticos, sustancias vasoactivas de producción local, hipertrofia y remodelación miocárdicas (figura 34-4).
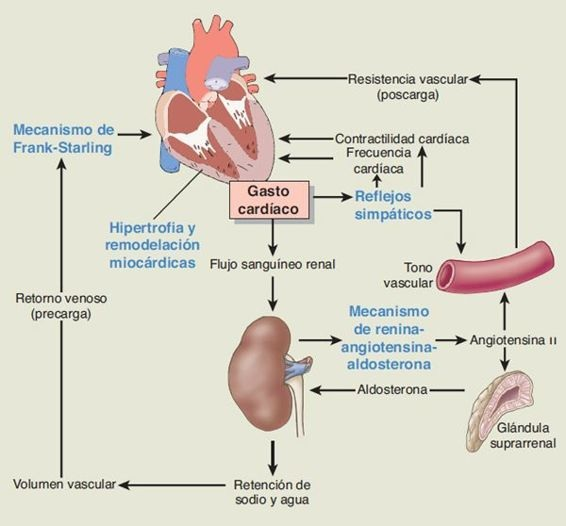
La primera de estas adaptaciones ocurre con rapidez en un lapso de minutos a horas después de la disfunción miocárdica y puede ser adecuada para mantener el desempeño de bombeo general del corazón en un grado relativamente normal. La hipertrofia y remodelación miocárdicas ocurren con lentitud en un lapso de meses o años, y tiene un papel importante en la adaptación a la sobrecarga hemodinámica a largo plazo. En el corazón insuficiente, la disminución temprana de la función cardíaca puede permanecer desapercibida debido a que estos mecanismos compensatorios mantienen el gasto cardíaco. Sin embargo, estos mecanismos contribuyen no sólo a la adaptación del corazón insuficiente sino también a la fisiopatología de la insuficiencia cardíaca.
Mecanismo de Frank-Starling
El mecanismo de Frank-Starling opera a través de un incremento de la precarga (figura 34-5). Con un llenado diastólico incrementado, hay un mayor estiramiento de las fibras miocárdicas y mayor aproximación óptima de las cabezas en los filamentos gruesos de miosina con los sitios de unión a troponina en los filamentos delgados de actina, con un incremento resultante de la fuerza de la siguiente contracción. En el corazón que funciona de modo normal, el mecanismo de Frank-Starling funciona para equilibrar el gsto de los dos ventrículos. Como se ilustra en la figura 34-5, no hay una sola curva de Frank-Starling. Un incremento de la contractilidad, o inotropismo, aumentará el gasto cardíaco en cualquier volumen telediastólico, provocando que la curva se mueva hacia arriba y a la izquierda, mientras que una disminución del inotropismo provocará que la curva se mueva hacia abajo y a la derecha. En la insuficiencia cardíaca, el inotropismo disminuye en comparación con circunstancias normales. De este modo, el volumen latido no será tan alto como en el inotropismo normal, sin importar el incremento de la precarga.
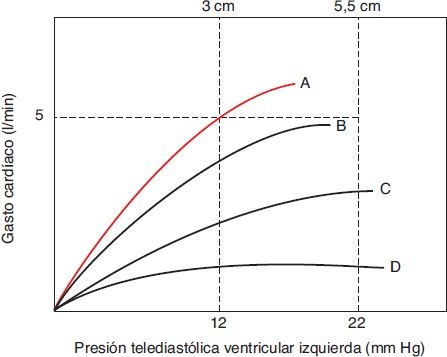
En la insuficiencia cardíaca, la disminución del gasto cardíaco y del flujo sanguíneo renal provoca una mayor retención de sodio y agua, un incremento resultante del volumen vascular y del retorno venoso al corazón, así como un aumento del volumen telediastólico ventricular. Dentro de los límites, conforme aumentan la precarga y el volumen telediastólico ventricular, se incrementa el gasto cardíaco. A pesar de que esto puede preservar el gasto cardíaco en reposo, la elevación crónica resultante de la presión telediastólica del ventrículo izquierdo se transmite a las aurículas y a la circulación pulmonar, lo que provoca congestión pulmonar.
Un aumento del estiramiento muscular, como ocurre con el mecanismo de Frank-Starling, también provoca un aumento de la tensión de la pared ventricular con un aumento consecuente del consumo miocárdico de oxígeno. Debido a que la tensión aumentada de la pared aumenta los requerimientos de oxígeno, puede producir isquemia, contribuir a una mayor alteración del inotropismo y hacer que la curva de Frank-Starling se mueva hacia abajo y a la derecha (véase la figura 34-5). En esta situación, el incremento de la precarga ya no contribuye a la compensación sino que provoca que la insuficiencia cardíaca empeore. El empleo de diuréticos en personas con insuficiencia cardíaca ayuda a disminuir el volumen vascular y el llenado ventricular, lo cual disminuye la carga del corazón y la tensión de la pared ventricular.
Actividad del sistema nervioso simpático
La estimulación del sistema nervioso simpático tiene un papel importante en la respuesta compensatoria a un gasto cardíaco y un volumen latido disminuidos. Tanto el tono simpático cardíaco como las concentraciones de catecolaminas (adrenalina y norepinefrina) se encuentran elevados durante las etapas tardías de la mayoría de las formas de insuficiencia cardíaca. Mediante la estimulación directa de la frecuencia y la contractilidad cardíacas, la regulación del tono vascular y el reforzamiento de la retención renal de sodio y agua, el sistema nervioso simpático ayuda al inicio a mantener la perfusión de los diversos órganos corporales. En personas que presentan insuficiencia cardíaca más grave y progresiva, la sangre se desvía hacia las circulaciones más críticas, es decir, la cerebral y la coronaria.
Pese a que la respuesta del sistema nervioso simpático pretende aumentar la presión arterial y el gasto cardíaco, y es el mecanismo compensatorio más inmediato, puede tornarse maladaptativo. Un incremento de la actividad simpática por estimulación de los receptores β-adrenérgicos del corazón provoca taquicardia, vasoconstricción y arritmias cardíacas. En situaciones agudas, la taquicardia aumenta de manera significativa la carga de trabajo del corazón, lo que incrementa la demanda miocárdica de oxígeno y ocasiona isquemia cardíaca, daño de miocitos y disminución de la contractilidad (inotropismo). La isquemia cardíaca y la cardiomiopatía contribuyen al empeoramiento de la insuficiencia cardíaca. A través de la promoción de arritmias, las catecolaminas liberadas por la estimulación del sistema nervioso simpático también pueden contribuir a la tasa elevada de muerte súbita observada con la insuficiencia cardíaca.
Se cuenta con evidencia de que la estimulación simpática prolongada también puede provocar desensibilización de los receptores β-adrenérgicos sin afectar los receptores α-adrenérgicos. Aunque las cifras de norepinefrina circulante se encuentran elevadas en personas con insuficiencia cardíaca, la ausencia de receptores β-adrenérgicos funcionales en relación con los receptores α-adrenérgicos puede provocar vasoconstricción y un aumento de la resistencia vascular sistémica. Un aumento de la resistencia vascular sistémica ocasiona un incremento de la poscarga cardíaca y tensión de la pared ventricular, lo cual aumenta el consumo miocárdico de oxígeno. Otros efectos incluyen la disminución de la perfusión renal y el aumento adicional del sistema renina-angiotensina-aldosterona, así como una reducción del flujo hacia la piel, los músculos y los órganos abdominales.
Mecanismo de renina-angiotensina-aldosterona
Uno de los efectos más importantes de la reducción del gasto cardíaco en la insuficiencia cardíaca es una disminución del flujo sanguíneo renal y de la velocidad de filtración glomerular, lo que provoca retención de sodio y agua. Con un menor flujo sanguíneo renal, hay un aumento progresivo de la secreción de renina por los riñones con incrementos paralelos de las concentraciones circulantes de angiotensina II. La mayor concentración de angiotensina II contribuye de modo directo a una vasoconstricción generalizada y excesiva, así como a la facilitación de la liberación de norepinefrina y la inhibición de la recaptación de norepinefrina por el sistema nervioso simpático.
La angiotensina II también proporciona un estímulo poderoso para la producción de aldosterona por la corteza suprarrenal. La aldosterona incrementa la reabsorción tubular de sodio, acompañada de un aumento de la retención de agua. Debido a que la aldosterona se metaboliza en el hígado, sus cifras se incrementan aún más cuando la insuficiencia cardíaca ocasiona congestión hepática.
Angiotensina II también aumenta las concentraciones de hormona antidiurética (HAD), que funciona como un vasoconstrictor e inhibidor de la excreción de agua. En la insuficiencia cardíaca, la acumulación progresiva de líquido provoca la dilatación ventricular y un aumento de la tensión de la pared. La mayor demanda de oxígeno que acompaña al aumento de la tensión de la pared supera con el tiempo al mecanismo compensatorio de Frank-Starling, por lo que disminuye el inotropismo y empeora la insuficiencia cardíaca.
Además de los efectos individuales sobre el equilibrio de sodio y agua, la angiotensina II y la aldosterona también están implicadas en la regulación de procesos inflamatorios y reparadores que siguen a la lesión de los tejidos. Al respecto, estimulan la producción de citocinas inflamatorias (ej. factor de necrosis tumoral [FNT] e interleucina-6), atraen células inflamatorias (ej. neutrófilos y macrófagos), activan macrófagos en sitios de lesión y reparación, y estimulan el crecimiento de fibroblastos y la síntesis de fibras de colágeno. Los fibroblastos y el depósito de colágeno provocan hipertrofia ventricular y fibrosis de las paredes miocárdicas, lo que disminuye la distensibilidad (es decir, aumenta la rigidez), que, por último, provoca disfunción ventricular tanto sistólica como diastólica. De este modo, la progresión de la insuficiencia cardíaca puede avanzar debido a efectos mediados por aldosterona sobre la vasculatura y el miocardio.
Péptidos natriuréticos
El músculo cardíaco produce y secreta una familia de hormonas peptídicas relacionadas, las hormonas natriuréticas cardíacas o péptidos natriuréticos (PN), que tienen potentes efectos diuréticos, natriuréticos y sobre el músculo liso vascular, además de interactuar con otros mecanismos neurohumorales que afectan la función cardiovascular. Dos de los 4 PN conocidos relacionados con mayor frecuencia con insuficiencia cardíaca son el péptido natriurético auricular (PNA) y el péptido natriurético cerebral (PNC).
Como su nombre lo indica, el PNA se libera por las células auriculares en respuesta al estiramiento, presión o sobrecarga de líquido en las aurículas. El PNC se secreta primordialmente por los ventrículos como respuesta a un aumento de la presión ventricular o sobrecarga de líquido.
En la insuficiencia cardíaca temprana, NTproPNC puede detectarse como un precursor de PNC en la sangre. Aunque los PN no se secretan en las mismas cámaras en el corazón, tienen funciones muy similares. En respuesta a un incremento del estiramiento o de la presión de una cámara, promueven la natriuresis y diuresis transitorias rápidas mediante un aumento de la tasa de filtración glomerular y la inhibición de la reabsorción tubular de sodio y agua.
Los PN también facilitan interacciones complejas con el sistema neurohumoral al inhibir el sistema nervioso simpático, el sistema renina-angiotensina-aldosterona, las citocinas inflamatorias relacionadas con endotelina y la vasopresina. La supresión del sistema nervioso simpático ocasiona dilatación venosa y arterial con reducción consecuente del retorno venoso al corazón (precargareducida) y presiones de llenado cardíaco, y una disminución de la poscarga (vasodilatación arterial).
La inhibición de angiotensina II y vasopresina por los PN disminuye la retención renal de líquido.
Además, los PNT afectan de modo directo el sistema nervioso central y el cerebro mediante la inhibición de la secreción de vasopresina y la función del centro de la sed y el apetito por la sal.
Se ha informado que las concentraciones de PNA y PNC circulantes son elevadas en personas con insuficiencia cardíaca. Las cifras de PNC y NT-proPNC pueden detectarse mediante análisis de sangre y equipos comerciales. Las concentraciones tienen una buena correlación con la extensión de la disfunción ventricular y se incrementan hasta 30 veces en personas con cardiopatía avanzada. Los análisis de PNC se utilizan en clínica para el diagnóstico de insuficiencia cardíaca y para predecir la gravedad del padecimiento. Muchos de los medicamentos utilizados para tratar la insuficiencia cardíaca (ej. diuréticos, como espironolactona, y los inhibidores de la enzima convertidora de angiotensina [ECA]) disminuyen las concentraciones de PNC. Por lo tanto, numerosas personas con insuficiencia cardíaca estable crónica tienen cifras de PNC en el intervalo diagnóstico normal. No obstante, la digoxina y los β-bloqueadores parecen aumentar las concentraciones de PNC. Se cuenta con fármacos diseñados para inhibir la degradación de PN como un potencial terapéutico.
Endotelinas
Las endotelinas, liberadas por las células endoteliales a todo lo largo del sistema circulatorio, son péptidos vasoconstrictores potentes. Como la angiotensina II, las endotelinas también pueden sintetizarse y liberarse por una variedad de tipos celulares, como los miocitos cardíacos. Se han identificado 4 endotelinas peptídicas (endotelina-1 [ET-1], ET-2, ET-3 y ET-4). Sin embargo, todas sus funciones fisiológicas aún no son claras. Se ha encontrado que las endotelinas inducen la proliferación de las células de músculo liso vascular y la hipertrofia de los miocitos cardíacos; incrementan la liberación de PNA, aldosterona y catecolaminas; y tienen efectos antinatriuréticos sobre los riñones. La producción de ET-1 está regulada por diversos factores significativos para la función cardiovascular y están implicados en la insuficiencia cardíaca. Por ejemplo, se refuerza por angiotensina II, vasopresina y norepinefrina, y por factores como la tensión de cizallamiento y el estiramiento endotelial. Las concentraciones plasmáticas de ET-1 también tienen una correlación directa con la resistencia vascular pulmonar y se piensa que el péptido puede tener un papel en la mediación de la hipertensión pulmonar en personas con insuficiencia cardíaca.
Hay por lo menos 2 tipos de receptores de endotelinas: tipo A y tipo B. El receptor tipo A se relaciona con la constricción del músculo liso y la hipertrofia, mientras que el receptor tipo B se relaciona con la vasodilatación. Debido a que ET-1 puede actuar sobre el corazón para provocar hipertrofia y retención de sodio y agua, ahora se dispone de un antagonista del receptor de endotelina para utilizarlo en personas con hipertensión arterial pulmonar debida a insuficiencia cardíaca grave.
Mediadores inflamatorios
Al momento hay estudios en proceso que examinan la relación entre los marcadores inflamatorios, en especial la proteína C reactiva (PCR) y la insuficiencia cardíaca. Las concentraciones elevadas de PCR se han relacionado con consecuencias adversas en personas con insuficiencia cardíaca. También se ha demostrado que son predictivas para el desarrollo de insuficiencia cardíaca en grupos de alto riesgo. Las interacciones entre PCR y los mediadores son de particular interés, como la angiotensina II y la norepinefrina. Esta relación inflamatoria continúa bajo investigación. No obstante, es difícil evaluarla si no se comprende cómo disminuir el efecto inflamatorio en la insuficiencia cardíaca.
Hipertrofia y remodelación miocárdicas
El desarrollo de la hipertrofia miocárdica constituye uno de los principales mecanismos por los cuales el corazón compensa el incremento de la carga de trabajo. A pesar de que la hipertrofia ventricular mejora el desempeño de trabajo del corazón,también es un factor de riesgo importante para morbilidad y mortalidad cardíacas subsecuentes. La hipertrofia y remodelación inadecuadas pueden provocar cambios en la estructura (es decir, en la masa muscular o la dilatación de las cámaras) y la función (es decir, función sistólica o diastólica alteradas) que con frecuencia promueven una mayor disfunción de bombeo y sobrecarga hemodinámica.
La hipertrofia y remodelación miocárdicas implican una serie de sucesos complejos tanto a nivel molecular como celular. El miocardio está compuesto por miocitos, o células musculares, y células distintas a miocitos. Los miocitos son las unidades funcionales del músculo cardíaco. Su crecimiento está limitado por un incremento del tamaño celular, en contraposición con un incremento de la cantidad de células. Las células distintas a miocitos incluyen macrófagos y fibroblastos cardíacos, células endoteliales y de músculo liso vascular. Estas células, que se encuentran en el espacio intersticial, aún son capaces de incrementar su número y proporcionar soporte para los miocitos. Las células distintas a miocitos también determinan muchos de los cambios inadecuados que ocurren durante la hipertrofia miocárdica. Por ejemplo, el crecimiento descontrolado de los fibroblastos cardíacos se relaciona con un incremento de la síntesis de fibras de colágeno, fibrosis miocárdica y rigidez de la pared ventricular. La rigidez de la pared ventricular no sólo incrementa la carga de trabajo del corazón, sino que la fibrosis y la remodelación que ocurren pueden provocar anomalías de la conducción eléctrica, por lo que el corazón se contrae de modo descoordinado, lo cual se denomina disincronía cardíaca, y provoca la disminución de la función sistólica cardíaca.
La investigación reciente se ha enfocado en el tipo de hipertrofia que se desarrolla en personas con insuficiencia cardíaca. A nivel celular, las células de músculo cardíaco responden a estímulos por tensión en la pared ventricular, tanto por sobrecarga de volumen como de presión al inicial diferentes procesos que ocasionan hipertrofia. Estos incluyen los estímulos que producen los siguientes:
- Hipertrofia simétrica, con un incremento proporcional de la longitud y grosor del músculo, como ocurre en los atletas.
- Hipertrofia concéntrica, con un incremento del grosor de la pared, como ocurre en la hipertensión.
- Hipertrofia excéntrica, con un incremento desproporcionado de la longitud muscular, como ocurre en la cardiomiopatía dilatada (figura 34-6).
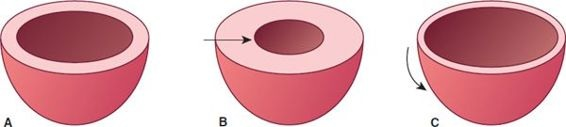
Cuando el estímulo primario para la hipertrofia es la sobrecarga de presión, el incremento de la tensión de la pared provoca la replicación paralela de las miofibrillas, el engrosamiento de los miocitos individuales y la hipertrofia concéntrica. La hipertrofia concéntrica puede preservar la función sistólica por cierto tiempo, pero con el tiempo, el trabajo realizado por el ventrículo excede a la reserva vascular, lo cual predispone a isquemia. Cuando el estímulo primario es la sobrecarga de volumen ventricular, el incremento de la tensión de la pared provoca la replicación de las miofibrillas en series, la elongación de las células de músculo cardíaco y la hipertrofia excéntrica. La hipertrofia excéntrica provoca una disminución del grosor de la pared ventricular con un aumento del volumen diastólico y de la tensión de la pared.
Síndromes con insuficiencia cardíaca aguda
Los síndromes con insuficiencia cardíaca aguda (SICA) se definen como «cambios graduales o rápidos en los signos y síntomas de insuficiencia cardíaca que provocan la necesidad de tratamiento urgente». Estos síntomas son el resultado primario del edema pulmonar debido a presiones elevadas de llenado del ventrículo izquierdo, con o sin disminución del gasto cardíaco. Estos síndromes se encuentran entre los padecimientos más frecuentes observados en el departamento de urgencias, y la insuficiencia cardíaca crónica, con frecuencia complicada por episodios de empeoramiento agudo, es la causa más frecuente del síndrome.
Se piensa que los SICA acompañan a 3 condiciones diferentes:
- Empeoramiento de la disfunción sistólica o diastólica crónica que parece responder a tratamiento, alrededor del 80%.
- Insuficiencia cardíaca aguda de inicio reciente que ocurre secundaria a un accidente precipitante como un infarto de miocardio grande o un incremento súbito de la presión arterial superpuesto a un ventrículo izquierdo que no responde.
- Empeoramiento de una insuficiencia cardíaca avanzada o en etapa terminal refractaria a tratamiento, con disfunción sistólica predominante del ventrículo izquierdo relacionada con un estado de bajo gasto.
La diferencia entre los SICA de inicio reciente y los SICA productos de la insuficiencia cardíaca crónica es el grado de respuesta fisiológica, que es más pronunciada en los SICA de inicio reciente y más sutil en la insuficiencia cardíaca crónica debido a la fisiopatología compensatoria. Por ejemplo, en los SICA de inicio reciente, la persona presenta una respuesta simpática más potente con permeabilidad vascular pulmonar reforzada, lo cual produce síntomas rápidos y radicales de edema pulmonar. Debido a que en las personas con insuficiencia cardíaca crónica operan numerosos mecanismos compensatorios, toleran presiones vasculares pulmonares más elevadas. Los cambios crónicos en la regulación neurohumoral provocan una activación más potente del sistema angiotensina-aldosterona con una sobrecarga de volumen resultante, y la congestión venosa es más prominente tanto en la circulación sistémica como en la pulmonar.
Manifestaciones clínicas de la insuficiencia cardíaca
Las manifestaciones de la insuficiencia cardíaca dependen de la extensión y tipo de disfunción cardíaca presente y la rapidez con la cual se desarrolla. Una persona con insuficiencia cardíaca estable y compensada con anterioridad puede desarrollar signos de insuficiencia cardíaca por primera vez cuando la condición ha avanzado hasta un punto crítico, como con un incremento progresivo de la hipertensión pulmonar en una persona con regurgitación de la válvula mitral. La insuficiencia cardíaca franca también puede precipitarse por situaciones como infección, estrés emocional, hipertensión descontrolada o sobrecarga de líquidos. Numerosas personas con cardiopatía subyacente grave, sin importar si habían presentado insuficiencia cardíaca con anterioridad, pueden encontrarse relativamente asintomáticas mientras se apeguen con cuidado a su esquema terapéutico. Un exceso dietético de sodio es una causa frecuente de descompensacióncardíaca súbita.
Las manifestaciones de la insuficiencia cardíaca reflejan los efectos fisiológicos de la capacidad de bombeo alterada del corazón, un flujo sanguíneo renal disminuido y la activación de los mecanismos compensatorios simpáticos. La gravedad de la progresión de los síntomas depende de la extensión y tipo de disfunción que se encuentren (sistólica frente a diastólica, derecha frente a izquierda). Los signos y síntomas incluyen dificultad respiratoria y otras manifestaciones respiratorias, fatiga y tolerancia limitada al ejercicio, retención de líquidos y edema, caquexia y desnutrición, y cianosis. Las personas con insuficiencia cardíaca grave pueden presentar diaforesis y taquicardia.
Manifestaciones respiratorias
La dificultad respiratoria debida a congestión de la circulación pulmonar es una de las manifestaciones principales de la insuficiencia cardíaca izquierda. La dificultad respiratoria percibida (es decir, la falta de aliento) se denomina disnea. La disnea relacionada con un incremento de la actividad se conoce como disnea de esfuerzo. La ortopnea es la dificultad respiratoria que ocurre cuando la persona se encuentra en posición supina. Las fuerzas gravitacionales provocan el secuestro de líquido en la región inferior de las piernas y los pies cuando la persona se encuentra en posición de pie o sedente. Cuando la persona asume la posición recostada, el líquido de las piernas y las partes en declive del cuerpo se moviliza y redistribuye hacia la circulación pulmonar que ya está distendida.
La disnea paroxística nocturna es un ataque súbito de disnea que ocurre durante el sueño. Interrumpe el sueño y la persona despierta con una sensación de sofocación extrema que se resuelve al sentarse.
Al inicio, la experiencia puede interpretarse como el despertar por una pesadilla.
Un síntoma sutil y con frecuencia omitido de insuficiencia cardíaca es una tos no productiva crónica y seca que empeora cuando la persona se encuentra recostada. El broncospasmo debido a la congestión de la mucosa bronquial puede provocar sibilancias y dificultad para respirar. Esta condición se denomina en ocasiones asma cardíaca.
Respiración de Cheyne-Stokes
La respiración de Cheyne-Stokes es un patrón de respiración periódica caracterizado por un incremento gradual de la profundidad (y, en ocasiones, la frecuencia) de la respiración hasta su máximo, seguido de una disminución que produce apnea. A pesar de que ya no se relaciona sólo con la insuficiencia cardíaca, se reconoce como un factor de riesgo independiente para empeoramiento de insuficiencia cardíaca. Se ha sugerido que la respiración de Cheyne-Stokess puede no ser sólo un marcador para la progresión de la insuficiencia cardíaca sino que también puede agravarla. Durante el sueño, la respiración de Cheyne-Stokes ocasiona despertares recurrentes y esto disminuye el sueño de ondas lentas y de movimiento ocular rápido (REM, por sus siglas en inglés). El ciclado recurrente de hipoventilación/apnea e hiperventilación también puede incrementar la actividad simpática y predisponer a arritmias. Se ha observado que el empleo nocturno de oxígeno mejora el sueño, la tolerancia al ejercicio y la función cognitiva.
Edema pulmonar agudo
El edema pulmonar agudo es el síntoma más radical de SICA. Es un padecimiento que pone en riesgo la vida que implica el movimiento del líquido capilar hacia los alvéolos. El líquido acumulado en los alvéolos y las vías respiratorias provoca rigidez pulmonar, dificulta la expansión de los pulmones y altera la función de intercambio de gases de los pulmones.
Con la capacidad disminuida de los pulmones para oxigenar la sangre, la hemoglobina abandona la circulación pulmonar sin oxigenarse por completo, lo cual ocasiona dificultad respiratoria y cianosis.
Por lo general, la persona con edema pulmonar grave se observa sentada y jadeando en busca de aire. El pulso es rápido, la piel húmeda y fría, y los labios y lechos ungueales se encuentran cianóticos. Conforme el edema pulmonar empeora y disminuye el suministro de oxígeno al cerebro, aparecen confusión y estupor. La disnea y la búsqueda de aire se acompañan de una tos productiva con esputo espumoso (parecido a claras de huevo) y, con frecuencia, teñido de sangre: el efecto de la mezcla de aire con albúmina sérica y eritrocitos que entran a los alvéolos. El movimiento del aire a través del líquido alveolar produce un sonido de crujido denominado crepitaciones, que se escuchan con la auscultación del tórax. Si el líquido se mueve hacia las vías respiratorias más grandes, las crepitaciones se tornan más audibles y gruesas/toscas.
Fatiga, debilidad y confusión mental
Con frecuencia, la debilidad y la fatiga acompañan al gasto disminuido del ventrículo izquierdo. La fatiga cardíaca es diferente a la fatiga general, ya que es usual que no se encuentre por la mañana, sino que aparezca y progrese conforme se incrementa la actividad durante el día.
En la insuficiencia izquierda grave, el gasto cardíaco puede disminuir a tal grado que es insuficiente para proporcionar suficiente oxígeno al cerebro y hay indicaciones de confusión mental y comportamiento alterado. La confusión, la alteración de la memoria, la ansiedad, agitación y el insomnio son frecuentes en personas mayores con insuficiencia cardíaca avanzada, en particular en aquellos con aterosclerosis cerebral. Estos síntomas pueden confundir el diagnóstico de insuficiencia cardíaca en adultos de edad avanzada debido a que cuentan con una miríada de otras causas relacionadas con el envejecimiento.
Retención de líquidos y edema
Muchas de las manifestaciones de la insuficiencia cardíaca son consecuencia del incremento de las presiones capilares (presiones hidrostáticas aumentadas) que se desarrollan en la circulación periférica en personas con insuficiencia cardíaca derecha y en la circulación pulmonar en personas con insuficiencia cardíaca izquierda. La presión capilar incrementada refleja un llenado excesivo del sistema vascular debido a una mayor retención de agua y sodio, así como congestión venosa, denominado antes como insuficiencia retrógrada, que es resultado de un gasto cardíaco alterado.
La nicturia es un incremento nocturno del gasto urinario que ocurre relativamente pronto en la evolución de la insuficiencia cardíaca. Sucede debido al incremento del gasto cardíaco, del flujo sanguíneo renal y de la velocidad de filtración glomerular que sigue al aumento del retorno de sangre al corazón cuando la persona se encuentra en posición supina. La oliguria, que es una disminución del gasto urinario, es un signo tardío relacionado con un gasto cardíaco muy disminuido y la insuficiencia renal consecuente.
La trasudación de líquido hacia la cavidad pleural (hidrotórax) o la cavidad peritoneal (ascitis) puede ocurrir en personas con insuficiencia cardíaca avanzada. Debido a que las venas pleurales drenan hacia los lechos venosos sistémico y pulmonar, es más frecuente observar hidrotórax en personas con hipertensión que afecta ambos sistemas venosos. La efusión pleural ocurre conforme el líquido excesivo en el espacio intersticial pulmonar cruza la pleura visceral, que a su vez sobrepasa la capacidad del sistema linfático pulmonar. La ascitis ocurre en personas con una presión incrementada en las venas hepáticas y en las venas que drenan el peritoneo. Por lo general refleja insuficiencia ventricular derecha y una elevación de la presión venosa sistémica de larga evolución en la insuficiencia cardíaca crónica.
Caquexia y desnutrición
La caquexia cardíaca es una condición de desnutrición y desgaste de los tejidos que ocurre en personas con insuficiencia cardíaca en etapa terminal. Es probable que diversos factores contribuyan a su desarrollo, incluidos la fatiga y la depresión que interfieren con la ingesta de alimento, la congestión del hígado y de las estructuras gastrointestinales que afectan la digestión y la absorción, además de producir la sensación de plenitud, y las toxinas y mediadores circulantes liberados de tejidos mal perfundidos que alteran el apetito y contribuyen al desgaste tisular.
Cianosis
La cianosis es la coloración azulada de la piel y las membranas mucosas provocada por un exceso de hemoglobina desaturada en la sangre; con frecuencia es un signo tardío de insuficiencia cardíaca. La cianosis puede ser central, causada por desaturación arterial resultante de un intercambio de gases pulmonares alterado, o periférica, producto de la desaturación venosa, consecuencia de la extracción extensa de oxígeno a nivel capilar. La cianosis central se produce por condiciones que afectan la oxigenación de la sangre arterial, como el edema pulmonar, la insuficiencia cardíaca izquierda o el cortocircuito cardíaco de derecha a izquierda. La cianosis periférica se debe a condiciones como la insuficiencia de gasto bajo que ocasiona la entrega de sangre poco oxigenada a los tejidos periféricos, o por condiciones como la vasoconstricción periférica que provoca la remoción excesiva de oxígeno de la sangre. La cianosis central se observa mejor en los labios y las membranas mucosas debido a que estas áreas no están sujetas a las condiciones ambientales, como un ambiente frío, que provocan cianosis periférica. Las personas con insuficiencia cardíaca derecha o izquierda pueden desarrollar cianosis, en especial alrededor de los labios y en las partes periféricas de las extremidades.
Arritmias y muerte cardíaca súbita
Tanto las arritmias auriculares como las ventriculares ocurren en personas con insuficiencia cardíaca. La fibrilación auricular es la arritmia más frecuente. Las manifestaciones clínicas relacionadas con fibrilación auricular se relacionan con la pérdida de la contracción auricular, taquicardia y frecuencia cardíaca irregular, y síntomas relacionados con una disminución de la presión arterial. También se cuenta con evidencia sólida de que las personas con insuficiencia cardíaca se encuentran en mayor riesgo de paro cardíaco súbito; es decir, muerte atestiguada o muerte que ocurre en un lapso de una hora posterior al inicio de los síntomas. En personas con disfunción ventricular, la muerte súbita es consecuencia con mayor frecuencia por taquicardia ventricular o fibrilación ventricular.
Diagnóstico y tratamiento
Diagnóstico
Los métodos diagnósticos para la insuficiencia cardíaca están dirigidos a establecer la causa del padecimiento y a determinar la extensión de la disfunción. Las directrices médicas para el diagnóstico y tratamiento se describen con claridad en las directrices médicas de AHA para el manejo de la insuficiencia cardíaca. Debido a que la insuficiencia cardíaca representa el fallo del corazón como bomba y puede ocurrir en la evolución de diversas enfermedades cardíacas u otras sistémicas, con frecuencia el diagnóstico de insuficiencia cardíaca se basa en signos y síntomas relacionados con un corazón insuficiente por sí mismo, como dificultad respiratoria y fatiga. La clasificación funcional de la New York Heart Association (NYHA) es una guía para clasificar la extensión de la disfunción.
La clasificación funcional de la NYHA cataloga la disfunción en 4 categorías:
- Clase I: personas que tienen cardiopatía conocida sin síntomas durante la actividad ordinaria.
- Clase II : personas que tienen cardiopatía y limitaciones leves, pero no fatiga extrema, palpitaciones, disnea o dolor anginoso durante la actividad regular.
- Clase III : personas con cardiopatía que se encuentran cómodas al reposo, pero la actividad ordinaria sí provoca fatiga, palpitaciones, disnea y dolor anginoso.
- Clase IV: personas que tienen cardiopatía marcada progresiva y que no se encuentran cómodas al reposo o a la actividad mínima.
Los métodos utilizados en el diagnóstico de insuficiencia cardíaca incluyen la valoración de los factores de riesgo, historia clínica y exploración física, estudios de laboratorio, electrocardiografía, radiografía torácica y ecocardiografía. La historia clínica debe incluir información relacionada con disnea, tos, nicturia, fatiga generalizada y otros signos y síntomas de insuficiencia cardíaca. La exploración física completa incluye la evaluación de la frecuencia cardíaca, ruidos cardíacos, presión arterial, venas yugulares en busca de congestión venosa, valoración pulmonar en busca de signos de congestión pulmonar y la evaluación de las extremidades para buscar edema. Los estudios de laboratorio se utilizan en el diagnóstico de anemia y desequilibrios electrolíticos, además de detectar signos de congestión hepática crónica. La medición de PNC y NT-proPNC puede ser útil si el diagnóstico de insuficiencia cardíaca es incierto y para estratificación del riesgo. El empleo de mediciones seriadas de las concentraciones de PNC o NT-proPNC aún no se ha establecido del todo.
La ecocardiografía tiene un papel clave en la valoración del movimiento de las paredes de los ventrículos (normal, acinesia o hipocinesia), el grosor de la pared, el tamaño de las cámaras ventriculares, la función valvular, defectos cardíacos, la fracción de eyección y cualquier enfermedad pericárdica. Los hallazgos electrocardiográficos pueden indicar hipertrofia auricular o ventricular, padecimientos subyacentes de la frecuencia cardíaca o anomalías de la conducción, como bloqueo de la ramificación derecha o izquierda del haz. La ventriculografía con radionúclidos y la angiografía cardíaca se recomiendan si hay alguna razón para sospechar cardiopatía coronaria como causa subyacente para la insuficiencia cardíaca. Las radiografías torácicas proporcionan información sobre el tamaño y forma del corazón y de la vasculatura pulmonar. La silueta cardíaca puede utilizarse para detectar hipertrofia y dilatación cardíacas. También pueden indicar la gravedad relativa de la insuficiencia al revelar si el edema pulmonar tiene predominio vascular o intersticial, o si ha avanzado a etapas alveolar y bronquial. La imagen por resonancia magnética (IRM) y la tomografía computarizada (TC) del corazón se utilizan para documentar la fracción de eyección, la precarga ventricular y el movimiento regional de la pared.
El monitoreo hemodinámico invasivo puede utilizarse para valorar episodios agudos de insuficiencia cardíaca que ponen en riesgo la vida. Estos métodos de monitoreo incluyen el monitoreo de la presión venosa central (PVC), de la presión de la arteria pulmonar, la medición por termodilución del gasto cardíaco y la medición intraarterial de la presión arterial. La PVC refleja la cantidad de sangre que regresa al corazón. Las mediciones de la PVC se obtienen mejor con el empleo de un catéter insertado en la aurícula derecha a través de una vena periférica o mediante un puerto (abertura) en la aurícula derecha en un catéter en la arteria pulmonar. Esta presión se encuentra disminuida en la hipovolemia e incrementada en la insuficiencia cardíaca derecha. Los cambios que ocurren en la PVC con el tiempo, por lo general, son más significativos que los valores numéricos absolutos obtenidos durante una sola medición.
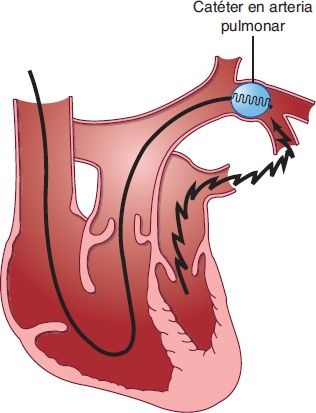
Las presiones y volúmenes ventriculares se obtienen mediante un catéter en la arteria pulmonar con un balón en la punta dirigido por el flujo. Este catéter se introduce a través de una vena central y luego se avanza hacia la aurícula derecha. El balón se infla con aire, lo cual permite al catéter flotar a través del ventrículo derecho hacia la arteria pulmonar hasta que se asienta en un vaso pulmonar pequeño (figura 34-7). Con el balón inflado, el catéter monitorea las presiones capilares pulmonares (también denominadas presiones capilares pulmonares en cuña [PCPC]), que se encuentran en comunicación directa con las presiones del corazón izquierdo. Las presiones capilares pulmonares proporcionan un medio para valorar la capacidad de bombeo del corazón izquierdo.
El monitoreo de la presión arterial intraarterial proporciona un medio para la vigilancia continua de la presión arterial. Se utiliza en personas con insuficiencia cardíaca aguda cuando se requiere tratamiento farmacológico intravenoso agresivo o un dispositivo auxiliar mecánico. Las mediciones se obtienen a través de un pequeño catéter insertado en una arteria periférica, por lo general, la arteria radial. El catéter se conecta a un transductor de presión y se registran las mediciones latido por latido de la presión arterial. El sistema de monitoreo muestra el contorno de la forma de onda de presión y las presiones sistólica, diastólica y arterial media, así como la frecuencia y ritmo cardíaco.
Tratamiento
Los objetivos del tratamiento están determinados por la rapidez de inicio y la gravedad de la insuficiencia cardíaca. Las personas con SICA requieren tratamiento urgente dirigido a estabilizar y corregir la causa de la disfunción cardíaca. Para personas con insuficiencia cardíaca crónica, los objetivos de tratamiento se dirigen a aliviar los síntomas, mejorar la calidad de vida y disminuir o eliminar los factores de riesgo (ej. hipertensión, diabetes, obesidad) con un objetivo a largo plazo de hacer más lenta, interrumpir o revertir la disfunción cardíaca.
Las medidas terapéuticas tanto para la insuficiencia cardíaca crónica como aguda incluyen estrategias no farmacológicas y farmacológicas. Los dispositivos de soporte mecánico, incluida la bomba con balón intraaórtico (para insuficiencia aguda) y el dispositivo auxiliar ventricular (DAV), sostienen la vida en personas con insuficiencia cardíaca grave. El trasplante cardíaco aún es el tratamiento de elección para numerosas personas con insuficiencia cardíaca en etapa terminal.
Métodos no farmacológicos
La intolerancia al ejercicio es típica en personas con insuficiencia cardíaca crónica. En consecuencia, el entrenamiento individualizado de actividad física es importante para maximizar el condicionamiento muscular. Las personas que no están acostumbradas a ejercitarse y aquellas con una insuficiencia cardíaca más grave inician con una menor intensidad y sesiones más breves que aquellas que casi se encuentran asintomáticas. La restricción de líquido y sodio, así como el manejo del peso, son importantes para todas las personas con insuficiencia cardíaca; el grado de restricción de sodio y líquido se individualiza según la gravedad de la insuficiencia cardíaca. La asesoría, la enseñanza en salud y los programas de evaluación en proceso ayudar a las personas con insuficiencia cardíaca a manejar y lidiar con su esquema terapéutico.
Tratamiento farmacológico
Una vez que la insuficiencia cardíaca es moderada o grave, el manejo farmacológico en conjunción con el no farmacológico es importante para prevenir y tratar la insuficiencia cardíaca aguda y manejar la insuficiencia cardíaca crónica. Los fármacos recomendados con base en la evidencia para el tratamiento y manejo incluyen los diuréticos, los inhibidores de ECA o los bloqueadores del receptor de angiotensina II, los bloqueadores β-adrenérgicos y digoxina. La selección de las opciones farmacológicas se basa en la sintomatología de la persona.
Los diuréticos se encuentran entre los medicamentos prescritos con mayor frecuencia para la insuficiencia cardíaca moderada o grave. Promueven la excreción de líquido y ayudan a mantener el gasto cardíaco y la perfusión de los tejidos mediante la disminución de la precarga y al permitir que el corazón opere en una región más óptima de la curva de Frank-Starling. Se utilizan los diuréticos de asa y las tiazidas. En urgencias, como en el edema pulmonar agudo, los diuréticos de asa como la furosemida pueden administrarse por vía intravenosa. Cuando se administra como infusión en bolo, furosemida intravenosa actúa en un lapso de minutos para incrementar la capacitancia venosa de tal manera que el gasto del ventrículo derecho y las presiones capilares pulmonares disminuyen.
Los inhibidores de ECA, que evitan la conversión de angiotensina I en angiotensina II, se han utilizado con eficacia en el tratamiento de la insuficiencia cardíaca crónica. El sistema renina-angiotensina-aldosterona se activa pronto en la evolución de la insuficiencia cardíaca y tiene un papel importante en su progresión. Ocasiona el incremento de angiotensina II, la cual provoca vasoconstricción, remodelación ventricular desregulada y producción incrementada de aldosterona con un aumento subsecuente de la retención de sodio y aguda por los riñones. Los inhibidores de ECA han demostrado limitar estas complicaciones deletéreas. Los bloqueadores del receptor de angiotensina II parecen tener efectos semejantes pero beneficiosos más limitados. Tienen la ventaja de no producir tos, la cual es un efecto colateral problemático de los inhibidores de ECA en numerosas personas. La aldosterona tiene diversos efectos lesivos en personas con insuficiencia cardíaca. Los antagonistas del receptor de aldosterona pueden utilizarse en combinación con otros fármacos para personas con insuficiencia cardíaca moderadamente grave o grave.
Los medicamentos bloqueadores de los receptores β-adrenérgicos se utilizan para disminuir la disfunción del ventrículo izquierdo relacionada con la activación del sistema nervioso simpático.
Estudios clínicos grandes han demostrado que el tratamiento a largo plazo con fármacos bloqueadores de los receptores β-adrenérgicos reduce la morbilidad y mortalidad en personas con insuficiencia cardíaca crónica. El mecanismo de este beneficio aún no está claro, pero es probable que el incremento crónico de las catecolaminas y la actividad del sistema nervioso simpático provoquen daño miocárdico progresivo, lo cual empeora la función del ventrículo izquierdo y da paso a un pronóstico peor en personas con insuficiencia cardíaca. Estudios clínicos fundamentales grandes en personas con insuficiencia cardíaca estable clase II y III de la NYHA han demostrado disminuciones significativas en la tasa de mortalidad global con el tratamiento basado en diversos fármacos bloqueadores de los receptores β-adrenérgicos.
Los digitálicos han sido un tratamiento reconocido para la insuficiencia cardíaca por más de 200 años. Las diversas formas de digitálicos se denominan glucósidos cardíacos. Mejoran la función cardíaca al incrementar la fuerza e intensidad de las contracciones ventriculares. Al disminuir la actividad del nódulo sinoauricular y reducir la conducción a través del nódulo auriculoventricular, también hacen más lenta la frecuencia cardíaca e incrementan el tiempo de llenado diastólico. A pesar de que no son diuréticos, los digitálicos promueven el gasto urinario al mejorar el gasto cardíaco y el flujo sanguíneo renal. El papel de los digitálicos en el tratamiento de la insuficiencia cardíaca se ha estudiado en estudios clínicos durante las últimas décadas. Los resultados de estos estudios permanecen controversiales y mixtos; parece haber un consenso creciente que, pese a que los digitálicos no necesariamente reducen las tasas de mortalidad, es posible que puedan prevenir el deterioro clínico y la hospitalización.
Los fármacos vasodilatadores no se han estudiado de manera extensa como un tratamiento único para el manejo de la insuficiencia cardíaca, pero pueden ser efectivos en el manejo de los síntomas.
Los medicamentos como el dinitrato de isosorbide y la hidralazina pueden agregarse a otros fármacos estándar para pacientes con insuficiencia cardíaca crónica. Los vasodilatadores como nitroglicerina, nitroprusiato y nesiritide (PN tipo B) se utilizan en SICA para mejorar el desempeño del corazón izquierdo mediante la disminución de la precarga (a través de la vasodilatación) o mediante la reducción de la poscarga (a través de la dilatación arteriolar), o ambas.
Terapia con oxígeno
El tratamiento con oxígeno incrementa el contenido de oxígeno en la sangre y se utiliza con mayor frecuencia en personas con episodios agudos de insuficiencia cardíaca. La presión positiva continua (PPC) en la vía respiratoria se recomienda para disminuir la necesidad de intubación endotraqueal en pacientes con SICA. Debido a que la PPC incrementa la presión intratorácica, también tiene el potencial para disminuir el retorno venoso y la precarga del ventrículo izquierdo, con lo cual mejora la fracción de eyección cardíaca y estabiliza el estado hemodinámico en personas con insuficiencia cardíaca grave. Algunos argumentan que la presión positiva binivel en la vía respiratoria (BiPAP, por sus siglas en inglés), la cual es parecida a la PPC pero además proporciona presiones más elevadas durante la inspiración, es superior a PPC, ya que disminuye la frecuencia respiratoria y la frecuencia cardíaca mientras mejora la oxigenación con mayor rapidez y de manera más sustancial que la PPC.
Resincronización cardíaca y cardioversores-desfibriladores implantables
Algunas personas con insuficiencia cardíaca tienen conducción intraventricular anómala que provoca contracciones disinrónicas e ineficaces. El tratamiento de resincronización cardíaca implica la colocación de un marcapasos en los ventrículos derecho e izquierdo como un medio para resincronizar la contracción de ambos. La resincronización cardíaca ha demostrado mejorar la función ventricular y la presión arterial, mejorar la calidad de vida y disminuir el riesgo de muerte.
Las personas con insuficiencia cardíaca se encuentran en riesgo significativo de muerte cardíaca súbita debida a fibrilación ventricular o taquicardia ventricular. La implantación de un cardioversor-desfibrilador se indica en pacientes selectos con insuficiencia cardíaca para prevenir la muerte cardíaca súbita. Un cardioversor-desfibrilador es un dispositivo implantable y programable que monitorea la frecuencia cardíaca. Tiene la capacidad de marcar el paso del corazón y aplica shocks eléctricos para terminar arritmias mortales cuando es necesario.
Soporte mecánico y trasplante cardíaco
La insuficiencia cardíaca refractaria refleja el deterioro de la función cardíaca que no responde a intervenciones medicamentosas ni quirúrgicas. Con los métodos terapéuticos mejorados, más personas alcanzan un punto en el que la cura es inalcanzable y la muerte es inminente sin soporte mecánico o trasplante cardíaco.
Desde inicios de la década de los 60, se ha logrado un progreso significativo en la mejora de la eficacia de DAV (dispositivos auxiliares ventriculares), que son bombas mecánicas para apoyar la función ventricular. Los DAV se utilizan para disminuir la carga de trabajo del miocardio mientras mantienen el gasto cardíaco y la presión arterial sistémica. Esto disminuye la carga de trabajo del ventrículo y le permite descansar y recuperarse. En el pasado, DAV requerían un procedimiento torácico abierto invasivo para su implantación, pero ahora no es menos invasivo. Pueden utilizarse en personas en quienes falla la derivación cardiopulmonar después de cirugía cardíaca o tienen dificultad para el destete de esta técnica, aquellos que desarrollan shock cardiogénico después de infarto de miocardio, personas con cardiomiopatía en etapa terminal y aquellos a la espera de un trasplante de corazón. El empleo más agresivo y temprano de DAV como puente hacia el trasplante y la terapia de destino (soporte permanente) ha demostrado incrementar la supervivencia. Los DAV que permiten al paciente movilizarse y manejarse en casa se utilizan en ocasiones para soporte a largo plazo o permanente como tratamiento para la insuficiencia cardíaca en etapa terminal, en lugar de emplearse como un simple puente hacia el trasplante. DAV pueden utilizarse para apoyar la función del ventrículo izquierdo, del derecho, o de ambos.
El trasplante cardíaco es el tratamiento preferido para personas con insuficiencia cardíaca en etapa terminal y, por lo demás, con una buena esperanza de vida. A pesar del éxito global del trasplante cardíaco, la disponibilidad de donadores aún es un problema clave y sólo se completan cerca de 5.000 procedimientos anuales mientras se niega el trasplante a miles cada año.
Otros tratamientos quirúrgicos novedosos en investigación incluyen la remodelación del ventrículo izquierdo. Esta técnica es un procedimiento quirúrgico diseñado para restaurar el tamaño y la forma del ventrículo y se piensa que es una alternativa quirúrgica viable al trasplante cardíaco para personas con disfunción grave del ventrículo izquierdo.