03. Trastornos tiroideos
Control de la función tiroidea
La glándula tiroides es una estructura con forma de escudo que se ubica justo por debajo de la laringe en la zona media de la cara anterior del cuello (figura 49-3A). Se compone de un gran número de estructuras minúsculas similares a sacos, que se denominan folículos (figura 49-3B). Éstos son las unidades funcionales de la tiroides. Cada folículo está constituido por una sola capa de células epiteliales (foliculares) y está lleno de una sustancia secretora denominada coloide, conformada en gran medida por un complejo de glucoproteína-yodo, denominado tiroglobulina.
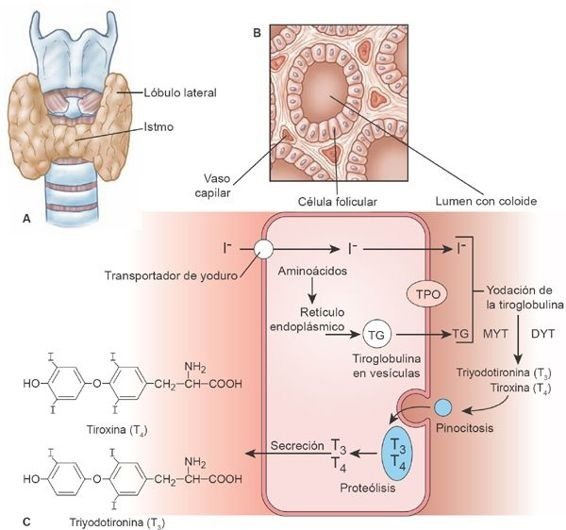
La tiroglobulina que ocupa los folículos tiroideos es una molécula glucoproteica grande que contiene 140 residuos de tirosina. En el proceso de la síntesis tiroidea, el yodo se une a estas moléculas de tirosina. Tanto la tiroglobulina como el yoduro se secretan hacia el coloide del folículo a partir de las células foliculares.
La tiroides tiene una eficiencia notable en torno a su empleo del yoduro. Se requiere una absorción diaria aproximada de 50 mg de yodo ingerido o alrededor de 1 mg/semana para sintetizar cantidades normales de hormona tiroidea. En el proceso de ser eliminado de la sangre y almacenado para empleo futuro, el yoduro se bombea hacia el interior de las células foliculares contra un gradiente de concentración. El yoduro (I−) se transporta a través de la membrana basal de las células tiroideas por medio de una proteína intrínseca a la membrana denominada simportador Na+/I (SNI).
En el borde apical, una segunda proteína transportadora de I− llamada pendrina moviliza al yodo hacia el coloide, donde participa en la hormonogénesis. El SNI obtiene su energía a partir de la Na+/K+/ATPasa, que conduce el proceso. Como resultado, la concentración de yoduro en la glándula tiroides normal se aproxima a 40 veces la correspondiente en la sangre.
El SNI recibe estimulación tanto de la HET como del anticuerpo estimulante del receptor de HET que se identifica en la enfermedad de Graves. La pendrina, que se encuentra codificada por el gen del síndrome de Pendred (SPD), es un transportador de cloruro y yoduro. Se han identificado mutaciones en el gen SPD en los pacientes con bocio y sordera congénita.
Una vez dentro del folículo, la mayor parte del yoduro se oxida por medio de la enzima tiroperoxidasa (TPO) en una reacción que facilita su combinación con una molécula de tirosina, para obtener monoyodotirosina (MYT) y luego diyodotirosina (DYT). Dos residuos de DYT se acoplan para constituir la tiroxina (T4), o bien, se enlazan una MYT y una DYT para obtener triyodotironina (T3). Sólo se liberan a la circulación T4 (90%) y T3 (10%; figura 49-3C). Existe evidencia de que la T3 es la forma activa de la hormona y de que la T4 se convierte en T3 antes de poder ejercer su acción fisiológica.
Las hormonas tiroideas se unen a la globulina de unión a tiroxina (GUT) y a otras proteínas del plasma para ser transportadas por la sangre. Sólo la hormona libre ingresa a las células y regula el mecanismo de retroalimentación hipofisario. La hormona tiroidea unida a proteínas constituye un reservorio grande que se utiliza con lentitud al tiempo que se requiere hormona tiroidea libre.
Existen 3 proteínas principales de unión a hormonas tiroideas: GUT, transtiretina (antes conocida como prealbúmina de unión a tiroxina [PAUT]) y albúmina. Más del 99% de la T4 y la T3 se transporta unido. La GUT transporta alrededor del 70% de la T4 y la T3 ; la transtiretina se une a alrededor del 10% de la T4 circulante y a cantidades menores de T3 ; y la albúmina se une a alrededor del 15% de la T4 y la T3 circulantes.
Distintas condiciones patológicas y fármacos farmacológicos pueden disminuir la cantidad de proteína de unión en el plasma o influir sobre la unión de la hormona. La insuficiencia congénita de GUT es un rasgo ligado al x que se presenta en 1 de cada 5.000 nacidos vivos. Los neonatos prematuros enfermos necesitan ser sometidos a detección mediante un perfil sérico tiroideo integral, con el objetivo de prevenir la omisión del diagnóstico de hipotiroidismo primario en los neonatos.
Los medicamentos glucocorticoides y la enfermedad sistémica, como la desnutrición proteica, el síndrome nefrótico y la cirrosis, disminuyen las concentraciones de GUT. Los medicamentos como la fenitoína, los salicilatos y el diazepam pueden afectar la conjunción de la hormona tiroidea a las proteínas de unión disponibles en concentración normal.La secreción de hormona tiroidea está regulada por el sistema de retroalimentación hipotálamo-hipófiso-tiroidal (figura 49-4). En este sistema, la hormona liberadora de tirotropina (HLT), que se sintetiza en el hipotálamo, controla la liberación de la HET a partir del lóbulo anterior de la hipófisis.
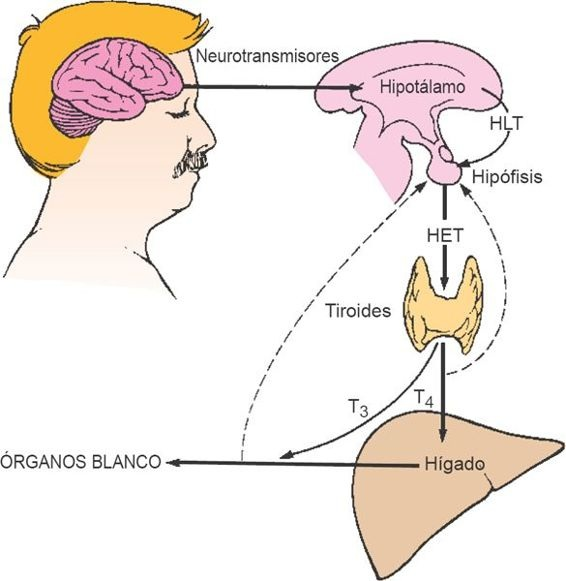
La HET incrementa la actividad general de la glándula tiroides al aumentar la degradación de la tiroglobulina y la liberación de las hormonas tiroideas a partir de los folículos hacia el torrente sanguíneo, activar la bomba de yoduro (al aumentar la actividad del SNI), intensificar la oxidación del yoduro y acoplar el yoduro a la tirosina, y a la vez aumentar el número y el tamaño de las células foliculares. El efecto de la HET sobre la liberación de las hormonas tiroideas se establece en el transcurso de alrededor de 30 min, pero los otros efectos requieren días o semanas para presentarse.
El aumento de las concentraciones de hormonas tiroideas participa en la inhibición mediante retroalimentación de la HLT o la HET. Las concentraciones altas de yoduro también inducen una disminución temporal de la actividad tiroidea, que dura varias semanas, quizá por medio de una inhibición directa de la HET sobre la tiroides. La exposición al frío es uno de los estímulos más fuertes para generar un incremento de la síntesis de hormonas tiroideas, que quizá se encuentra mediado por la HLT que deriva del hipotálamo. Distintas reacciones emocionales también pueden afectar la liberación de HLT y HET.
Acciones de las hormonas tiroideas
Las anomalías de las concentraciones de hormonas tiroideas afectan a todos los órganos importantes del cuerpo. Las hormonas tiroideas tienen 2 funciones principales: incrementar el metabolismo y la síntesis de proteínas, y respaldar el crecimiento y el desarrollo en los niños, lo que incluye el desarrollo mental y el alcance de la madurez sexual. Estas acciones se encuentran mediadas ante todo por la T3. En la célula, la T3 se une a un receptor nuclear, lo que da origen a la transcripción de genes de respuesta específicos a la hormona tiroidea.
Tasa metabólica
Las hormonas tiroideas incrementan el metabolismo de todos los tejidos corporales excepto la retina, el bazo, los testículos y los pulmones. La tasa metabólica basal puede incrementarse entre el 60% y el 100% respecto a lo normal cuando existen cantidades elevadas de T42. Como consecuencia de este metabolismo mayor, la tasa de consumo de glucosa, grasa y proteínas se incrementa. Los lípidos se movilizan a partir del tejido adiposo y aumenta el catabolismo del colesterol en el hígado. Las concentraciones hemáticas de colesterol disminuyen en el hipertiroidismo y aumentan en el hipotiroidismo. Las proteínas musculares se degradan y se utilizan como combustible, lo que quizá explique parte de la fatiga muscular que se observa en el hipertiroidismo. La absorción de glucosa en el tubo gastrointestinal aumenta.
Función cardiovascular
La función tiroidea tiene un efecto intenso sobre las funciones cardiovascular y respiratoria. Con un incremento en el metabolismo, existe elevación del consumo de oxígeno y de la obtención de productos metabólicos finales, con un aumento acompañante de la vasodilatación. El flujo sanguíneo hacia la piel, en particular, se incrementa como medio para disipar el calor corporal que se produce por la tasa metabólica mayor. Volumen sanguíneo, gasto cardíaco y ventilación se elevan como medio para mantener el flujo sanguíneo y la provisión de oxígeno a los tejidos corporales. La frecuencia cardíaca y la contractilidad del miocardio se incrementan como medio para mantener el gasto cardíaco requerido. La presión arterial tiene probabilidad demodificarse poco por efecto del aumento de la vasodilatación, que tiende a equilibrar el incremento del gasto cardíaco.
Función gastrointestinal
Las hormonas tiroideas aumentan la función gastrointestinal al generar un aumento de la motilidad y la producción de secreciones gastrointestinales que, con frecuencia, induce diarrea. Un aumento del apetito y del consumo de alimentos acompaña a la tasa metabólica más alta que se presenta ante el incremento de las concentraciones de hormonas tiroideas. Al mismo tiempo, se verifica una pérdida ponderal como consecuencia del aumento del consumo de calorías.
Efectos neuromusculares
La hormona tiroidea tiene efectos marcados sobre el control neural de la función y el tono musculares. Las elevaciones discretas de las concentraciones hormonales pueden hacer que los músculos esqueléticos reaccionen en forma más vigorosa, en tanto una caída de las concentraciones de hormonas hace que los músculos reaccionen con más lentitud. En el estado hipertiroideo, existe un temblor muscular fino. La causa del temblor se desconoce, pero pudiera corresponder a un aumento de la sensibilidad de las sinapsis neurales de la médula espinal que controlan el tono muscular. En el neonato y el lactante, las hormonas tiroideas son necesarias para el desarrollo normal del cerebro. Las hormonas favorecen la cerebración; en el estado hipertiroideo generan nerviosismo extremo, ansiedad y dificultad para dormir.
La evidencia sugiere una interacción intensa entre las hormonas tiroideas y el sistema nervioso simpático. Muchos de los signos y los síntomas del hipertiroidismo sugieren la hiperactividad de la división simpática del sistema nervioso autónomo, como la taquicardia, las palpitaciones y la diaforesis. Los temblores, la inquietud, la ansiedad y la diarrea también pueden reflejar desequilibrios del sistema nervioso autónomo. Los medicamentos que bloquean la actividad simpática han probado ser adyuvantes valiosos para el tratamiento del hipertiroidismo por efecto de su capacidad para aliviar algunos de estos síntomas indeseables.
Pruebas de función tiroidea
Distintas pruebas son de ayuda para el diagnóstico de los trastornos tiroideos. Las mediciones de T3, T4 y HET son posibles por medio de técnicas de inmunoensayo. La prueba de T4 libre mide la fracción libre de T4, que tiene independencia para ingresar a las células y generar sus efectos, y suele ser el primer valor de laboratorio que se obtiene. Las concentraciones de HET se utilizan paradiferenciar entre los trastornos tiroideos primarios y los secundarios. T3, T4 y concentraciones libres de T4 muestran disminución en el hipotiroidismo primario, en tanto la concentración de HET se eleva (figura 49-4). La valoración de los autoanticuerpos tiroideos (ej. anticuerpos contra TPO en la tiroiditis de Hashimoto) resulta importante en el proceso diagnóstico y para dar seguimiento subsecuente a los individuos con trastornos tiroideos.
La prueba de captación de yodo radioactivo (123I) mide la capacidad de la glándula tiroides para concentrar el yodo a partir de la sangre y retenerlo. Las gammagrafías tiroideas (123I, 99mTcpertecnectato) pueden utilizarse para detectar nódulos tiroideos y determinar la actividad funcional de la glándula tiroides. La ecografía puede aprovecharse para diferenciar las lesiones quísticas de las sólidas en la tiroides y los estudios de TC e IRM se utilizan para revelar la compresión de la tráquea o la presión ejercida sobre las estructuras vecinas. La biopsia mediante aspiración con aguja fina de un nódulo tiroideo ha probado ser el mejor método para diferenciar la tiroidopatía benigna de la maligna.
Alteraciones de la función tiroidea
Una alteración de la función tiroidea puede representar una condición hipofuncional o hiperfuncional. Las manifestaciones de estos 2 estados alterados se resumen en la tabla 49-3. Los trastornos de la tiroides pueden deberse a un defecto congénito del desarrollo de la tiroides o pueden desarrollarse en una fase posterior de la vida, con inicio gradual o súbito.
El bocio es un aumento del tamaño de la glándula tiroides (figura 49-5). Puede coincidir con estados de hipotiroidismo, eutiroidismo e hipertiroidismo. El bocio puede ser difuso, afectar a toda la glándula sin evidencia de nodularidad o puede contener nódulos. El bocio difuso suele convertirse en nodular. El bocio puede ser tóxico y generar signos de hipertiroidismo extremo, o tirotoxicosis, o puede no ser tóxico. Los bocios difusos no tóxicos y multinodulares derivan de la hipertrofia y la hiperplasia compensatorias del epitelio folicular por alguna anomalía que compromete la producción de hormonas tiroideas.
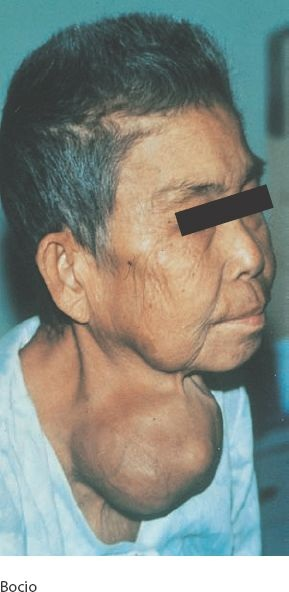
El grado de crecimiento de la tiroides suele ser proporcional al grado y la duración de la insuficiencia tiroidea. Los bocios multinodulares dan origen a los crecimientos tiroideos más intensos. Cuando alcanza un tamaño suficiente, el bocio puede comprimir el esófago y la tráquea, y generar dificultad para la deglución, una sensación de ahogamiento y estridor inspiratorio. Este tipo de lesiones también tiene capacidad para comprimir la vena cava superior, lo que produce distensión de las venas del cuello y las extremidades superiores, edema palpebral y conjuntival, y síncope al presentarse la tos.
Hipotiroidismo
El hipotiroidismo puede presentarse como un defecto congénito o adquirido. El hipotiroidismo congénito se desarrolla durante el período prenatal y ya existe en el momento de nacer. El hipotiroidismo adquirido se desarrolla por efecto de algún trastorno primario de la glándula tiroides, o puede ser secundario a un problema hipotalámico o hipofisario.
Hipotiroidismo congénito
El hipotiroidismo congénito es una causa frecuente de retraso mental prevenible. Afecta a alrededor de 1 de cada 4.000 neonatos. El hipotiroidismo en el neonato puede derivar de una carencia congénitade glándula tiroides, de anomalías de la biosíntesis de las hormonas tiroideas o de la secreción insuficiente de HET. Cuando existe ausencia congénita de glándula tiroides, el neonato suele parecer normal y tiene funciones normales al nacer debido a que las hormonas son provistas in utero por la madre.
Las hormonas tiroideas son esenciales para el crecimiento normal y el desarrollo cerebral, casi la mitad del cual ocurre durante los primeros 6 meses de vida. En caso de no recibir tratamiento, el hipotiroidismo congénito induce retraso mental y compromete el crecimiento físico. Las manifestaciones del hipotiroidismo congénito no tratado se conocen como cretinismo. Sin embargo, el término no aplica para el neonato con desarrollo normal en quien se instituye tratamiento de restitución con hormonas tiroideas poco después del nacimiento.
Por fortuna, se han instituido pruebas para detección neonatal con el objetivo de identificar el hipotiroidismo congénito durante el período neonatal temprano. La detección suele realizarse en el nido del hospital. En esta prueba se toma una gota de sangre del talón del neonato y se analiza para medir en ella T4 y HET.
El hipotiroidismo congénito transitorio se ha reconocido con más frecuencia desde la introducción de las pruebas de detección neonatales. Se caracteriza por concentraciones altas de HET y concentraciones normales o bajas de hormonas tiroideas. La tiroides del feto y el neonato son sensibles al exceso de yodo. El yodo atraviesa la placenta y las glándulas mamarias, y se absorbe con facilidad a través de la piel del neonato. El hipotiroidismo transitorio puede derivar de una exposición materna o neonatal a sustancias como la yodopovidona que se utiliza como desinfectante (ej. lavados vaginales o empleo como desinfectante cutáneo en el nido). Los medicamentos antitiroideos, como el propiltiouracilo y el metimazol, pueden atravesar la placenta e impedir la función de la tiroides fetal.
El hipotiroidismo congénito se maneja mediante restitución hormonal. La evidencia indica que es importante normalizar las concentraciones de T4 con tanta rapidez como sea posible debido a que el retraso se acompaña de un desarrollo psicomotor y mental más insuficiente. La dosificación se ajusta al tiempo que el niño crece. Cuando se siguen los regímenes de tratamiento tempranos y adecuados, riesgo de retraso mental en los niños identificados mediante programas de detección es en esencia nulo.
Hipotiroidismo adquirido y mixedema
El hipotiroidismo en niños mayores y adultos genera una disminución general de la velocidad de los procesos metabólicos, y mixedema. El mixedema implica la presencia de un tipo de edema mucoso que no genera godete y que deriva de la acumulación de una sustancia mucopolisacárida hidrofílica en los tejidos conectivos de todo el organismo. El estado hipotiroideo puede ser leve y sólo manifestar unos cuantos signos y síntomas, o puede avanzar hasta convertirse en una condición con desarrollo de angioedema que ponga en riesgo la vida.
Etiología y patogénesis
El hipotiroidismo adquirido puede ocurrir por la destrucción o de la disfunción de la glándula tiroides (es decir, hipotiroidismo primario), puede ser un trastorno secundario generado por una anomalía de la función hipofisaria, o bien, ser un trastorno terciario provocado por una disfunción hipotalámica.
El hipotiroidismo primario es mucho más frecuente que el secundario (y el terciario). Puede derivar de la tiroidectomía (es decir, extirpación quirúrgica de la tiroides) o la ablación de la glándula con radiación. Ciertos fármacos bociógenos, como el carbonato de litio (que se administra para el tratamiento de los estados maniacodepresivos) y los medicamentos antitiroideospropiltiouracilo y metimazol en dosificación continua, pueden bloquear la síntesis hormonal e inducir hipotiroidismo con bocio. Las dosis elevadas de yodo (ej. ingestión de tabletas de kelp o de jarabes para la tos que contienen yoduro, o bien la administración de medios de contraste radiológicos que contienen yoduro o el fármaco amiodarona de la clase III de los antiarrítmicos, que contiene 75 mg de yoduro en cada tableta de 200 mg) también pueden bloquear la producción de hormonas tiroideas e inducir bocio, en particular en individuos con tiroidopatía autoinmunitaria.
La insuficiencia de yodo, que puede inducir bocio e hipotiroidismo, es rara en Estados Unidos debido a la utilización generalizada de sal yodada y otras fuentes de yoduro. Sin embargo, se calcula que la insuficiencia de yodo afecta a 100 millones de personas en todo el mundo.
La causa más frecuente de hipotiroidismo es la tiroiditis de Hashimoto, un trastorno autoinmunitario en el que la glándula tiroides puede destruirse por completo por medio de un proceso inmunitario. Se trata de la etiología principal del bocio y el hipotiroidismo en niños y adultos. La tiroiditis de Hashimoto es ante todo una enfermedad de la mujer. La evolución de la enfermedad es variable. Al inicio, puede sólo existir bocio. Al avanzar el tiempo, el hipotiroidismo suele hacerse evidente. Si bien el trastorno suele inducir hipotiroidismo, puede desarrollarse un estado hipertiroideo en el período intermedio de la evolución de la enfermedad. El estado hipertiroideo transitorio se debe a la fuga de hormona tiroidea preformada a partir de las células dañadas en la glándula. La tiroiditis subaguda, que puede presentarse durante el período puerperal (tiroiditis puerperal), también puede inducir hipotiroidismo.
Manifestaciones clínicas
El hipotiroidismo puede afectar a casi todas las funciones corporales. Las manifestaciones del trastorno se relacionan en gran medida con 2 factores: el estado hipometabólico que deriva de la insuficiencia de hormonas tiroideas y la afectación mixedematosa de los tejidos corporales. El estado hipometabólico que se relaciona con el hipotiroidismo se caracteriza por un desarrollo gradual de debilidad y fatiga, una tendencia a la ganancia ponderal no obstante la pérdida del apetito e intolerancia al frío (figura 49-6).
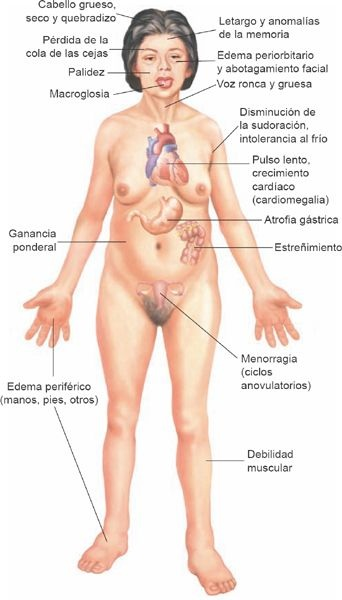
Al tiempo que el padecimiento avanza, la piel se seca y se vuelve áspera, y el pelo se hace grueso y quebradizo. La cara se vuelve rolliza y los párpados, edematosos, y se presenta adelgazamiento del tercio lateral de las cejas. La motilidad gastrointestinal disminuye, lo que genera estreñimiento, flatulencia y distensión abdominal. En ocasiones, se observan retraso de la relajación de los reflejos tendinosos profundos y bradicardia. La afectación del SNC se manifiesta por abotagamiento mental, letargo y alteraciones de la memoria.
Si bien el fluido mixedematoso suele ser más evidente en la cara, puede acumularse en los espacios intersticiales de casi cualquier estructura corporal y es responsable de muchas de las manifestaciones del estado hipotiroideo grave. La lengua con frecuencia aumenta su volumen y la voz se vuelve de tono bajo y ronca. Es frecuente identificar síndromes de atrapamiento como el del túnel del carpo y otros, al igual que compromiso de la función muscular, con rigidez, calambres y dolor. Los depósitos de mucopolisacárido en el corazón inducen dilatación cardíaca generalizada, bradicardia y otros signos de alteración de la función cardíaca. Los signos y los síntomas del hipotiroidismo se resumen en la tabla 49-3.
Diagnóstico y tratamiento
El diagnóstico del hipotiroidismo se basa en el interrogatorio clínico, la exploración física y los estudios de laboratorio. En el hipotiroidismo primario una característica es la presencia de concentraciones bajas de T4 y altas de HET en el suero. Deben solicitarse pruebas de anticuerpos antitiroideos si se sospecha tiroiditis de Hashimoto (con frecuencia se miden los títulosde anticuerpos contra TPO).
El hipotiroidismo se trata mediante tratamiento de restitución con preparaciones sintéticas de T3 o T4. La mayor parte de las personas recibe tratamiento con T4. Las concentraciones séricas de HET se utilizan para valorar si el tratamiento o de restitución con T4 es adecuado. Cuando se normaliza la concentración de HET, se considera que la dosis de T4 es satisfactoria (sólo en el caso del hipotiroidismo primario). Debe considerarse el empleo de una estrategia de «apuntar bajo y avanzar lento» para el tratamiento de los adultos mayores con hipotiroidismo por el riesgo de inducir síndromes coronarios agudos en individuos susceptibles. También es importante que las personas utilicen con constancia la formulación de T4 que se prescriba, de tal forma que sus valores de laboratorio representen en mejor manera su condición tiroidea. Así, si la persona utiliza productos genéricos de T4 o, de manera similar, productos con patente, deben mantenerse utilizando un mismo producto.
Coma mixedematoso
El coma mixedematoso es una expresión de fase terminal del hipotiroidismo que pone en riesgo la vida. Se caracteriza por la presencia de coma, hipotermia, colapso cardiovascular, hipoventilación y trastornos metabólicos graves, como hiponatremia, hipoglucemia y acidosis láctica. La fisiopatología del coma mixedematoso implica 3 aspectos principales:
- retención de dióxido de carbono e hipoxia,
- desequilibrio hídrico y electrolítico, y
- hipotermia.
La persona con hipotiroidismo grave no es capaz de metabolizar los sedantes, los analgésicos y los anestésicos, y puede acumular estos fármacos. La acumulación de estos fármacos puede precipitar el coma.
El tratamiento incluye un manejo agresivo de los factores precipitantes, tratamiento de apoyo, como el manejo de la condición cardiorrespiratoria, la hiponatremia y la hipoglucemia, y tratamiento de restitución tiroidea. En caso de que exista hipotermia, hay contraindicación para aplicar recalentamiento activo del organismo, puesto que puede inducir vasodilatación y colapso vascular. La prevención es preferible al tratamiento e implica prestar atención especial a las poblaciones de alto riesgo, como las mujeres con antecedente de tiroiditis de Hashimoto. Estas personas deben ser informadas en torno a los signos y los síntomas del hipotiroidismo grave y la necesidad de recibir tratamiento médico temprano.
Hipertiroidismo
La tirotoxicosis es el síndrome clínico que se produce cuando los tejidos se exponen a concentraciones altas de hormonas tiroideas circulantes.
Etiología y patogénesis
En la mayor parte de los casos, la tirotoxicosis se debe a la hiperactividad de la glándula tiroides, o hipertiroidismo. La causa más frecuente de hipotiroidismo es la enfermedad de Graves, que se acompaña de oftalmopatía (o dermatopatía) y bocio difuso. Otras causas de hipertiroidismo son el bocio multinodular, el adenoma tiroideo y la tiroiditis. Los fármacos que contienen yodo pueden inducir hipertiroidismo, al igual que hipotiroidismo. La crisis, o tormenta tiroidea, es una manifestación exagerada aguda de la condición tirotóxica.
Manifestaciones clínicas
Muchas de las manifestaciones del hipertiroidism∫o se relacionan con el aumento del consumo deoxígeno y la utilización de combustibles metabólicos asociados con el estado hipermetabólico, así como con la intensificación de la actividad del sistema nervioso simpático que tiene lugar. El hecho de que muchos de los signos y los síntomas del hipertiroidismo se asemejen a los de la actividad excesiva del sistema nervioso simpático sugiere que la hormona tiroidea puede incrementar la sensibilidad del organismo a las catecolaminas o que puede actuar como una seudocatecolamina. En el estado hipermetabólico es frecuente la referencia de nerviosismo, irritabilidad y tendencia a la fatiga (figura 49-7).
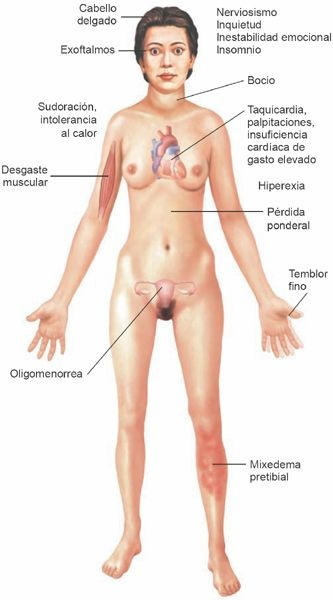
La pérdida ponderal es común, no obstante el gran apetito. Otras manifestaciones son taquicardia, palpitaciones, disnea, diaforesis excesiva, calambres musculares e intolerancia al calor. La persona parece inquieta y muestra temblor muscular fino. Incluso en individuos sin exoftalmos (es decir, protrusión de los globos oculares que se identifica en la oftalmopatía), existe una retracción anómala de los párpados y parpadeo infrecuente, de tal manera que parece haber una mirada fija. El pelo y la piel suelen ser delgados y tener textura sedosa. Alrededor del 15% de los adultos mayores con fibrilación auricular de inicio reciente cursa con tirotoxicosis. Los signos y los síntomas del hipertiroidismo se resumen en la tabla 49-3.
El tratamiento del hipertiroidismo se dirige a reducir la concentración de la hormona tiroidea. Esto puede lograrse mediante la eliminación de la glándula tiroides con yodo radiactivo por medio de la extirpación quirúrgica de parte o toda la glándula, o el consumo de fármacos que disminuyen la función tiroidea y también el efecto de las hormonas tiroideas sobre los tejidos periféricos. La ablación de la tiroides con yodo radiactivo se lleva a cabo con más frecuencia que la cirugía. Los medicamentos bloqueadores β-adrenérgicos (propranolol, metoprolol, atenolol y nadolol son los preferidos) se administran para bloquear los efectos del estado hipertiroideo sobre la función del sistema nervioso simpático. Se utilizan junto con fármacos antitiroideos, como el propiltiouracilo y el metimazol. Estos medicamentos impiden que la glándula tiroides convierta al yodo a su forma orgánica (hormonal) y bloquean la conversión de T4 en T3 en los tejidos (sólo el propiltiouracilo).
Enfermedad de Graves
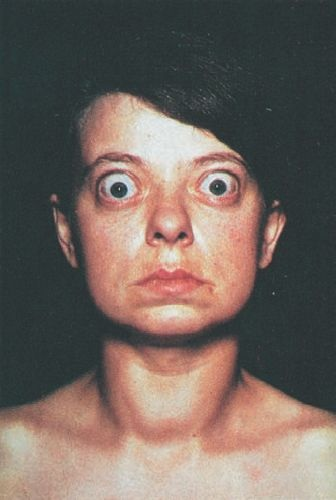
La enfermedad de Graves es un estado de hipertiroidismo, bocio y oftalmopatía. Suele desarrollarse entre los 20 y los 40 años de edad. Afecta a alrededor del 0,5% al 1% de la población menor de 40 años de edad. La enfermedad de Graves es un trastorno autoinmunitario que se caracteriza por una estimulación anómala de la glándula tiroides por la presencia de anticuerpos estimulantes de la tiroides (anticuerpos contra el receptor de HET), que actúan al interactuar con los receptores de HET normales. Puede relacionarse con otros trastornos autoinmunitarios, como la miastenia grave. La enfermedad se relaciona con los antígenos de cadena tipo A relacionados con la clase I del HCM (ACTA); los genotipos ACTA A5 se correlacionan con la enfermedad de Graves, en tanto los ACTA A6/A9 evitan su presentación.
Se piensa que la oftalmopatía, que ocurre hasta en una tercera parte de los individuos con enfermedad de Graves, deriva de la acumulación de linfocitos T sensibilizados contra los antígenos distribuidos a lo largo de las células foliculares de la tiroides y los fibroblastos solitarios que secretan citocinas. La oftalmopatía de la enfermedad de Graves puede inducir problemas oculares graves, como el desgarramiento de los músculos extraoculares, lo que genera diplopía; la afectación del nervio óptico, con cierto grado de pérdida visual; y la ulceración corneal como consecuencia de la incapacidad para el cierre palpebral por encima del globo ocular que protruye (por el exoftalmos). La oftalmopatía suele tender a estabilizarse una vez que el hipertiroidismo recibetratamiento. Sin embargo, puede empeorar en forma aguda tras el manejo con yodo radiactivo.
Algunos médicos prescriben glucocorticoides durante las semanas próximas al tratamiento con yodo radiactivo cuando el paciente presenta signos de oftalmopatía. La oftalmopatía también puede agravarse con el tabaquismo, que debe desalentarse con intensidad. La figura 49-8 muestra a una mujer con enfermedad de Graves.
Tormenta tiroidea
La tormenta tiroidea, o crisis tirotóxica, es una variante extrema de tirotoxicosis que pone en riesgo la vida y rara vez se identifica en la actualidad por efecto del mejoramiento del diagnóstico y las estrategias terapéuticas. Cuando ocurre, se identifica con más frecuencia en pacientes sin diagnóstico o en personas con hipertiroidismo que no han recibido un tratamiento adecuado. Con frecuencia se precipita con el estrés, como en el caso de la infección, el trauma físico o emocional, o por la manipulación de la glándula tiroidea hiperactiva durante la tiroidectomía. La tormenta tiroidea se manifiesta por fiebre muy elevada, efectos cardiovasculares extremos (es decir, taquicardia, insuficiencia congestiva y angina) y efectos graves en el SNC (es decir, agitación, inquietud y delirio). Su tasa de mortalidad es alta.
La tormenta tiroidea requiere el establecimiento rápido de su diagnóstico y tratamiento. Al inicio, debe lograrse la estabilidad hemodinámica en la persona. Las hormonas tiroideas pueden retirarse del plasma mediante aféresis, diálisis o adsorción mediante hemoperfusión. Se inicia el enfriamiento periférico utilizando bolsas frías y un colchón para enfriamiento. Para que elenfriamiento sea efectivo, debe impedirse la respuesta de tiriteo. Las medidas de apoyo generales para restitución de líquidos, glucosa y electrolitos resultan esenciales en tanto exista el estado hipermetabólico. Se administra un medicamento bloqueador β-adrenérgico, como el propranolol, para bloquear los efectos indeseables de la T4 sobre la función cardiovascular. Los glucocorticoides se utilizan para corregir la insuficiencia suprarrenal relativa que deriva del estrés impuesto por el estado hipertiroideo, y para inhibir la conversión periférica de T4 en T3. Puede administrarse propiltiouracilo o metimazol para bloquear la síntesis tiroidea. El ácido acetilsalicílico incrementa la concentración de las hormonas tiroideas libres al desplazarlas de sus proteínas portadoras y no debe administrarse durante una tormenta tiroidea.