02. Trastornos de la circulación arterial
El sistema arterial distribuye sangre a todos los tejidos del cuerpo. Existen 3 tipos de arterias: arterias grandes elásticas, incluida la aorta y sus ramas distales; arterias de tamaño mediano, como las coronarias y las renales; y arterias pequeñas y arteriolas que pasan por los tejidos. La función principal de las arterias grandes es el transporte de sangre. Las arterias de tamaño mediano están formadas sobre todo por CML dispuestas en forma circular y espiral; la distribución del flujo sanguíneo a los diversos órganos y tejidos del cuerpo está controlada por la contracción y relajación del músculo liso de estos vasos. Las arterias pequeñas y arteriolas regulan el flujo sanguíneo capilar. Los distintos procesos patológicos tienden a afectar a alguno de estos tipos distintos de arterias.
La enfermedad del sistema arterial afecta la función corporal porque altera el flujo sanguíneo. El efecto del flujo sanguíneo anómalo depende de las estructuras afectadas y la extensión del compromiso del flujo. El término isquemia denota una reducción en el flujo arterial hasta un nivel insuficiente para cubrir las demandas tisulares de oxígeno. Infarto se refiere a una zona de necrosis isquémica en un órgano causado por la oclusión de su suministro arterial o su drenaje venoso. La discusión de esta sección se enfoca en los lípidos sanguíneos y en la hipercolesterolemia, ateroesclerosis, vasculitis, enfermedad arterial de las extremidades y aneurismas arteriales.
Hiperlipidemia
La hiperlipidemia es un exceso de lípidos en la sangre. Los lípidos se clasifican como triglicéridos o grasa neutra, fosfolípidos y colesterol. Conforman un grupo diverso de compuestos con muchas funciones biológicas clave. Los triglicéridos, que se utilizan en el metabolismo energético, son combinaciones de ácidos grasos libres condensados con una sola molécula de glicerol. Los fosfolípidos, que contienen un grupo fosfato, son elementos estructurales importantes de las lipoproteínas, factores de coagulación sanguínea, la vaina de mielina y las membranas celulares. Aunque el colesterol no está compuesto de ácidos grasos, su núcleo esteroide se sintetiza a partir de ácidos grasos, por lo que su actividad química y física es similar a la de otros lípidos.
Las concentraciones altas de colesterol sanguíneo (hipercolesterolemia) participan en el desarrollo de la ateroesclerosis, con el riesgo que conlleva de infarto cardíaco y accidente cerebrovascular. Éste es un gran problema de salud pública, lo que se demuestra con las estadísticas publicadas por la American Heart Association (AHA). Se calcula que 102,2 millones de estadounidenses tiene una cifra de colesterol sérico mayor de 200 mg/dl y 37,7 millones de ellos tienen concentraciones de colesterol de alto riesgo (240 mg/dl o más) que podrían contribuir a un infarto de miocardio, accidente cerebrovascular u otro accidente cardiovascular relacionado con la ateroesclerosis.
Clasificación de las lipoproteínas
Como el colesterol y los triglicéridos son insolubles en el plasma, están encapsulados en una cubierta estabilizadora de fosfolípidos y proteínas hidrosolubles (llamadas apolipoproteínas). Estas partículas, denominadas lipoproteínas, transportan colesterol y triglicéridos a varios tejidos para que se utilicen como fuente de energía, depósito de lípidos, síntesis de hormonas esteroideas y formación de ácido biliar.
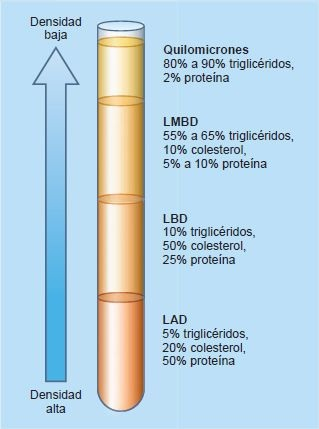
Existen 5 tipos de lipoproteínas, clasificados con base en su densidad medida por ultracentrifugación: quilomicrones, lipoproteína de muy baja densidad (LMBD), lipoproteína de densidad intermedia (LDI), lipoproteína de baja densidad (LBD) y lipoproteína de alta densidad (LAD).
Los quilomicrones aparecen en la sangre alrededor de una hora después de una comida y transportan sobre todo triglicéridos, aunque también una pequeña cantidad de fosfolípidos, colesterol y apoproteína B6. La LMBD transporta grandes cantidades de triglicéridos, que tienen menor densidad que el colesterol. La LBD es la principal transportadora de colesterol, mientras que la LAD en realidad contiene el 50% de proteína (figura 30-3).
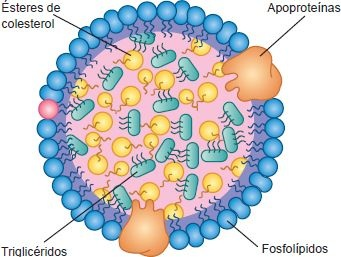
Cada tipo de lipoproteína consiste en un complejo molecular grande de lípidos combinados con apoproteínas. Los principales constituyentes lipídicos son ésteres de colesterol, triglicéridos, colesterol no esterificado (o libre) y fosfolípidos. Los ésteres de colesterol y triglicéridos insolubles se sitúan en el centro hidrófobo de la macromolécula de lipoproteína, rodeados por los fosfolípidos, colesterol no esterificado y apoproteínas solubles (figura 30-4). El colesterol no esterificado y los fosfolípidos proporcionan una carga negativa que permite que la lipoproteína sea soluble en el plasma.
Existen 4 tipos principales de apoproteínas: A (apoA- I, apoA- II y apoA- IV ), B (apoB-48, apoB-100), C (apoC- I, apoC- II y apoC- III ) y E (apoE).
Las apoproteínas controlan las interacciones y el destino metabólico final de las lipoproteínas. Algunas apoproteínas activan enzimas lipolíticas que facilitan la separación de lípidos de las lipoproteínas. Otros sirven como sitio reactivo que reconocen los receptores celulares, así participan en la endocitosis y metabolismo de las lipoproteínas. La principal apoproteína de la LBD es apoB-100, mientras que la de LAD es la apoA-i. Los hallazgos de la investigación sugieren que los defectos genéticos en las apoproteínas participan en la hiperlipidemia y ateroesclerosis acelerada.
Las lipoproteínas se sintetizan en 2 sitios: el intestino delgado y el hígado. Los quilomicrones, que son las moléculas de lipoproteína más grandes, se forman en la pared del intestino delgado. Participan en el transporte de los triglicéridos y colesterol dietéticos (vía exógena) que seabsorbieron en el tubo digestivo. Los quilomicrones transfieren sus triglicéridos a las células del tejido adiposo y muscular esquelético. El colesterol permanece en las partículas remanentes del quilomicrón después del retiro de los triglicéridos. Al final, el colesterol residual es captado por el hígado, que lo utiliza en la producción de LMBD o lo excreta en la bilis.
El hígado sintetiza y libera LMBD y LBD. La LMBD contiene grandes cantidades de triglicéridos y menores cantidades de ésteres de colesterol. Son el principal mecanismo para el transporte de los triglicéridos endógenos producidos en el hígado, a diferencia de los obtenidos en la dieta. También son la principal fuente corporal de energía durante el ayuno prolongado. Como los quilomicrones, las partículas de LMBD transportan los triglicéridos a las células adiposas y musculares, donde se desprenden de los triglicéridos. Los fragmentos de LDI resultantes tienen bajo contenido de triglicérido y quedan enriquecidos con colesterol. Son captados por el hígado y se reciclan para formar LMBD o convertirse en LBD en el compartimiento vascular. La LDI es la principal fuente de LBD (figura 30-5).
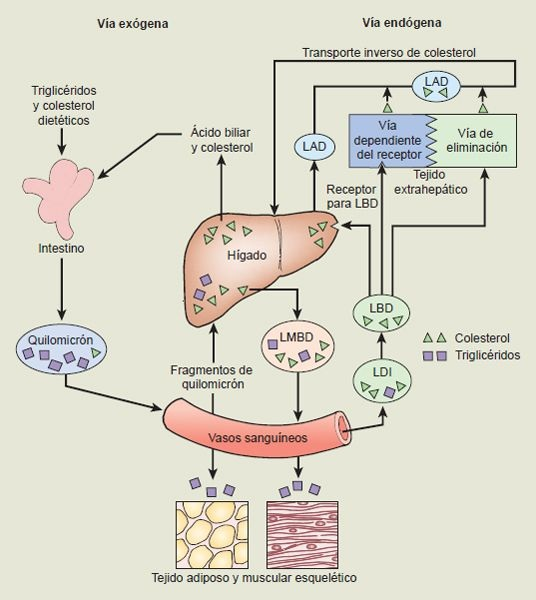
La LBD en ocasiones se llama colesterol nocivo y es el principal transportador de colesterol. La LBD es retirada de la circulación por los receptores para LBD o por células eliminadoras, como los monocitos o macrófagos. Cerca del 70% de la LBD se elimina mediante la vía dependiente del receptor para LBD, el resto por la vía de los eliminadores. Aunque los receptores para LBD tienen una distribución amplia, casi el 75% se localiza en los hepatocitos. Por lo tanto, el hígado tiene un papel crucial en el metabolismo de la LBD. La eliminación mediada por el receptor para LBD implica la unión de LBD con los receptores de la superficie celular que después permite la endocitosis, un proceso fagocítico en el que la LBD es rodeada e introducida a la célula dentro de una vesícula endocítica cubierta por membrana. Dentro de la célula, las vesículas endocíticas se fusionan con los lisosomas y la molécula de LBD se degrada mediante enzimas, lo que permite la salida de colesterol libre al citoplasma.
Otros tejidos no hepáticos (ej. glándulas suprarrenales, CML, células endoteliales y células linfoides) también utilizan la vía dependiente del receptor para LBD a fin de obtener el colesterol necesario para la membrana y la síntesis de hormonas. Estos tejidos pueden controlar su ingreso de colesterol mediante la adición o retiro de receptores para LBD. La vía eliminadora ocurre mediante ingestión en los monocitos y macrófagos fagocíticos. Estas células eliminadoras tienen receptores que se unen con la LBD oxidada o que tiene modificaciones químicas. La cantidad de LBD que se elimina por esta vía mantiene relación directa con la concentración plasmática de colesterol. Cuando disminuyen los receptores para LBD o cuando la concentración de LBD rebasa la disponibilidad de receptores, la cantidad de LBD que se desecha mediante las células eliminadoras aumenta mucho. La captación de LBD por los macrófagos de la pared arterial puede conducir a la acumulación de ésteres de colesterol insolubles, formación de células espumosas y desarrollo de ateroesclerosis.
La LAD se sintetiza en el hígado y a menudo se conoce como colesterol beneficioso. La LAD participa en el transporte inverso de colesterol porque lo traslada de los tejidos periféricos al hígado.
Los estudios epidemiológicos muestran una relación inversa entre la concentración de LAD y el desarrollo de ateroesclerosis. Se cree que la LAD, que es pobre en colesterol y rico en fosfolípidos superficiales, facilita la eliminación de colesterol de la periferia (incluidas placas ateromatosas) y lo transporta al hígado, donde puede excretarse, en lugar de reutilizarse en la producción de LMBD (transporte inverso de colesterol).
El mecanismo por el que la LAD favorece el desplazamiento del colesterol de las células periféricas a la LAD insuficiente en colesterol incluye un tipo de transportador especializado, los transportadores casete de unión con ATP (ABCA1 y ABCG1). Estos transportadores tienen un papel central en los efectos antiinflamatorios de la LAD. Los defectos en este sistema (derivado de mutaciones en el transportador ABCA1) son la causa de la enfermedad de Tangier, caracterizada por ateroesclerosis acelerada e insuficiencia o ausencia de LAD. También se cree que la LAD inhibe la captación celular de LBD al disminuir la oxidación, lo que previene la captación de LBD oxidada mediante los receptores eliminadores en los macrófagos. Se ha observado que el ejercicio regular, el consumo moderado de alcohol y ciertos medicamentos aumentan la concentración de LAD, mientras que el tabaquismo y el síndrome metabólico se relacionan con cifras bajas de LAD.
Etiología y patogénesis de la hiperlipidemia
La concentración sérica de colesterol puede elevarse como resultado del aumento en cualquiera de las lipoproteínas: quilomicrones, LMBD, IDL, LBD o LAD. El sistema de clasificación de hiperlipidemia utilizado a menudo se basa en el tipo de lipoproteína alterado. Varios factores pueden elevar las cifras de lípidos sanguíneos, como la nutrición, factores genéticos, medicamentos, trastornos concurrentes y enfermedades metabólicas. Es probable que mayoría de los casos de colesterol elevado sea multifactorial. Algunas personas tienen una mayor sensibilidad al colesterol dietético, otras tienen falta de receptores para LBD y otros más tienen alteraciones en la síntesis de apoproteínas, incluida la síntesis excesiva de apoB-100, la principal apoproteína de la LBD.
La hipercolesterolemia (hiperlipoproteinemia) puede clasificarse como primaria o secundaria. La hipercolesterolemia primaria es el incremento en la concentración de colesterol independiente deotros problemas de salud o del estilo de vida, mientras que la hipercolesterolemia secundaria se relaciona con otros problemas de salud y conductas.
Muchos tipos de hipercolesterolemia primaria tienen base genética. Es posible que haya un defecto en la síntesis de apoproteínas, falta de receptores, receptores defectuosos o defectos de origen genético en el manejo celular del colesterol. Por ejemplo, los receptores para LBD son defectuosos o insuficientes en el trastorno genético conocido como hipercolesterolemia familiar (tipo 2A). Esta hiperlipoproteinemia autosómica dominante es resultado de una mutación en el gen del receptor para LBD. Como la mayoría del colesterol circulante se elimina por mecanismos dependientes del receptor, las personas con este trastorno tienen una concentración sanguínea de colesterol muy alta. Es probable que éste sea uno de los trastornos mendelianos más frecuentes.
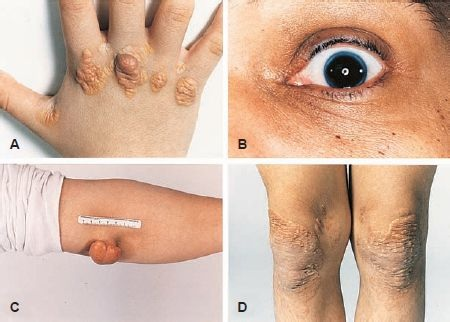
La cifra de LBD plasmática en personas con la forma heterocigótica de la enfermedad varía entre 250 mg/dl y 500 mg/dl. Sin embargo, en los individuos con la forma homocigótica, el colesterol LBD llega hasta 1.000 mg/dl. Aunque las personas con la forma heterocigótica de la enfermedad a menudo tienen el colesterol elevado desde el nacimiento, no tienen manifestaciones hasta la vida adulta, cuando a menudo desarrollan xantomas (depósitos de colesterol) sobre los tendones y aparece la ateroesclerosis (figura 30-6). En esta población se producen infartos de miocardio, pero a una edad mayor (40 a 45 años de edad en varones) que en las personas con la forma homocigótica de la enfermedad. El compromiso es mucho más grave en los que tienen la forma homocigótica; desarrollan xantomas cutáneos en la infancia y pueden sufrir un infarto de miocardio a edad temprana.
Las causas de la hiperlipoproteinemia secundaria incluyen obesidad con consumo calórico excesivo y diabetes mellitus. Las dietas altas en calorías aumentan la producción de LMDB, con aumento de los triglicéridos y conversión intensa de LMDB a LBD. La ingestión excesiva de colesterol reduce la formación de receptores para LBD, lo que disminuye la eliminación de esta lipoproteína. Las dietas ricas en triglicéridos y grasas saturadas aumentan la síntesis de colesterol y suprimen la actividad del receptor para LBD.
En la diabetes mellitus y el síndrome metabólico se observa dislipidemia típica, con aumento de triglicéridos, LAD baja e incremento mínimo o modesto de LBD. Otros trastornos sistémicosque pueden elevar los lípidos incluyen el hipotiroidismo, síndrome nefrótico y enfermedad hepática obstructiva. Los medicamentos como los β-bloqueadores, estrógenos e inhibidores de la proteasa (utilizados en la infección por el virus de inmunodeficiencia humana [VIH]) también elevan las cifras de lípidos.
Diagnóstico de hiperlipidemia
El Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults incluye un sistema de clasificación para la hiperlipidemia que describe las cifras óptimas a muy altas de colesterol LBD, los niveles deseables a elevados de colesterol total y las cifras bajas y altas de colesterol LAD. El NCEP recomienda que a todos los adultos de 20 años de edad y más se les practique un perfil de lipoproteínas en ayuno (colesterol total, colesterol LBD, colesterol LAD y triglicéridos) una vez cada 5 años. Los intervalos normales pueden encontrarse en el sitio de internet del NCEP. Si la prueba no se hace en ayuno, sólo el colesterol total y la LAD se consideran útiles. Debe obtenerse un perfil de lipoproteínas de seguimiento a las personas con cifras de colesterol total no en ayuno de 200 mg/dl o más, o con cifras de LAD menores de 40 mg/dl. Las mediciones de lipoproteínas son muy importantes en personas con riesgo alto de cardiopatía coronaria (CPC), ya que la hiperlipidemia tiene pocas o ninguna manifestación clínica.
Tratamiento de la hiperlipidemia
El NCEP aún establece el descenso del colesterol LBD como el objetivo principal para el tratamiento reductor de lípidos, sobre todo en personas con riesgo de CPC. Los principales factores de riesgo mayores para CPC, exclusivos de la concentración de colesterol LBD, y que modifican los objetivos para el colesterol LBD incluyen tabaquismo, hipertensión, antecedente familiar de CPC prematura en un familiar en primer grado, edad (varones ≥45 años; mujeres ≥55 años) y concentración de colesterol LAD menor de 40 mg/dl. Por consiguiente, el NCEP actualizó las directrices de 2001 para el tratamiento del colesterol LBD con base en los factores de riesgo.
Las directrices actualizadas recomiendan que las personas con ninguno o algún de riesgo mayor deben establecer un objetivo para el colesterol LBD de 160 mg/dl o menos; los que tienen 2 o más factores de riesgo mayores deben tener un objetivo para colesterol LBD menor de 130 mg/dl, para las personas con factores de alto riesgo (o sea, aquellos con CPC, otras formas de enfermedad ateroesclerótica o diabetes) el objetivo del colesterol LBD debe ser menor de 70 mg/dl. Las directrices también recomiendan que los individuos con un riesgo a 10 años mayor del 20% de experimentar un infarto de miocardio o muerte coronaria, según la herramienta de valoración de riesgo desarrollada con los datos del Framingham Heart Study, deben tener un objetivo para colesterol LBD menor de 100 mg/dl.
El tratamiento de la hipercolesterolemia se enfoca en los cambios dietéticos y cambios terapéuticos en el estilo de vida; cuando éstos resultan infructuosos, quizá sea necesario el tratamiento farmacológico. Los cambios terapéuticos en el estilo de vida incluyen mayor énfasis en la actividad física, medidas en la dieta para reducir el colesterol LBD, eliminación del tabaquismo y reducción de peso para las personas con sobrepeso.
Varios elementos dietéticos influyen en el colesterol y sus fracciones de lipoproteínas:
- consumo calórico excesivo,
- grasas saturadas y trans,
- colesterol.
Las calorías excesivas siempre reducen la LAD y elevan la LBD de manera menos consistente. Las grasas saturadas de la dieta influyen mucho en la concentración de colesterol. Cada 1% del consumo calórico en forma de grasa saturada aumenta el colesterol en 2,8 mg/dl, en promedio. Según las diferencias individuales, eleva la LMBD y la LBD. Las grasas trans, que se producen a partir de los aceites vegetales y se utilizan para intensificar el sabor y prolongar la vida de anaquel de las comidas rápidas, tienen mayor efecto aterógeno que las grasas saturadas. El colesterol dietético tiende a incrementar el colesterol LBD. En promedio, cada 100 mg de colesterol ingerido eleva 8 a 10 mg/dl el colesterol sérico.
El objetivo del tratamiento dietético es reducir las cifras de colesterol total y LBD, y aumentar el colesterol LAD mediante la disminución del total de calorías y el porcentaje de calorías derivadas de la grasa saturada y el colesterol. La AHA publicó nuevas directrices dietéticas que se enfocan en un plan integral de elecciones alimentarias saludables y aumento en la actividad física para disminuir el riesgo de enfermedad cardiovascular (ECV).
Las directrices específicos pretenden ayudar al público general a mantener un índice de masa corporal menor de 25 (peso en kilogramos dividido entre la superficie corporal total en metros cuadrados) para alcanzar y mantener cifras bajas de colesterol total y LBD, y un nivel alto de LBAD, además de conservar una presión arterial en límites normales. En general, las directrices en la dieta hacen énfasis en el mayor consumo de frutas, verduras y pescado, y reducción en el consumo de grasa, colesterol, azúcares, alcohol y sal. Para personas que ya tienen cifras altas de LBD, la AHA recomienda limitar la grasa saturada a menos del 7% de la ingestión diaria total, las grasas trans a menos del 1% del consumo diario total y el colesterol a menos de 300 mg/día. Sin embargo, incluso con la observancia estricta de la dieta, casi siempre es necesario el tratamiento farmacológico. Los datos clínicos sugieren que el tratamiento médico puede ser eficaz incluso para aquellos con colesterol LBD normal, ya que algunos efectos protectores cardíacos de las estatinas no se relacionan sólo con la disminución de la LBD, sino con sus efectos anti-inflamatorios.
Los fármacos hipolipémicos actúan de varias maneras: descenso en la síntesis de colesterol, decremento de la absorción intestinal de colesterol y eliminación del colesterol de la corriente sanguínea. Los fármacos que actúan de manera directa para reducir la concentración de colesterol también tienen el efecto provechoso de disminuir más las cifras de colesterol mediante el estímulo de la creación de más receptores para LBD. A menos que los lípidos estén muy elevados, se recomienda un tratamiento dietético intensivo por un mínimo de 3 meses antes de considerar los fármacos. Sin embargo, ciertos grupos de alto riesgo (ej. personas con diabetes, cuyo riesgo cardiovascular es mayor) ahora inician el tratamiento con estatina al mismo tiempo que los cambios terapéuticos en el estilo de vida.
En la actualidad existen 5 tipos de medicamentos para tratar la hipercolesterolemia:
- inhibidores de la HMG CoA reductasa (estatinas),
- resinas de unión con ácido biliar,
- inhibidores de la absorción de colesterol,
- niacina y
- los fibratos.
Los inhibidores de la HMG CoA reductasa (ej. atorvastatina, rosuvastatina, simvastatina), una enzima clave en la vía biosintética del colesterol, pueden reducir o bloquear la síntesis hepática de colesterol y son la piedra angular para el tratamiento reductor de LBD. Las estatinas también reducen la concentración de triglicéridos y aumentan la de LAD. Está demostrado que las estatinas reducen el riesgo de síndromes coronarios agudos y accidente cerebrovascular en la prevención secundaria.
Las resinas de unión con ácido biliar (ej. colestiramina, colestipol, colesevelam) se unen y secuestran en el intestino a los ácidos biliares que contiene colesterol. Esto disminuye la producción de receptores para LBD en el hígado, con el aumento consecuente en la eliminación del colesterol sanguíneo para la síntesis de nuevos ácidos biliares. Estos fármacos casi siempre se utilizan como auxiliares de las estatinas en pacientes que requieren un mayor descenso en la LBD y un aumento del 3% al 5% en el colesterol LAD.
El ácido nicotínico, un congénere de la niacina, bloquea la síntesis y liberación hepática deLMBD, lo que no sólo reduce la concentración de LMBD, sino también la de LDI y LBD. El ácido nicotínico también aumenta la concentración de LAD hasta en 15% a 35%. Los fibratos (ej. fenofibrato y gemfibrozilo) también disminuyen la síntesis hepática de LMBD, pero además intensifican la eliminación de triglicéridos de la circulación, lo que reduce el nivel de triglicéridos en 20% a 50%.
Ateroesclerosis
La ateroesclerosis es un tipo de arterioesclerosis o endurecimiento de las arterias. El término ateroesclerosis, que deriva del griego atheros («avena» o «pasta») y sclerosis («dureza»), denota la formación de lesiones fibroadiposas en la íntima de las arterias grandes y medianas, como la aorta y sus ramas, las arterias coronarias y las arterias grandes que irrigan el cerebro (figura 30-7).
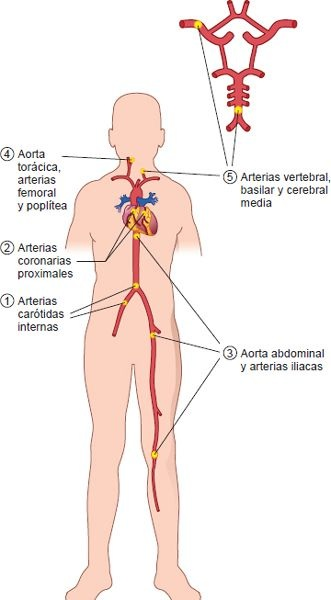
Aunque ha habido un descenso gradual en la mortalidad por ateroesclerosis en las últimas décadas, una complicación de ésta, la ECV, se mantiene como la principal causa de muerte entre varones y mujeres en Estados Unidos. Es probable que el descenso reportado en la tasa de mortalidad refleje los nuevos y mejores recursos terapéuticos y las mejores prácticas de atención a la salud, consecuencia de una mayor conciencia pública sobre los factores que predisponen al desarrollo de este trastorno. En 2011, las principales complicaciones de la ateroesclerosis, que incluyen cardiopatía isquémica, accidente cerebrovascular y enfermedad vascular periférica, causaron cerca del 33,6% de las muertes en Estados Unidos.
La ateroesclerosis comienza como un proceso insidioso y las manifestaciones clínicas de la enfermedad casi nunca aparecen hasta 20 o 40 años más tarde. Las placas fibrosas a menudo empiezan a formarse en las arterias de los estadounidenses en su tercera década de vida.
Etiología y factores de riesgo
Los principales factores de riesgo para la ateroesclerosis es la hipercolesterolemia, que puede modificarse. Otros factores de riesgo, como el avance de la edad, el antecedente familiar de CPC prematura y el sexo masculino, no pueden modificarse. La tendencia al desarrollo de la ateroesclerosis parece tener un carácter familiar. Las personas con antecedentes familiares marcados de cardiopatía o accidente cerebrovascular por ateroesclerosis tienen mayor riesgo de desarrollar ateroesclerosis que aquéllos sin el antecedente familiar. Se han identificado varias alteraciones genéticas con efectos en el metabolismo de las lipoproteínas y colesterol, y parece probable que se identifiquen más en el futuro. La incidencia de ateroesclerosis aumenta con la edad.
Si otros factores permanecen iguales, los varones tienen mayor riesgo de desarrollar ECV que las mujeres premenopáusicas, quizá por los efectos protectores de los estrógenos naturales. Después de la menopausia, la incidencia de enfermedades relacionadas con la ateroesclerosis en las mujeres aumenta y la frecuencia de infarto de miocardio tiende a igualarse en ambos sexos.
Los principales factores de riesgo para ateroesclerosis que pueden modificarse con un cambio en las conductas de atención a la salud incluyen las cifras altas de colesterol sanguíneo (sobre todo el colesterol LBD), tabaquismo, obesidad y grasa visceral, hipertensión y diabetes mellitus (factores de riesgo cardiovascular usuales). El tabaquismo tiene una estrecha relación con la ECV y la muerte súbita. El consumo durante años de una cajetilla de cigarrillos al día o más duplica el daño al endotelio. Sin embargo, la suspensión del tabaquismo reduce de manera significativa el riesgo de daño endotelial.
La hipertensión o la presión arterial elevada aumentan al doble el riesgo de enfermedad arterial coronaria ateroesclerótica. La diabetes mellitus tipo 2 eleva más de 2 veces el riesgo de enfermedad. Cuando una persona tiene hipertensión y diabetes tipo 2, su riesgo de coronariopatía ateroesclerótica se incrementa 8 veces.
Sin embargo, no toda la enfermedad vascular aterotrombótica puede explicarse por los factores de riesgo genéticos y ambientales conocidos. Otros factores de riesgo cardiovascular conocidos como no habituales pueden vincularse con un mayor riesgo de ateroesclerosis; incluyen la proteína C reactiva (PCR), homocisteína sérica, lipoproteína (a) sérica y agentes infecciosos.
En los últimos años se ha generado un interés considerable en el papel de la inflamación en la etiología de la ateroesclerosis. En particular, ahora la PCR se considera un marcador de riesgo mayor. La PCR es un marcador sérico de la inflamación sistémica (capítulo 14). Varios estudios prospectivos indicaron que las cifras elevadas de PCR se relacionan con la enfermedad vascular. El papel fisiopatológico de la PCR en la ateroesclerosis no se ha definido. Es probable que la PCR de alta sensibilidad (PCR-as) sea un mejor factor predictivo del riesgo cardiovascular que la medición de lípidos sola. Además, más del 75% de los accidentes cardiovasculares ocurre en mujeres con cifras normales de LBD (<160 mg/dl).
En el Heart Protection Study, el tratamiento con estatina disminuyó las complicaciones cardiovasculares, incluso en personas con LBD normal. Sepensó que esto se debía a los efectos anti-inflamatorios de estos agentes. La inflamación (valorada por el descenso en la PCR-as) puede reducirse con ciertos cambios en el estilo de vida (ejercicio y disminución del estrés) y con fármacos (estatinas, fibratos y tiazolidinedionas).
Las concentraciones séricas de PCR-as menores de 1 mg/l, 1 a 3 mg/l y mayores de 3 mg/l corresponden a los grupos de riesgo bajo, medio y alto, respectivamente, de accidentes cardiovasculares futuros. En la mayoría de las situaciones clínicas, es probable que una sola medición de PCR-as sea adecuada, siempre que se obtengan cifras menores de 10 mg/l. Como la PCR es un reactante de fase inflamatoria aguda, las infecciones graves, traumatismos y el internamiento en el hospital pueden elevar su concentración (casi siempre 100 veces o más). Por tanto, la concentración de PCR para determinar el riesgo cardiovascular debe medirse en condiciones de estabilidad clínica. Si la cifra se mantiene muy alta, debe considerarse una fuente alternativa de inflamación sistémica.
La homocisteína proviene del metabolismo de la metionina dietética, un aminoácido abundante en la proteína animal. El metabolismo normal de la homocisteína requiere cantidades adecuadas de folato, vitamina B6, vitamina B12 y riboflavina. La homocisteína inhibe elementos de la cascada anticoagulante y se relaciona con daño endotelial, el cual se considera un primer paso importante en el desarrollo de la ateroesclerosis. Sin embargo, casi nunca se recomienda la complementación con ácido fólico, vitamina B6 y vitamina B12 para reducir la concentración plasmática de homocisteína en la prevención primaria o secundaria de la ECV, según la evidencia clínica relevante.
La lipoproteína (a) tiene composición similar a la LBD y es un factor de riesgo independiente para el desarrollo de CPC prematura; por su parte la lipoproteína (a) puede causar ateroesclerosis por la unión con macrófagos mediante un receptor de alta afinidad que induce la formación de células espumosas y el depósito de colesterol en placas ateroescleróticas. Debe medirse la concentración de lipoproteína (a) en personas con enfermedad coronaria prematura o antecedente familiar positivo, ya que no se modifica con los fármacos hipolipémicas habituales. Está demostrado que la cifra de lipoproteína (a) disminuye con la uilización de ácido nicotínico. La concentración deseable es menor de14 mg/dl.
También ha crecido el interés en la posible relación entre los agentes infecciosos (ej. Chlamydia pneumoniae, virus herpes, citomegalovirus) y el desarrollo de enfermedad vascular. Se ha demostrado la presencia de estos agentes en las lesiones ateromatosas mediante análisis inmunocitoquímico, pero no se ha establecido una relación causa–efecto. Es posible que los organismos participen en el desarrollo de la ateroesclerosis porque inician e intensifican la respuesta inflamatoria.
Patogénesis
Las lesiones formadas en la ateroesclerosis son de 3 tipos:
- la estría grasa,
- la placa ateromatosa fibrosa y
- la lesión complicada.
Las últimas 2 son las causantes de las manifestaciones clínicas de la enfermedad.
Las estrías grasas son zonas delgadas, planas y de coloración amarilla en la íntima que crecen de manera progresiva para convertirse en lesiones más gruesas y un poco elevadas mientras crecen en longitud. En el examen histológico, consisten en macrófagos y CML distendidas con lípidos para formar células espumosas. Las estrías grasas se forman en niños, a menudo en el primer año de edad. Esto ocurre sin importar la región geográfica, sexo o etnia. Su número aumenta hasta cerca de los 20 años de edad y luego permanecen estáticas o regresan. El daño al endotelio es un marcador temprano que luego puede volverse ateroesclerótico. Una vez que el endotelio se daña, los monocitos circulantes y los lípidos empiezan a adherirse al área. Esta placa ateromatosa fibrosa se caracteriza por un color gris a blanco perlado producido por los macrófagos que ingieren y oxidan las lipoproteínas acumuladas y forman una estría grasa visible. Con el tiempo, las estrías grasas crecen y proliferan al músculo liso. Conforme aumenta el tamaño de las lesiones, invaden el lumen de la arteria. Los macrófagos liberan sustancias que causan inflamación y al final pueden ocluir el vaso o predisponer a la formación de un trombo, lo que reduce el flujo sanguíneo (figura 30-8). Como el flujo sanguíneo se relaciona con el radio elevado a la cuarta potencia, la reducción en el flujo sanguíneo aumenta conforme la enfermedad evoluciona.
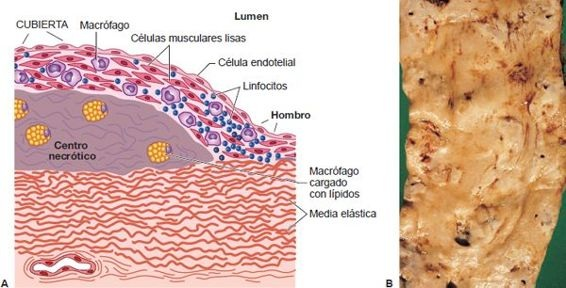
Las lesiones complicadas más avanzadas incluyen hemorragia, ulceración y depósitos de tejido cicatricial. La trombosis es la principal complicación de la ateroesclerosis; la causa es el enlentecimiento y turbulencia del flujo sanguíneo en la región de la placa y la ulceración de la placa. El trombo puede ocluir un vaso pequeño en el corazón y el cerebro. Además, es posible que se formen aneurismas en las arterias debilitadas por la formación extensa de placa.
Aunque se han identificado los factores de riesgo relacionados con la ateroesclerosis mediante estudios epidemiológicos, aún quedan muchas interrogantes sin respuesta sobre los mecanismos por los que estos factores de riesgo contribuyen al desarrollo de la ateroesclerosis. El endotelio vascular, formado por una sola capa de células con uniones entre ellas, en condiciones normales actúa como una barrera selectiva que protege las capas subendoteliales al interactuar con las células sanguíneas y otros componentes de la sangre.
Una hipótesis de la formación de la placa sugiere que la lesión en la capa endotelial del vaso es el factor iniciador en el desarrollo de la ateroesclerosis. Varios factores se consideran posibles agentes nocivos, incluidos los productos del tabaco en los fumadores, mecanismos inmunitarios y estrés mecánico como el relacionado con la hipertensión. El hecho de que las lesiones ateroescleróticas tiendan a formarse en los puntos de ramificación vascular o en los sitios donde hay flujo turbulento sugiere la posible participación de factores hemodinámicos.
Se cree que también la hiperlipidemia, sobre todo por LBD con su alto contenido de colesterol, tiene un papel activo en la patogénesis de la lesión ateroesclerótica. Las interacciones entre el endotelio vascular y los leucocitos, en particular los monocitos (macrófagos sanguíneos), ocurren de manera normal durante toda la vida; estas interacciones se incrementan cuando la concentración sanguínea de colesterol es elevada. Una de las respuestas más tempranas al colesterol elevado es launión de los monocitos con el endotelio. Se ha observado que los monocitos migran a través de las uniones intercelulares del endotelio hacia los espacios subendoteliales, donde se transforman en macrófagos.
Los macrófagos activados liberan radicales libres que oxidan la LBD. La LBD oxidada es tóxica para el endotelio, causa pérdida endotelial y exposición del tejido subendotelial a los componentes sanguíneos. Esto induce la adhesión y agregación plaquetarias y los depósitos de fibrina. Las plaquetas y los macrófagos activados liberan varios factores que parecen inducir factores de crecimiento, los que a su vez modulan la proliferación de CML y el depósito de MEC en las lesiones.
Los macrófagos activados también ingieren LBD oxidada (por captación a través del receptor eliminador) para convertirse en células espumosas, presentes en todas las etapas de la formación de la placa ateroesclerótica. Los lípidos liberados de las células espumosas necróticas se acumulan y forman el centro lipídico de las placas inestables. Por lo general, las características histológicas de las placas inestables incluyen un centro lipídico grande, infiltrado inflamatorio y una cubierta fibrosa delgada. Estas «placas vulnerables» tienen riesgo de ruptura (ruptura de placa), a menudo en el hombro de la placa (figura 30-8A), donde la cubierta fibrosa es más delgada (por la presencia de células inflamatorias locales y mediadores que degradan la cubierta) y el estrés mecánico es mayor.
Manifestaciones clínicas
La ateroesclerosis comienza como un proceso insidioso, por lo general no hay manifestaciones clínicas de la enfermedad durante 20 a 40 años o más. Las placas fibrosas a menudo comienzan a aparecer en las arterias de los estadounidenses en su tercera década de vida. Las manifestaciones clínicas de la ateroesclerosis dependen de los vasos implicados y la magnitud de la obstrucción vascular.
Las placas (lesiones) ateroescleróticas ejercen sus efectos por:
- Estrechamiento del vaso con producción de isquemia.
- Obstrucción súbita del vaso por hemorragia o ruptura de la placa.
- Trombosis y formación de émbolos a causa del daño al endotelio vascular.
- Formación de aneurisma por debilitamiento de la pared vascular.
En los vasos más grandes, como la aorta, las complicaciones importantes son la formación de un trombo y el debilitamiento de la pared vascular. En las arterias de tamaño mediano, como las coronarias y las cerebrales, son más frecuentes la isquemia y el infarto por la oclusión vascular.
Aunque la ateroesclerosis puede afectar cualquier órgano o tejido, las arterias que irrigan el corazón,cerebro, riñones, extremidades inferiores e intestino delgado son las afectadas con más frecuencia.
Vasculitis
Las vasculitis son un grupo de trastornos vasculares que causan lesión inflamatoria y necrosis de la pared del vaso sanguíneo. Las vasculitis, que son una vía común de compromiso tisular y orgánico en muchas enfermedades distintas, afectan a las células endoteliales y las CML de la pared vascular. Pueden afectar los vasos de cualquier tipo (arterias, venas y capilares) de cualquier órgano. Como alteran venas y capilares, los términos vasculitis, angitis y arteritis a menudo se utilizan de manera indistinta. Las manifestaciones clínicas frecuentes incluyen fiebre, mialgia, artralgia y malestar.
Las vasculitis pueden producirse por lesión directa al vaso, agentes infecciosos o procesos inmunitarios; también pueden ser secundarias a otros estados patológicos, como lupus eritematoso sistémico. Los agentes físicos, como el frío (ej. congelación), radiación (ej. quemadura solar), lesión mecánica, mecanismos inmunitarios y toxinas causan daño vascular secundario, lo que a menudo causa necrosis de los vasos. En ocasiones las vasculitis se relacionan con anticuerpos citoplásmicos antineutrofílicos (ANCA). Son anticuerpos dirigidos contra ciertas proteínas en el citoplasma de los neutrófilos; pueden causar daño endotelial. Los títulos de ANCA séricos, que pueden relacionarse con la actividad de la enfermedad, pueden ser un marcador diagnóstico cuantitativo útil en estos trastornos.
Las vasculitis a menudo se clasifican con base en su etiología, hallazgos patológicos y pronóstico. Un sistema de clasificación divide los trastornos en 3 grupos:
- vasculitis de vasos pequeños,
- de vasos medianos y
- de vasos grandes (tabla 30-2).
| Grupo | Ejemplos | Características |
|---|---|---|
| Vasculitis de vasos pequeños | Poliangitis microscópica | Vasculitis necrosante con pocos o ningún depósito inmunitario, afecta vasos sanguíneos medianos y pequeños, incluidos capilares, vénulas y arteriolas; es frecuente la glomerulonefritis necrosante y el compromiso de los capilares pulmonares |
| Granulomatosis de Wegener | Inflamación granulomatosa que afecta las vías respiratorias y vasculitis necrosante que afecta capilares, vénulas, arteriolas y arterias; es frecuente la glomerulonefritis necrosante | |
| Vasculitis de vasos medianos | Poliarteritis nodosa | Inflamación necrosante de arterias pequeñas y medianas sin vasculitis en arterias, capilares ni vénulas; casi siempre se relaciona con enfermedad subyacente o agentes ambientales |
| Enfermedad de Kawasaki | Afecta arterias grandes, medianas y pequeñas (a menudo las coronarias) y se relaciona con síndrome de ganglio linfático mucocutáneo; casi siempre ocurre en niños pequeños | |
| Tromboangitis obliterante | Inflamación aguda y crónica, segmentaria, con trombosis de las arterias medianas y pequeñas, sobre todo las arterias tibial y radial, aunque a veces se extiende a venas y nervios de las extremidades; ocurre casi sólo en varones que son grandes fumadores | |
| Vasculitis de vasos grandes | Arteritis de células gigantes (temporal) | Inflamación granulomatosa de la aorta y sus ramas principales con predilección por ramas extracraneales de la arteria carótida; inflamación de la pared vascular con células gigantes y células mononucleares; casi siempre ocurre en personas mayores de 50 años y a menudo se relaciona con polimialgia reumática |
| Arteritis de Takayasu | Inflamación granulomatosa de la aorta y sus ramas; casi siempre ocurre en sujetos mayores de 50 años |
Los vasos pequeños se refieren a las arterias pequeñas (sólo enfermedad relacionada con ANCA), arteriolas, vénulas y capilares; los vasos medianos son arterias y arteriolas de tamaño mediano y pequeño; y los vasos grandes se refieren a la aorta y sus principales ramas.
Las vasculitis de vasos pequeños participan en distintas enfermedades, la mayoría de las cuales está mediada por una reacción de hipersensibilidad con complejos inmunitarios tipo III. Con frecuencia afectan la piel y a menudo son una complicación de alguna enfermedad subyacente (ej. vasculitis relacionada con neoplasias o enfermedad del tejido conectivo) y exposición a agentes ambientales (ej. vasculitis en la enfermedad del suero y urticarial). Las vasculitis de pequeños vasos positiva para ANCA incluyen la poliangitis microscópica, granulomatosis de Wegener y el síndrome de Churg-Strauss. Estas vasculitis positivas para ANCA se tratan con regímenes similares.
Las vasculitis de vasos medianos producen daño necrosante a las arterias musculares de tamaño intermedio de los principales sistemas orgánicos. Este grupo incluye la poliarteritis nodosa, enfermedad de Kawasaki y tromboangitis obliterante.
Las vasculitis de vasos grandes afectan las arterias elásticas. Incluyen la arteritis de células gigantes (temporal), polimialgia reumática y arteritis de Takayasu. La siguiente discusión se enfoca en 2 de las vasculitis: la poliarteritis nodosa y la arteritis de células gigantes (temporal).
Poliarteritis nodosa
La poliarteritis nodosa, llamada así por los numerosos nódulos encontrados en el curso de las arterias musculares, es una enfermedad inflamatoria multisistémica primaria de los vasos sanguíneos pequeños y medianos, sobre todo los de los riñones, hígado, intestino, nervios periféricos, piel y músculo. La enfermedad es más frecuente en varones.
Etiología
La causa de la poliarteritis nodosa se desconoce. Puede desarrollarse en drogadictos y a veces se relaciona con la utilización de ciertos fármacos, como alopurinol y sulfonamidas. Existe una relación entre la poliarteritis nodosa y la hepatitis B12, del 10% al 30% de las personas con la enfermedad tiene anticuerpos contra hepatitis B. Otras relaciones incluyen otitis media grave, tricoleucemia y tratamiento de desensibilización para alergias. Las personas con enfermedades del tejido conectivo como lupus eritematoso sistémico, artritis reumatoide y síndrome de Sjögren primario pueden tener manifestaciones similares a las de la poliarteritis nodosa primaria.
Manifestaciones clínicas
El inicio de la poliarteritis nodosa puede ser agudo, subagudo o crónico, con largos períodos asintomáticos. Los signos y síntomas clínicos varían por el compromiso vascular variado. Casi siempre comienza con quejas de anorexia, pérdida de peso, fiebre y fatiga, a menudo acompañadas de signos de compromiso orgánico. Los riñones son los órganos más afectados y la hipertensión es una manifestación frecuente del trastorno.
El compromiso gastrointestinal se manifiesta con dolor abdominal, náuseas, vómito o diarrea. Son frecuentes la mialgia, artralgia y artritis, igual que las neuropatías periféricas con parestesia, dolor y debilidad. Las complicaciones del sistema nervioso central incluyen accidente cerebrovascular trombótico y hemorrágico.
Las manifestaciones cardíacas son resultado del compromiso de las arterias coronarias. También puede haber lesiones cutáneas, que son muy variables; incluyen áreas con coloración azul y moteada en la piel de las extremidades llamadas livedo reticular, púrpura (coloración negra y azul por hemorragia en la piel), urticaria (ronchas) y úlceras.
Diagnóstico y tratamiento
Aunque los hallazgos de laboratorio son variables, incluyen aumento en la velocidad de eritrosedimentación, leucocitosis, anemia y signos de compromiso orgánico como hematuria y resultados alterados en las pruebas de función hepática. El diagnóstico se confirma en muestras de biopsia que muestran vasculitis necrosante de arterias pequeñas y grandes.
El tratamiento incluye corticoesteroides en dosis altas y a menudo inmunosupresores citotóxicos (ej. azatioprina, ciclofosfamida). Por lo general se administra el inmunosupresor citotóxico por 3 meses, seguido deglucocorticoides en dosis descendente en los 4 meses siguientes. Antes de que se dispusiera de corticoesteroides e inmunosupresores, muchas veces la enfermedad era mortal. Para personas con poliarteritis nodosa relacionada con hepatitis B12, está indicado el tratamiento agresivo simultáneo de la hepatitis con antivirales.
Arteritis temporal de células gigantes
La arteritis temporal (arteritis de células gigantes) es la vasculitis más frecuente; es un trastorno inflamatorio focal de las arterias medianas y grandes. Afecta sobre todo a los ramos del cayado aórtico, incluidas las arterias temporal superficial, vertebral, oftálmica y ciliar posterior. El trastorno evoluciona hasta afectar toda la pared arterial, con necrosis focal e inflamación granulomatosa con células gigantes multinucleadas (figura 30-9). Es más frecuente en adultos de edad avanzada, con una proporción entre mujeres y varones de 2:1. Se desconoce la causa, pero se ha sugerido un origen autoinmunitario, como una respuesta inmunitaria inicial mediada por células T3.
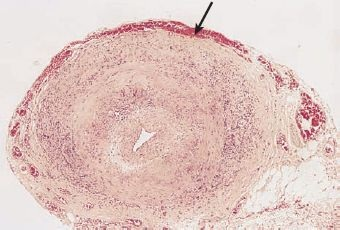
Este trastorno a menudo es de inicio insidioso y puede anunciarse por el inicio súbito de cefalea; sensibilidad sobre la arteria; inflamación y enrojecimiento de la piel de la zona; visión borrosa o diplopía; y dolor facial. Casi la mitad de las personas afectadas tiene compromiso sistémico en forma de polimialgia reumática. Hasta el 10% de las personas con arteritis de células gigantes desarrolla un aneurisma aórtico (sobre todo torácico).
El diagnóstico se basa en las manifestaciones clínicas; un aumento característico en la velocidad de eritrosedimentación y PCR; y biopsia de la arteria temporal. El tratamiento incluye dosis altas de corticoesteroides sin demora por el riesgo significativo de síntomas visuales. Antes que las personas con este trastorno fueran tratadas con corticoesteroides, casi el 80% desarrollaba ceguera por el compromiso de la arteria ciliar posterior. La dosis inicial típica de prednisolona es 40 mg/día a 60 mg/día durante 4 semanas.
Enfermedad arterial de las extremidades
Los trastornos en la circulación de las extremidades a menudo se refieren como trastornos vasculares periféricos. En muchos aspectos, los trastornos que afectan las arterias de las extremidades son los mismos que alteran las arterias coronarias y cerebrales, ya que causan isquemia, dolor, disfunción y en algunos casos, infarto y necrosis del tejido. No sólo los efectos son similares, sino que los cambios patológicos que afectan la circulación en las extremidades son idénticos. Esta sección se enfoca en la oclusión arterial aguda de las extremidades, enfermedad oclusiva ateroesclerótica, tromboangitis obliterante y enfermedad y fenómeno de Raynaud.
Oclusión arterial aguda
La oclusión arterial aguda es un fenómeno súbito que interrumpe el flujo arterial a los tejidos u órgano afectados. La mayoría de estos episodios son resultado de un émbolo o un trombo. Aunque son mucho menos frecuentes que los émbolos y trombos, el traumatismo o espasmo arterial causado por cateterización arterial es otra causa posible de oclusión arterial aguda.
Etiología y patogénesis
Un émbolo es una partícula que se mueve con libertad, como un coágulo sanguíneo que se desprende y viaja en los vasos más grandes de la circulación hasta que se aloja en un vaso más pequeño y ocluye el flujo sanguíneo. La mayoría de los émbolos se originan en el corazón y se deben a trastornos que inducen el desarrollo de coágulos en la pared de una cámara cardíaca o superficie valvular.
Por lo general, los émbolos son complicación de la enfermedad cardíaca: cardiopatía isquémica con o sin infarto, fibrilación auricular o cardiopatía reumática. Las válvulas cardíacas prostéticas son otra fuente posible de émbolos. Otros tipos de émbolos son los grasos que se originan en la médula ósea de huesos fracturados, embolia aérea en el pulmón y embolia de líquido amniótico que se produce durante el parto. La embolia arterial aguda se relaciona con un riesgo del 5% al 25% de pérdida de la extremidad afectada y un incremento del 25% al 30% en la mortalidad intrahospitalaria. La enfermedad cardíaca es la causa de más de la mitad de estos decesos.
Un trombo es un coágulo sanguíneo que se forma en la pared de un vaso y continúa en crecimiento hasta alcanzar un tamaño que obstruye el flujo sanguíneo. Los trombos a menudo se forman como resultado de la erosión o ruptura de la cubierta fibrosa de una placa ateroesclerótica.
Manifestaciones clínicas
Los signos y síntomas de la oclusión arterial aguda dependen de la arteria afectada y la calidad de la circulación colateral. Los émbolos tienden a alojarse en las bifurcaciones de las arterias principales, como la aorta, iliacas, femorales y poplíteas. El cuadro clínico de la embolia arterial aguda a menudo se describe con 7 «P»:
- Punzada (inicio agudo).
- Palidez.
- Polar (frialdad).
- Pulso ausente.
- Padecimiento (dolor).
- Parestesia.
- Parálisis.
La oclusión en una extremidad causa dolor agudo de inicio súbito con entumecimiento, hormigueo, debilidad, palidez y frialdad. A menudo existe una línea bien delineada que delimita el tejido oxigenado sobre el nivel de obstrucción y el tejido isquémico distal a la obstrucción. Hay ausencia de pulsos distales a la oclusión. Estos cambios van seguidos poco después por cianosis, piel moteada y pérdida de la función sensorial, refleja y motora. A menos que se restaure el flujo sanguíneo, el tejido muere.
Diagnóstico y tratamiento
El diagnóstico de la oclusión arterial aguda se basa en los signos de alteración en el flujo sanguíneo. Incluye valoración visual, palpación de pulsos y métodos para valorar el flujo sanguíneo.
El tratamiento de la oclusión arterial aguda se enfoca en restaurar el flujo sanguíneo. Cuando se ocluye una arteria grande, el tratamiento óptimo es la embolectomía, que es la extirpación quirúrgica del trombo.
El tratamiento trombolítico (estreptocinasa o activador tisular del plasminógeno) puede utilizarse como un intento por disolver el coágulo. Por lo general, se administra tratamiento anticoagulante (heparina) para prevenir la extensión de la embolia y prevenir la progresión del trombo original. Debe evitarse la aplicación de frío, y la extremidad debe protegerse de la lesión con superficies duras y la ropa de cama que la cubre.
Enfermedad oclusiva ateroesclerótica
La ateroesclerosis es causa importante de enfermedad arterial periférica (EAP) y se observa más a menudo en los vasos de las extremidades inferiores. En ocasiones el trastorno se refiere como arterioesclerosis obliterante. Los vasos afectados con mayor frecuencia son las arterias femoral, superficial y poplítea. Cuando las lesiones se desarrollan en la pierna y el pie, las arterias afectadas más a menudo son la tibial, peronea común o pedia. La enfermedad es más frecuente en varones y en las mujeres conforme avanza la edad. Cerca del 20% de las personas mayores de 70 años tienen EAP.
Etiología
Los factores de riesgo para este trastorno son similares a los de la ateroesclerosis. El tabaquismo contribuye a la progresión de la ateroesclerosis en las extremidades inferiores y al desarrollo de síntomas de isquemia. Las personas con diabetes mellitus desarrollan enfermedad vascular más extensa y con avance más rápido que los no diabéticos.
Manifestaciones clínicas
Como con la ateroesclerosis en otros sitios, los signos y síntomas de la oclusión vascular son graduales. Por lo general existe un estrechamiento de al menos el 50% del vaso antes que aparezcan manifestaciones de isquemia. El síntoma principal de la enfermedad arterial obstructiva crónica es la claudicación intermitente, o dolor durante la marcha. Las personas con el trastorno casi siempre se quejan de dolor en la pantorrilla porque el músculo gastrocnemio tiene el mayor consumo de oxígeno entre todos los grupos musculares de la pierna durante la marcha. Algunas personas se quejan de una sensación de dolorimiento vago o entumecimiento, más que de dolor. Otras actividades, como la natación, ciclismo y ascenso de escaleras emplean otros grupos musculares y es probable que no causen la misma intensidad de molestia que la marcha.
Otros signos de isquemia incluyen cambios atróficos y adelgazamiento de la piel y tejidos subcutáneos en la pierna, así como disminución en el tamaño de los músculos de la pantorrilla. Con frecuencia el pie está frío, los pulsos poplíteo y pedio son débiles o ausentes. El color de la extremidad se aclara con la elevación de la pierna por los efectos de la gravedad en la presión de perfusión, y adquiere un color rojo oscuro cuando está en posición inferior por el aumentoautorregulatorio del flujo sanguíneo y el aumento de la presión de perfusión debido a la gravedad.
Cuando el flujo sanguíneo disminuye al grado de no cubrir las necesidades mínimas del músculo en reposo y los nervios, aparecen el dolor isquémico en reposo, ulceración y gangrena. Conforme se desarrolla la necrosis tisular, suele haber dolor intenso en la región con alteración cutánea, más intenso por la noche, con la elevación de la extremidad y menos intenso durante la bipedestación.
Diagnóstico
Los métodos diagnósticos incluyen inspección de las extremidades en busca de signos de isquemia leve crónica, como atrofia cutánea, uñas de los pies frágiles, pérdida del vello, palidez, frialdad o rubor por declive. La palpación de los pulsos femoral, poplíteo, tibial posterior y dorsal del pie permite calcular el nivel y grado de obstrucción.
El índice tobillo-brazo (o sea, entre las arterias tibial y la radial) de la presión arterial sistólica se utiliza para detectar una obstrucción significativa; un índice menor de 0,9 indica oclusión. En condiciones normales, la presión sistólica en el tobillo es superior a la braquial porque la presión sistólica y la presión del pulso tienden a aumentar conforma la onda de presión se aleja del corazón. La presión arterial se mide en varios niveles de la pierna para determinar el nivel de obstrucción. Puede utilizarse un estetoscopio con ecografía Doppler para detectar los pulsos y medir la presión arterial. También se utilizan como métodos diagnósticos las imágenes por ecografía, la arteriografía por imagen por resonancia magnética (IRM), arteriografía tomográfica computarizada (TC) espiral y la angiografía con contraste invasiva.
Tratamiento
Los 2 objetivos del tratamiento en personas con EAP son:
- disminuir su considerable riesgo cardiovascular y
- aliviar los síntomas.
Las personas con EAP deben evaluarse en busca de ateroesclerosis coronaria y cerebrovascular concurrente. El riesgo de muerte, sobre todo por fenómenos coronarios y cerebrovasculares, es más alto que si no tuvieran EAP. También es importante señalar otros factores de riesgo cardiovascular, como el tabaquismo, hipertensión, concentraciones altas de lípidos y diabetes. Debe recomendarse la suspensión del tabaquismo y los problemas de salud coexistentes deben tratarse en forma apropiada.
Los fármacos antiplaquetarios (ácido acetilsalicílico o clopidogrel) reducen en cerca del 25% la tasa de mortalidad vascular en personas con EAP. Otros medicamentos útiles incluyen estatinas, cilostazol (un inhibidor de la fosfodiesterasa) y pentoxifilina (un antagonista del receptor para difosfato de adenosina (ADP) que disminuye la viscosidad sanguínea y mejora la flexibilidad de los eritrocitos). Los tejidos de las extremidades afectadas por ateroesclerosis se lesionan con facilidad y se curan con lentitud. El tratamiento incluye medidas enfocadas en la protección de los tejidos afectados y en la conservación de la capacidad funcional. Casi siempre se alienta a caminar (despacio) hasta el punto de la claudicación, ya que esto aumenta la circulación colateral.
Por lo general, la intervención percutánea o quirúrgica se reserva para la persona con claudicación incapacitante o con isquemia que pone en peligro la extremidad. La cirugía (injerto para derivación femoropoplítea con una sección de la vena safena) está indicada en algunos casos graves.
En pacientes diabéticos a menudo están afectadas las arterias peroneas entre las rodillas y los tobillos, lo que dificulta la revascularización. La tromboendarterectomía con extracción del centro oclusivo del tejido ateroesclerótico puede hacerse si la sección afectada del vaso es muy corta. Otra forma de tratamiento es la angioplastia transluminal percutánea y la colocación de una endoprótesis, en la que se introduce un catéter con globo en la región estrechada y el globo se infla para aumentar el diámetro vascular.
Tromboangitis obliterante
La tromboangitis obliterante, o enfermedad de Buerger, es un trastorno arterial inflamatorio (una arteritis) que induce formación de trombos. El trastorno afecta las arterias medianas, casi siempre los vasos plantares y digitales del pie y la parte inferior de la pierna. También puede afectar las arterias del brazo y la mano. Se caracteriza por inflamación aguda y crónica, segmentaria y formadora de trombos. Aunque afecta sobre todo a las arterias, con frecuencia se extiende y compromete las venas y nervios adyacentes. La enfermedad casi siempre se observa en personas menores de 35 años de edad con tabaquismo intenso.
Etiología y patogénesis
La patogénesis de la enfermedad de Buerger todavía está en el campo de la especulación. Sin embargo, el tabaquismo y en algunos casos el tabaco mascado parecen participar. Se ha sugerido que la nicotina tiene un efecto directo tóxico en las células endoteliales y puede desencadenar una respuesta inmunitaria. Se sugieren influencias genéticas porque es más prevalente en ciertos grupos étnicos.
Manifestaciones clínicas
El dolor es el síntoma principal de esta enfermedad. Por lo general se debe a isquemia distal. Durante las etapas tempranas del trastorno existe claudicación intermitente en el arco del pie y los dedos. En casos graves, el dolor se presenta incluso en reposo. La circulación alterada aumenta la sensibilidad al frío. Los pulsos periféricos están disminuidos o ausentes y existen cambios en el color de la extremidad. En los casos con avance moderado, la extremidad se vuelve cianótica cuando la persona se pone en posición vertical; los dedos pueden adquirir un tono azul rojizo incluso sin encontrarse en declive. Con la falta de flujo sanguíneo, la piel adquiere una apariencia delgada y brillante, se reducen el crecimiento del vello y la nutrición cutánea. La isquemia crónica hace que las uñas se vuelvan gruesas y malformadas. Si la enfermedad progresa, al final los tejidos se ulceran y aparecen cambios gangrenosos que ameritan amputación.
Diagnóstico y tratamiento
Los métodos diagnósticos son similares a los de la enfermedad ateroesclerótica de las extremidades inferiores. Como parte del programa terapéutico para tromboangitis obliterante, es obligatorio que la persona suspenda el consumo de tabaco. Incluso deben eliminarse el tabaquismo pasivo y el tratamiento de reemplazo con nicotina. Otras medidas terapéuticas tienen importancia secundaria y se enfocan en métodos para inducir vasodilatación y prevenir la lesión del tejido. Puede recurrirse a la simpatectomía para aliviar las manifestaciones del espasmo vascular de esta enfermedad.
Enfermedad y fenómeno de Raynaud
La enfermedad o fenómeno de Raynaud es un trastorno funcional causado por vasoespasmo intenso de las arterias y arteriolas en los dedos de las manos, con menor frecuencia de los pies. Este trastorno frecuente afecta del 3% al 5% de la población y es más frecuente en las mujeres. Existen 2 tipos: el primario, llamado enfermedad de Raynaud, carece de una causa demostrable; el tipo secundario, llamado fenómeno de Raynaud, se relaciona con otras enfermedades o causas conocidas de espasmo vascular.
Etiología y patogénesis
El vasoespasmo es una respuesta constrictora excesiva a estímulos que en condiciones normales sólo producen vasoconstricción moderada. En contraste con lechos circulatorios regionales inervados por fibras vasodilatadoras y vasoconstrictoras, los vasos cutáneos de los dedos de manos y pues sólo están inervados por fibras vasoconstrictoras simpáticas. En estos vasos, la dilatación ocurre por retiro del estímulo simpático. El enfriamiento de partes específicas del cuerpo, como la cabeza, cuello y tronco, produce una disminución del flujo sanguíneo digital mediada por nervios simpáticos, lo mismo ocurre con el estrés emocional.
La enfermedad de Raynaud se desencadena por la exposición al frío o a emociones intensas y casi siempre se limita a los dedos. También tiene una evolución más benigna que el fenómeno de Raynaud, pocas veces causa necrosis tisular. Se desconoce la causa del vasoespasmo en la enfermedad de Raynaud. El fenómeno de Raynaud se relaciona con una lesión vascular previa, como la congelación, traumatismo laboral derivado de la utilización de herramientas pesadas vibratorias, enfermedades del colágeno, trastornos neurológicos y trastornos oclusivos arteriales crónicos. Otra causa relacionada con la ocupación es la exposición a temperaturas frías y calientes alternadas, como la que experimentan los carniceros y preparadores de alimentos. El fenómeno de Raynaud a menudo es la primera manifestación de las enfermedades de la colágeno, como la esclerodermia y el lupus eritematoso sistémico.
Manifestaciones clínicas
En la enfermedad y el fenómeno de Raynaud, la isquemia por vasoespasmo causa cambios en la coloración de la piel que evolucionan de palidez a cianosis, sensación de frío y cambios sensoriales, como entumecimiento y hormigueo. Los cambios de color por lo general comienzan en las puntas de los dedos y avanzan a una o más falanges distales (figura 30-10). Después del episodio isquémico, hay un período de hiperemia con enrojecimiento intenso, sensación pulsátil y parestesias. El período hiperémico va seguido por el regreso de la coloración normal. Aunque casi siempre se afectan todos los dedos de manera simétrica, en algunos casos sólo se altera un dedo o una porción del mismo.
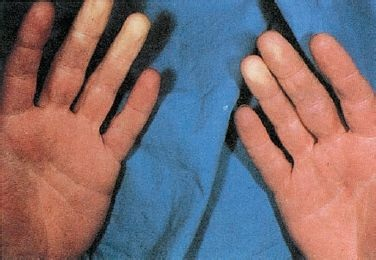
En los casos graves progresivos, por lo general de fenómeno de Raynaud, puede haber cambios tróficos. Las uñas se vuelven frágiles y la piel de las puntas de los dedos se engruesa. La alteración nutricional de estas estructuras puede causar artritis. Es posible la ulceración y gangrena superficial de los dedos, aunque es infrecuente.
Diagnóstico y tratamiento
El diagnóstico inicial se basa en el relato de los ataques de vasoespasmo, apoyado con otra evidencia del trastorno. Puede utilizarse la inmersión en agua fría para desencadenar un ataque como ayuda para el diagnóstico. También se emplea la velocimetría del flujo Doppler por láser para cuantificar el flujo sanguíneo digital durante los cambios de temperatura. La enfermedad de Raynaud se distingue del fenómeno de Raynaud mediante la exclusión de las enfermedades causantes del vasoespasmo.
Las medidas terapéuticas se enfocan en eliminar los factores que causan vasoespasmo y en la protección de los dedos contra traumatismos durante un episodio isquémico. Son prioritarias la abstinencia del tabaco y la protección contra el frío. Debe protegerse del frío todo el cuerpo, no sólo las extremidades. Otro factor importante para controlar el trastorno es evitar el estrés emocional, ya que la ansiedad y el estrés pueden desencadenar el espasmo vascular en las personas predispuestas.
Deben evitarse los medicamentos vasoconstrictores, como los descongestionantes que contienen las preparaciones para alergia y gripe. A veces está indicado el tratamiento con vasodilatadores, sobre todo si los episodios son frecuentes, ya que la frecuencia favorece el desarrollo de trombosis y gangrena. Los bloqueadores del conducto de calcio (ej. nifedipina, diltiazem) disminuyen la gravedad y la frecuencia de los ataques. También puede utilizarse prazosina, un bloqueador de los receptores α-adrenérgicos. Puede recurrirse a la interrupción quirúrgica de las vías nerviosas simpáticas (simpatectomía) en personas con síntomas graves.
Aneurismas
Un aneurisma es una dilatación localizada anómala en un vaso sanguíneo. Los aneurismas pueden formarse en arterias y venas, pero son más frecuentes en la aorta. Existen 2 tipos de aneurismas: los verdaderos y los falsos.
Un aneurisma verdadero es el que está delimitado por la pared vascular completa. En un aneurisma verdadero, la sangre permanece dentro del compartimiento vascular. Los aneurismas falsos o seudoaneurismas son una disección localizada o desgarro en pared interna de la arteria, con formación de un hematoma extravascular que causa crecimiento del vaso. A diferencia de los aneurismas verdaderos, los falsos sólo están delimitados por las capas externas de la pared vascular o tejidos de soporte (figura 30-11).
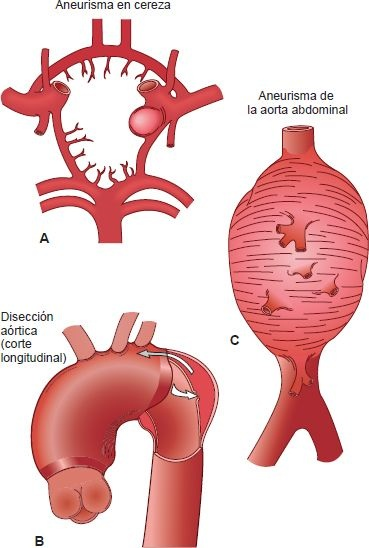
Los aneurismas pueden asumir varias formas y se clasifican con base en su causa, localización y características anatómicas.
Un aneurisma en cereza es un aneurisma verdadero que consiste en una pequeña dilatación esférica en la bifurcación de un vaso. Este tipo de aneurisma casi siempre se encuentra en el polígono de Willis, en la circulación cerebral.
Un aneurisma fusiforme es un aneurisma verdadero que afecta toda la circunferencia del vaso y se caracteriza por dilatación gradual y progresiva del mismo. Estos aneurismas, cuyo diámetro (hasta 20 cm) y longitud varían, pueden afectar todas las porciones ascendente y transversal de la aorta torácica, o pueden extenderse en segmentos largos de la aorta abdominal.
Un aneurisma sacular es un aneurisma verdadero que se extiende sobre parte de la circunferencia del vaso y tiene forma de un saco.
Un aneurisma disecante es un aneurisma falso causado por un desgarro en la túnica íntima del vaso, lo que permite que la sangre entre a la pared vascular y diseca sus capas para formar una cavidad llena de sangre (figura 30-11). Si la disección se produce en la aorta, pone en peligro la vida (véase más adelante).
La debilidad que conduce a la formación de un aneurisma puede ser resultado de varios factores, como defectos congénitos, traumatismo, infecciones y ateroesclerosis. Una vez iniciado, el aneurisma crece conforme aumenta la tensión de la pared vascular. Esto se debe a que la tensión en la pared de un vaso es igual a la presión multiplicada por el radio (tensión = presión × radio). En este caso, la presión en el segmento del vaso afectado por el aneurisma no cambia, permanece igual a la de las porciones adyacentes del vaso. Conforme el diámetro del aneurisma aumenta, la tensión en la pared vascular también se eleva en proporción directa al aumento de tamaño. Sin tratamiento, el aneurisma puede romperse por aumento en la tensión. Incluso un aneurisma no roto puede causar daño porque ejerce presión en las estructuras adyacentes e interrumpe el flujo sanguíneo.
Aneurismas aórticos
Los aneurismas aórticos pueden afectar cualquier parte de la arteria: la ascendente, el cayado, la porción descendente, toracoabdominal o abdominal. Es posible que haya varios aneurismas.
Etiología
Las 2 causas más frecuentes de aneurismas aórticos son la ateroesclerosis y la degeneración de la túnica media vascular. La mitad de las personas con aneurismas aórticos tienen hipertensión. Los aneurismas aórticos se desarrollan con más frecuencia en varones mayores de 50 años fumadores de cigarrillos.
Manifestaciones clínicas
Los signos y síntomas de los aneurismas aórticos dependen del tamaño y la localización. Un aneurisma también puede ser asintomático, la primera evidencia de su presencia se debe a su ruptura.
Los aneurismas de la aorta torácica son menos frecuentes que los de la aorta abdominal. Representan menos del 10% de los aneurismas aórticos y pueden manifestarse con dolor retroesternal, en la espalda o el cuello. También es posible que haya disnea, estridor o tos metálica causada por la presión sobre la tráquea. Puede haber ronquera, resultado de la presión sobre el nervio laríngeo recurrente y también es factible la dificultad para la deglución por la presión sobre el esófago. Además, a veces el aneurisma comprime la vena cava superior, lo que causa distensión de las venas del cuello y edema de cara y cuello.
La localización más frecuente de los aneurismas aórticos abdominales es inferior a la arteria renal (>90%), afectan la bifurcación aórtica y el extremo proximal de las arterias iliacas primitivas. La aorta infrarrenal normal mide 2 cm de diámetro; un aneurisma se define por un diámetro aórtico mayor de 3 cm. Puede afectar cualquier parte de la circunferencia del vaso (sacular) o extenderse y afectarla toda (fusiforme). La mayoría de los aneurismas abdominales es asintomática.
Como un aneurisma está en una arteria, la presencia de una masa pulsátil puede ser la primera evidencia del trastorno. Por lo general, los aneurismas mayores de 4 cm son palpables. Es posible que la masa se descubra durante una exploración física de rutina o que la persona se queje de su presencia. Es frecuente la calcificación en la pared del aneurisma y puede detectarse en un examen radiográfico abdominal. Es posible que haya dolor, que varía desde leve en la parte media del abdomen, una molestia lumbar y hasta dolor intenso en el abdomen y la espalda. Conforme los aneurismas se expanden, pueden comprimir las raíces nerviosas lumbares, lo que causa dolor en la parte baja de la espalda que se irradia a las caras posteriores de las piernas. El aneurisma puede extenderse y comprimir las arterias renal, iliaca o mesentérica, o las arterias vertebrales que irrigan la médula espinal. Es posible que un aneurisma abdominal erosione las vértebras. La estasis sanguínea favorece la formación de trombos en la pared del vaso (figura 30-12), con posibilidad de embolias periféricas que causan insuficiencia arterial sintomática.
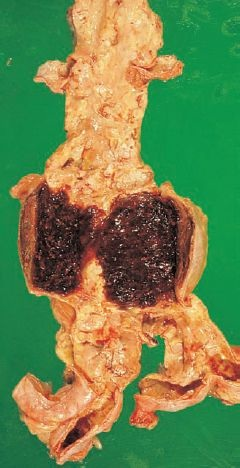
La complicación más temida de los aneurismas torácicos y abdominales es la ruptura. La probabilidad de ruptura se relaciona con el tamaño creciente del aneurisma. El riesgo se incrementa desde menos de 2% para los aneurismas abdominales pequeños (<4 cm de diámetro) hasta el 5% y 10% por año para los aneurismas mayores de 5 cm de diámetro.
Diagnóstico y tratamiento
Los métodos diagnósticos incluyen el empleo de ecografía, ecocardiografía, TC e IRM. Con frecuencia, el tratamiento de elección es la reparación quirúrgica, en la que la sección afectada de la aorta se sustituye por un injerto sintético de Dacron tejido.
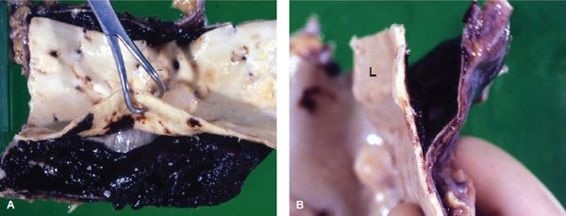
Disección aórtica
La disección aórtica (aneurisma disecante) es una situación aguda que pone en peligro la vida. Implica hemorragia hacia la pared vascular, con desgarro longitudinal de la pared vascular que forma un conducto lleno de sangre (figura 30-13). A diferencia de los aneurismas ateroescleróticos, la disección aórtica a menudo se produce sin evidencia de dilatación vascular previa. Más del 95% de los casos de aneurisma disecante tienen un desgarro transversal en la túnica intima y la parte interna de la túnica media. La disección puede originarse en cualquier parte de la aorta; la mayoría afecta la aorta ascendente. El segundo sitio en frecuencia es la aorta torácica, justo distal al origina de la arteria subclavia.
Etiología y patogénesis
La disección aórtica se produce por trastornos que debilitan o causan cambios degenerativos en la capa elástica y el músculo liso de la aorta. Es más frecuente en el grupo de 40 a 60 años de edad y más prevalente en varones. Dos factores de riesgo predisponen a la disección aórtica: la hipertensión y la degeneración de la túnica media de la pared vascular. En la mayoría de los casos existe antecedente de hipertensión. La disección aórtica también se relaciona con enfermedades del tejido conectivo, como síndrome de Marfan. Asimismo, se produce durante el embarazo por los cambios que experimenta la aorta en ese período. Otros factores que predisponen a la disección son los defectos congénitos en la válvula aórtica (o sea, válvulas bicúspides o unicúspides) y la coartación aórtica. La disección aórtica es una complicación posible de la cirugía y cateterismo cardíacos. La disección relacionada con cirugía puede ocurrir en los puntos donde la aorta se cortó y pinzó. Hay informes en el sitio donde la vena safena se suturó a la aorta durante la cirugía con injerto para revascularización coronaria.
Las disecciones aórticas a menudo se clasifican en 2 tipos, A y B12, según el nivel de disección.
Las lesiones proximales más frecuentes (y potencialmente más graves en términos de complicaciones) afectan sólo la aorta ascendente o la ascendente y la descendente se denominan como tipo A. Las lesiones que no afectan la aorta ascendente y, casi siempre, comienzan en un punto distal a la arteria subclavia se consideran del tipo B3. Otra forma de clasificar las disecciones aórticas es con base en el tiempo de inicio, como agudas o crónicas.
Las disecciones crónicas se definen como la persistencia del colgajo o el conducto de disección más de 2 semanas después del fenómeno inicial. Cuando el compromiso está en la aorta ascendente, la expansión de la pared aórtica puede afectar el cierre de la válvula aórtica. Además, existe el riesgo de ruptura aórtica con desplazamiento de sangre al pericardio y compresión del corazón. Aunque la longitud de la disección varía, es posible que se afecte la aorta abdominal, con progresión a las arterias renales, iliacas o femorales. La oclusión parcial o completa de las arterias que nacen del cayado aórtico, o las arterias intercostales o lumbares puede producir un accidente cerebrovascular, neuropatía periférica isquémica o alteración del flujo sanguíneo a la médula espinal.
Manifestaciones clínicas
Un síntoma principal de un aneurisma disecante es la aparición súbita de dolor intensísimo, descrito como un desgarrador o cortante. La localización del dolor puede señalar el sitio de disección. El dolor de la disección en la aorta ascendente a menudo se localiza en el pecho y el causado por la disección de la aorta descendente muchas veces se localiza en la espalda. En las etapas iniciales, la presión arterial muestra un aumento moderado o intenso. Más tarde, la presión arterial y la frecuencia del pulso se vuelven inmensurables en uno o ambos brazos, conforme la disección interrumpe el flujo arterial a los brazos. Es posible que haya síncope, hemiplejía o parálisis de las extremidades inferiores por la oclusión de los vasos sanguíneos que irrigan el cerebro o la médula espinal. Cuando se afecta la válvula aórtica, es posible que haya insuficiencia cardíaca.
Diagnóstico y tratamiento
El diagnóstico de la disección aórtica se basa en el interrogatorio y la exploración física. La angiografía aórtica, ecocardiografía transesofágica e IRM ayudan al diagnóstico.
El tratamiento del aneurisma disecante de la aorta puede ser médico o quirúrgico, según el tipo y el tiempo de evolución, aguda o crónica. Como la disección aórtica es una urgencia que pone en peligro la vida, se inicia la estabilización médica de las personas con diagnóstico probable, incluso antes de confirmarlo. Dos factores importantes que participan en la extensión de la disección son la presión arterial alta y la pendiente de la onda del pulso. Sin intervención, estas fuerzas continúan la extensión de la disección. Por lo tanto, el tratamiento médico se enfoca que el control de la hipertensión y el empleo de fármacos que reducen la fuerza de la expulsión sanguínea sistólica del corazón. Dos fármacos de utilización frecuente, a menudo combinados, son nitroprusiato sódico intravenoso y un bloqueador β-adrenérgico. El tratamiento quirúrgico consiste en resección del segmento afectado de la aorta y reemplazo con un injerto prostético. La tasa de mortalidad por un aneurisma disecante no tratado es alta.