02. Trastornos de la frecuencia y la conducción cardíacas
Existen 2 tipos de trastornos del sistema de conducción cardíaca: trastornos de la frecuencia y trastornos en la conducción del impulso. Existen muchas causas de arritmias cardíacas y trastornos de la conducción que incluyen defectos congénitos o cambios degenerativos en el sistema de conducción; isquemia e infarto de miocardio; desequilibrios hidroelectrolíticos; y efectos de fármacos. Las arritmias no siempre son patológicas, puede ocurrir en corazones sanos o enfermos.
El efecto nocivo de los trastornos de la frecuencia cardíaca deriva de la interferencia con la capacidad de bombeo del corazón. La frecuencia cardíaca demasiado rápida (taquiarritmia) reduce el tiempo de llenado diastólico que, a su vez, disminuye el volumen por latido y la perfusión coronaria, además de incrementar la necesidad miocárdica de oxígeno. La frecuencia cardíaca demasiado lenta (bradiarritmia) afecta el flujo sanguíneo a los órganos vitales, como el cerebro.
Mecanismos de arritmias y trastornos de la conducción
Las células especializadas en el sistema de conducción tienen 4 propiedades inherentes que contribuyen al origen de todas las frecuencias cardíacas normales y anómalas: automatismo, excitabilidad, conductividad y carácter refractario. Una alteración en cualquiera de estas 4 propiedades puede generar arritmias o defectos en la conducción.
La capacidad de ciertas células del sistema de conducción para iniciar un impulso o potencial de acción de manera espontánea se conoce como automatismo. El nodo SA tiene una frecuencia inherente de descarga de 60 veces/min a 100 veces/min. En condiciones normales actúa como marcapasos del corazón porque alcanza el umbral de excitación antes que otras partes del sistema de conducción se hayan recuperado lo suficiente para despolarizarse. Si el nodo SA se descarga con más lentitud o se bloquea su conducción, otro sitio con capacidad de automatismo funciona como marcapasos. Otras regiones con esta capacidad son las fibras auriculares que tienen potenciales de acción tipo meseta, el nodo AV, el haz de His y las fibras de la rama de Purkinje. Estos marcapasos tienen una menor velocidad de descarga que el nodo SA. La frecuencia de descarga del nodo AV es de 40 veces/min a 60 veces/min y el sistema de Purkinje se descarga a una frecuencia de 15 veces/min a 40 veces/min. Es posible que aunque el nodo SA funcione en forma adecuada, existan factores que determinen que otras células cardíacas adquieran una propiedad de automatismo y comiencen a generar impulsos. Estos factores incluyen lesión, hipoxia, trastornos electrolíticos, crecimiento o hipertrofia de aurículas y ventrículos, exposición a ciertos agentes químicos o fármacos.
Un marcapasos ectópico es un foco excitable fuera del nodo SA normal. Estos marcapasos pueden encontrarse en otras partes del sistema de conducción o en las células musculares de las aurículas o ventrículos. Una contracción prematura se produce cuando un marcapasos ectópico inicia un latido. Las contracciones prematuras no siguen las vías de conducción normales, no están acopladas con los fenómenos mecánicos normales y a menudo vuelven al corazón refractario o incapaz de responder al siguiente impulso normal generado en el nodo SA. Ocurren sin contratiempos en personas con corazón normal como respuesta a estímulos del sistema nervioso simpático u otros estimulantes, como la cafeína. En el corazón enfermo, las contracciones prematuras pueden dar lugar a arritmias más graves.
La excitabilidad describe la capacidad de una célula para responder a un impulso y generar un potencial de acción. Las células miocárdicas lesionadas o sustituidas por tejido cicatricial no conservan la excitabilidad normal. Por ejemplo, durante la fase aguda de un incidente isquémico, las células afectadas se despolarizan. Estas células isquémicas mantienen el vínculo eléctrico con al área no isquémica adyacente; la corriente de la zona isquémica puede inducir una nueva excitación de las células de la zona no isquémica.
La conductividad es la capacidad para conducir impulsos y el carácter refractario se refiere al grado en que la célula puede responder a un estímulo entrante. El período refractario del músculo cardíaco es el intervalo en el período de repolarización durante el cual una célula excitable no se ha recuperado lo suficiente para estimularse de nuevo. Los trastornos en la conductividad o en el carácter refractario predisponen a las arritmias.
Este fenómeno, conocido como reentrada, es la causa de muchas taquiarritmias. En condiciones normales, un impulso eléctrico se conduce por el corazón en forma secuencial y ordenada. A continuación, el impulso eléctrico se desvanece y no reingresa al tejido adyacente porque éste ya se despolarizó y es refractario a la estimulación inmediata. Sin embargo, las fibras que no se activaron durante la ola inicial de despolarización pueden recuperar la excitabilidad antes que los impulsos iniciales se desvanezcan y pueden servir como vínculo para estimular de nuevo las áreas del corazón recién descargadas y que ya se recuperaron de la despolarización inicial. Esta actividad altera la secuencia normal de conducción. Para que exista la reentrada debe haber áreas con conducción lenta y un bloqueo de conducción unidireccional (figura 33-8).
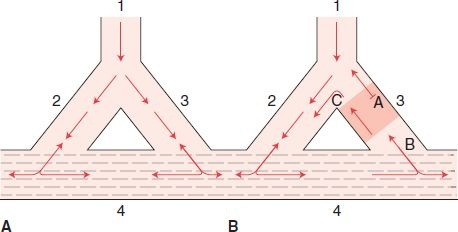
Para que las zonas ya despolarizadas se repolaricen de manera adecuada y puedan conducir un impulso de nuevo, es necesaria la conducción lenta. Se requiere un bloqueo unidireccional para que exista una vía de un solo sentido a fin de que reingrese el impulso original, con lo que bloquea la entrada de otros impulsos en sentido contrario que extinguirían el circuito de reentrada. La reentrada necesita un estímulo desencadenante, como una extrasístole, para iniciar el circuito. Si ya pasó tiempo suficiente para que termine el período refractario en el área de reentrada, puede iniciarse un movimiento cíclico que se perpetúa a sí mismo y se produce una arritmia.
La reentrada puede ocurrir en cualquier punto del sistema de conducción. Los componentes funcionales de un circuito de reentrada pueden ser grandes e incluir un sistema de conducción especializada completo, o puede tratarse de un circuito microscópico. Puede incluir tejido miocárdico, células del nodo AV, tejido de la unión o los ventrículos. Los factores que contribuyen al desarrollo de un circuito de reentrada incluyen isquemia, infarto y aumento en la concentración de potasio. El tejido cicatricial interrumpe las vías normales de baja resistencia entre las células miocárdicas viables, lo que ralentiza la conducción, induce la activación miocárdica asincrónica y predispone al bloqueo de conducción unidireccional. Existen varias formas de reentrada. La primera es la reentrada anatómica. Incluye un obstáculo anatómico alrededor del cual debe pasar la corriente circulante y genera una onda de estimulación que trascurre por una vía establecida. Las arritmias que surgen como resultado de una reentrada anatómica son taquiarritmias supraventriculares paroxísticas, como se ve en el síndrome de Wolff-Parkinson-White, FA, flúter auricular, reentrada nodal AV y algunas taquicardias ventriculares. La reentrada funcional no depende de una estructura anatómica para establecer el ciclo, sino de las diferencias locales en la velocidad de conducción y el carácter refractario entre las fibras vecinas que permiten la circulación repetida de un impulso alrededor de una zona. Se inicia por una onda de corriente que no se propaga de manera normal después de encontrar el tejido refractario. El extremo roto de la onda se desvía en espiral, forma un vórtice y gira de manera permanente.
Este fenómeno suprime la actividad de marcapasos normal y puede causar FA. Es probable que las arritmias con reentrada funcional sean polimórficas debido a los circuitos cambiantes. En ocasiones, la reflexión se considera otra forma de reentrada, puede ocurrir en vías paralelas de tejido miocárdico o la red de Purkinje. En caso de reflexión, el impulso cardíaco llega a una zona con conducción disminuida, activa al tejido circundante y luego regresa en sentido retrógrado a través de una región muy deprimida. La reflexión difiere de la reentrada real en que el impulso se desplaza por la misma vía en ambos sentidos y no requiere un circuito.
Tipos de arritmias y trastornos de la conducción
Arritmias del nodo sinusal
En el corazón sano activado por descargas del nodo sinusal, la frecuencia varía entre 60 lpm y 100 lpm. En la ECG puede observarse una onda P previa a cada complejo QRS. La frecuencia sinusal normal se considera la frecuencia «normal» de un corazón sano. En la frecuencia sinusal normal, la una onda P precede a todos los complejos QRS y los intervalos R-R se mantienen constantes en el tiempo (figura 33-9). Las alteraciones en la función del nodo SA inducen cambios en la frecuencia o ritmo del latido cardíaco.
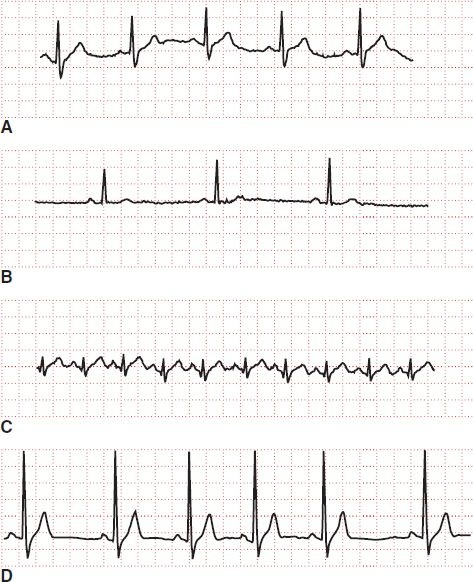
Por ejemplo, la arritmia sinusal respiratoria es una frecuencia cardíaca caracterizada por enlentecimiento y acortamiento graduales de los intervalos R-R (figura 33-9). Esta variación en los ciclos cardíacos se relaciona con los cambios en la presión intratorácica ocurridos durante la respiración y con las alteraciones en el control autonómico del nodo SA. La inspiración aumenta la frecuencia cardíaca y la espiración la reduce; no amerita tratamiento alguno. La arritmia sinusal respiratoria explica la mayor parte de la variabilidad en la frecuencia cardíaca de las personas sanas.
Dicha variabilidad es la modificación latido a latido de la señal cardíaca y se considera un signo del balance del sistema nervioso autónomo. La reducción de la variabilidad en la frecuencia cardíaca se vincula con trastornos como el IM, insuficiencia cardíaca, hipertensión, angina estable, diabetes mellitus y enfermedad pulmonar obstructiva crónica (EPOC).
Bradicardia sinusal
La bradicardia sinusal describe una frecuencia cardíaca baja (<60 lpm) (figura 33-9). En la bradicardia sinusal, una onda P precede a cada complejo QRS. La onda P e intervalo PR (0,12 s a 0,20 s) normales indican que el impulso se originó en el nodo SA, no en otra área del sistema de conducción con una frecuencia inherente menor. La estimulación vagal y ciertos medicamentos disminuyen la frecuencia de descargas del nodo SA y la conducción por el nodo AV, por lo que reducen la frecuencia cardíaca. Esta frecuencia puede ser normal en atletas entrenados, que mantienen un volumen por latido más grande, y durante el sueño. Por lo general, la bradicardia sinusal es benigna, a menos que se acompañe de descompensación metabólica. También puede ser una indicación de mal pronóstico cuando se presenta en el IM agudo y después de la reanimación de un paro cardíaco.
Pausa o paro sinusal
El paro sinusal se refiere a la falta de descargas del nodo SA y causa irregularidad del pulso. Se desarrolla una frecuencia de escape cuando otro marcapasos toma el control. El paro sinusal puede causar períodos prolongados de asistolia y a menudo predispone a otras arritmias. Las causas de paro sinusal incluyen enfermedad del nodo SA, toxicidad por digital, accidente cerebrovascular, IM, miocarditis aguda, tono vagal excesivo, apnea durante el sueño, quinidina, lidocaína, hiperpotasemia e hipopotasemia.
Bloqueo de salida sinusal
El bloqueo de salida sinusal ocurre cuando el nodo sinusal no despolariza las aurículas. Hay 3 tipos de bloqueos de salida sinusal: bloqueo de salida tipo I, tipo II y completo. En el bloqueo de salida tipo I, el intervalo P-P se acorta antes de la pausa. El bloqueo de salida tipo II se parece al paro sinusal, excepto por el intervalo P-P. Los intervalos durante el bloqueo de salida sinusal son múltiplos exactos del ciclo sinusal. El bloqueo de salida sinusal completo es la ausencia de ondas P y es difícil de diagnosticar porque es semejante al paro sinusal. Por lo general, el bloqueo de salida sinusal es corto, sólo se requiere tratamiento si es prolongado y causa síntomas.
Taquicardia sinusal
La taquicardia sinusal se refiere a la frecuencia cardíaca elevada (>100 lpm) originada en el nodo SA (figura 33-9). El complejo QRS debe ir acompañado de una onda P e intervalo PR normales. El mecanismo de la taquicardia sinusal es el incremento del automatismo derivado de la estimulación simpática o la eliminación del tono vagal. La taquicardia sinusal es una respuesta normal durante la fiebre, pérdida sanguínea, ansiedad, dolor y ejercicio, así como en situaciones que inducen la estimulación simpática. Puede relacionarse con insuficiencia cardíaca congestiva, IM e hipertiroidismo. También puede deberse al consumo de fármacos como atropina, isoproterenol, epinefrina y quinidina.
Síndrome de seno enfermo
Síndrome de seno enfermo (SSE) es un término que describe varias formas de generación del impulso cardíaco y alteraciones en la conducción intraauricular y AV. Las causas más frecuentes del síndrome es la destrucción total o casi total del nodo SA; zonas de discontinuidad nodal-auricular; cambios inflamatorios o degenerativos de los nervios y ganglios que rodean al nodo; y cambios patológicos en la pared auricular. Además, la oclusión del la arteria del nodo sinusal puede ser un factor contribuyente significativo. El SSE casi siempre es idiopático, aunque puede encontrarse en pacientes con enfermedad arterial coronaria, procesos infecciosos con fibrosis, por el consumo de ciertos fármacos y en enfermedades vasculares de colágeno. En los niños, el síndrome casi siempre se relaciona con anomalías cardíacas congénitas, en particular después de la cirugía cardíaca correctiva.
Las arritmias vinculadas con el SSE incluyen bradicardia sinusal persistente espontánea que no va acorde con las circunstancias fisiológicas; paro sinusal prolongado o bloqueo de salida sinusal; combinaciones de trastornos en la conducción del nodo SA o el AV; o paroxismos alternados de taquiarritmias auriculares regulares o irregulares y con períodos de frecuencias auriculares o ventriculares bajas (síndrome bradicardia-taquicardia). Lo más frecuente es que el término síndrome del seno enfermo se use para referirse al síndrome de bradicardia-taquicardia. La bradicardia se debe a la enfermedad del nodo sinusal (u otras vías de conducción intraauriculares) y la taquicardia se produce por arritmias auriculares paroxísticas o de la unión. Las personas con este síndrome a menudo permanecen asintomáticas. Las manifestaciones más frecuentes del SSE son sensación de desmayo, mareo y síncope, y estos síntomas se deben a las bradiarritmias. Cuando los pacientes con SSE experimentan palpitaciones, casi siempre son resultado de las taquiarritmias y sugieren la presencia de síndrome de bradicardia-taquicardia.
El tratamiento depende del trastorno de la frecuencia y a menudo incluye la implantación de un marcapasos permanente. En el síndrome bradicardia-taquicardia a menudo es necesario el control de la frecuencia por bradicardia, combinado con tratamiento farmacológico para corregir la taquicardia. Los medicamentos que influyen en la descarga del nodo SA deben consumirse con cautela si no se implanta un marcapasos.
Arritmias de origen auricular
Los impulsos del nodo SA pasan por las vías de conducción de las aurículas al nodo AV. Las arritmias de origen auricular incluyen contracciones auriculares prematuras (CAP), taquicardia auricular multifocal focal, flúter auricular y FA (figura 33-10).
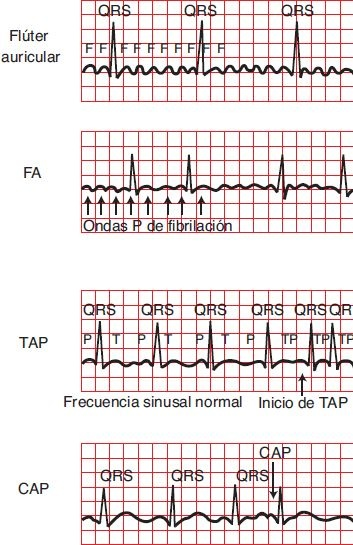
Contracciones auriculares prematuras
Las CAP son contracciones que se originan en las vías de conducción auricular o en las células miocárdicas auriculares y ocurren antes del siguiente impulso esperado del nodo SA. Este impulso para la contracción casi siempre se transmite al ventrículo y de vuelta al nodo SA. La localización del foco ectópico determina la configuración de la onda P. En general, mientras más cerca esté el foco ectópico del nodo SA, más se parece el complejo ectópico al complejo sinusal normal. La transmisión retrógrada al nodo SA a menudo interrumpe el momento la programación del siguiente latido sinusal, por lo que hay una pausa entre los 2 latidos conducidos de manera normal. En personas sanas, las CAP pueden ser resultado de estrés, consumo de alcohol, tabaco o cafeína. También se relacionan con IM, toxicidad por digital, concentraciones séricas bajas de potasio o magnesio e hipoxia.
Taquicardia auricular multifocal y focal
La taquicardia auricular multifocal es resultado de la descarga en varios focos ectópicos en la aurícula, lo que genera al menos 3 morfologías distintivas de la onda P a una velocidad mayor de 100 lpm. Como esta frecuencia es irregularmente irregular, puede confundirse con FA. Por lo general, se observa en adultos de edad avanzada con EPOC, hipoxia y trastornos electrolíticos. La base para la corrección de la frecuencia es tratar la causa subyacente.
La taquicardia auricular focal tiene una frecuencia de 100 lpm a 250 lpm, originada en el miocardio auricular. Proviene de un solo foco en la aurícula derecha o izquierda. Puede denominarse taquicardia auricular paroxística (TAP) porque comienza y termina de manera súbita. La taquicardia auricular incesante que dura más de 12 h puede ser más dañina debido a la frecuencia ventricular rápida que la acompaña. Por lo general, se relaciona con consumo de cafeína o alcohol; valvulopatía mitral; cardiopatía reumática; IM agudo; EPOC; hipopotasemia; y toxicidad por digital. Puede corregirse mediante la identificación de la causa subyacente, con antiarrítmicos o, lo anterior falla, con ablación por catéter de radiofrecuencia del foco ectópico generador der la taquicardia auricular.
Flúter auricular
El flúter auricular es la taquicardia auricular ectópica rápida, con frecuencia de 2 409 lpm a 450 lpm. Existen 2 tipos de flúter auricular. La forma típica (a veces llamada tipo I) es resultado de la frecuencia de reentrada en la aurícula derecha que puede captarse e interrumpirse con técnicas de control de la frecuencia auricular. La frecuencia auricular en el flúter tipo I suele ser cercana a 300 lpm, aunque varía desde 240 lpm a 340 lpm. Otras formas de flúter auricular (el llamado flúter atípico o de tipo II) ahora se reconocen como tipos distintivos e incluyen una macro reentrada auricular causada por cicatrices quirúrgicas, fibrosis idiopática en zonas de la aurícula u otras barreras anatómicas o funcionales en las aurículas. Como las barreras que limitan estas formas de flúter son variables, el patrón ECG del flúter atípico es diverso. A menudo, la onda de flúter cambia de morfología durante el mismo episodio de arritmia, lo que indica múltiples circuitos o barreras variables a la conducción.
En el flúter auricular típico, la ECG revela un patrón definido en dientes de sierra en las derivaciones aVF, V1 y V5. La frecuencia y la regularidad de la respuesta ventricular son variables y dependen de la secuencia de conducción AV. Cuando es regular, la frecuencia de respuesta casi siempre es una fracción definida de la frecuencia auricular (ej. cuando la conducción de las aurículas a los ventrículos es 2:1, una frecuencia de flúter auricular de 300 genera una frecuencia de respuesta ventricular de 150 lpm). El complejo QRS puede ser normal o no, según la presencia o ausencia de defectos preexistentes en la conducción ventricular o de conducción ventricular anómala.
El flúter auricular rara vez se encuentra en personas sanas. Puede encontrarse en sujetos de cualquier edad en presencia de alteraciones auriculares subyacentes. Los grupos con un riesgo elevado particular para desarrollar flúter auricular incluyen niños, adolescentes y adultos jóvenes que se sometieron a cirugía correctiva para cardiopatías congénitas complejas.
Fibrilación auricular
La fibrilación auricular (FA) se describe como la activación auricular desorganizada rápida y contracciones descoordinadas de las aurículas. En la mayoría de los casos surgen múltiples circuitos de reentrada pequeños de manera constante en las aurículas que colisionan, se extinguen y surgen de nuevo. La fibrilación se produce cuando las células auriculares no pueden repolarizarse a tiempo para el siguiente estímulo. En la ECG, la FA se observa como un patrón muy desorganizado de actividad eléctrica auricular, irregular en cuanto a ritmo y frecuencia, con ausencia de ondas P discernibles. La actividad auricular se manifiesta por ondas de fibrilación (f) de amplitud, duración y morfología variables. Estas ondas f aparecen como una oscilación aleatoria en la línea basal. Debido a la conducción aleatoria por el nodo AV, los complejos QRS aparecen con un patrón irregular.
La FA se clasifica en 3 categorías: paroxística, persistente y permanente. La FA paroxística se termina por sí sola y no dura más de 7 días, mientras que la persistente dura más de 7 días y casi siempre amerita intervención, como la cardioversión. La FA se considera permanente cuando fallan los intentos para terminarla y el paciente permanece en FA. Durante la FA, la frecuencia auricular casi siempre varía entre 400 lpm y 600 lpm, con muchos impulsos bloqueados en el nodo AV. La respuesta ventricular es del todo irregular, varía entre 80 lpm y 180 lpm sin tratamiento. Debido a los cambios en el volumen por latido derivados de los períodos variables de llenado diastólico, no todos los latidos ventriculares producen un pulso palpable. La diferencia entre la frecuencia apical y los pulsos periféricos palpables se llaman deficiencias del pulso. La deficiencia del pulso aumenta cuando la frecuencia ventricular es alta.
La FA puede encontrarse en personas sin enfermedad aparente o en pacientes con enfermedad coronaria, valvulopatía mitral, cardiopatía isquémica, hipertensión, IM, pericarditis, insuficiencia cardíaca congestiva, toxicidad por digital e hipertiroidismo. Es frecuente la conversión espontánea a frecuencia sinusal en menos de 24 h después del inicio de la FA, ocurre hasta en 2 tercios de las personas con este trastorno. Si la duración de la FA es mayor de 24 h, la probabilidad de conversión disminuye y después de una semana de arritmia persistente, la conversión espontánea es rara.
La FA es la arritmia crónica más frecuente, la incidencia y prevalencia aumentan con la edad. Por ejemplo, ocurre en menos del 0,5% de la población menor de 50 años de edad y aumenta en 2% entre los 60 y 69 años de edad. La prevalencia es más alta en varones que en mujeres.
Los síntomas de la FA varían. Algunos pacientes tienen síntomas mínimos, otros tienen síntomas graves, sobre todo al principio de la arritmia. Los síntomas varían desde palpitaciones hasta edema pulmonar agudo. Son frecuentes la fatiga y otros síntomas inespecíficos en los adultos mayores. Este trastorno predispone al sujeto a la trombosis en las aurículas, con el riesgo consecuente de accidente cerebrovascular embólico.
El tratamiento de la FA depende de la causa, la forma de inicio y la persistencia. Puede tratarse con fármacos antiarrítmicos para controlar la frecuencia o convertir a frecuencia sinusal. Además, pueden utilizarse anticoagulantes para prevenir el accidente cerebrovascular embólico, según el riesgo de esta complicación. Puede considerarse la cardioversión en algunas personas, sobre todo en caso de edema pulmonar o estado cardíaco inestable. Como la conversión la frecuencia sinusal se relaciona con un aumento en el riesgo de tromboembolia, casi siempre se administra un anticoagulante durante al menos 3 semanas antes de intentar la cardioversión en pacientes en los que la duración de la FA se desconoce o es mayor de 2 a 3 días. Puede emplearse la ecocardiografía transesofágica para detectar un trombo auricular y la cardioversión guiada con esta técnica de imagen es una forma de asegurar la ausencia de trombos auriculares cuando se intente la cardioversión. Por lo general, el anticoagulante se continúa después de la cardioversión.
Taquicardia supraventricular paroxística
La taquicardia supraventricular paroxística se refiere a las taquiarritmias que se originan antes de la bifurcación del haz de His, el inicio y la terminación son súbitos. La frecuencia cardíaca puede ser de 140 lpm a 240 lpm y, en ocasiones, mantiene la regularidad a pesar del ejercicio o el cambio de posición. La mayoría de los pacientes permanece asintomático, salvo por la conciencia del latido cardíaco rápido, pero algunos experimentan disnea, sobre todo si los episodios son prolongados. El mecanismo más frecuente de la taquicardia supraventricular paroxística es la reentrada. Es probable que se deba a la reentrada nodal AV, síndrome de Wolff-Parkinson-White (causado por una vía de conducción accesoria entre las aurículas y los ventrículos) o la reentrada intraauricular o en el nodo sinusal.
Arritmias de la unión
El nodo AV puede actuar como marcapasos en caso que el nodo SA no inicie un impulso. Las frecuencias de la unión pueden ser transitorios o permanentes, y casi siempre generan una frecuencia de 40 lpm a 60 lpm. Las fibras de la unión en el nodo AV o el haz de His también pueden actuar como marcapasos ectópicos, producen complejos de la unión prematuros. Otra frecuencia que se origina en los tejidos de la unión es la taquicardia de la unión no paroxística. Esta frecuencia casi siempre es de inicio y terminación graduales, aunque puede aparecer en forma abrupta si el marcapasos dominante es lo bastante lento. La frecuencia relacionada con la taquicardia de la unión varía entre 70 lpm y 130 lpm, aunque puede ser mayor. Las ondas P pueden preceder, quedar ocultas en el complejo o seguir al complejo QRS, según el sitio donde se originen los impulsos. La relevancia clínica de la taquicardia de la unión no paroxística es la misma que para las taquicardias auriculares. La ablación con catéter se ha usado con éxito en el tratamiento de algunos pacientes con taquicardia de la unión recurrente o intratable por otros medios. La taquicardia de la unión no paroxística es más frecuente en personas con cardiopatía subyacente, como IM de la pared inferior o miocarditis, o después de una cirugía cardíaca abierta. También puede encontrarse en caso de toxicidad por digital.
Trastornos de la conducción y frecuencia ventricular
Las fibras de la unión en el nodo AV se acoplan al haz de His, que se divide para formar las ramas derecha e izquierda del haz. Las ramas del haz se dividen más y forman las fibras de Purkinje, que se distribuyen por las paredes de los ventrículos (figura 33-1).
Cuando el impulso cardíaco sale de las fibras de la unión, se propaga por el haz AV. A continuación, el impulso desciende por las ramas derecha e izquierda del haz que se disponen debajo del endocardio a ambos lados del tabique. Luego se extienden por las paredes de los ventrículos. La interrupción en la conducción del impulso por las ramas del haz se denomina bloqueo de rama. Por lo general, estos bloqueos no alteran la frecuencia ni los latidos cardíacos, sino que el bloqueo de rama interrumpe el avance normal de la despolarización, por lo que un ventrículo se despolariza después del otro porque los impulsos trascurren por el tejido muscular en lugar del tejido de conducción especializado. Esta conducción prolongada hace que el complejo QRS sea más ancho de los 0,08 s a 0,12 s normales. La rama izquierda del haz se bifurca en los fascículos izquierdos anterior y posterior. La interrupción de uno de estos fascículos se conoce como hemibloqueo.
Síndrome de QT largo y taquicardia helicoidal
El síndrome de QT largo (SQTL) se caracteriza por la prolongación del intervalo QT, lo que puede generar un tipo característico de taquicardia ventricular polimórfica llamada taquicardia helicoidal y muerte súbita cardíaca. La taquicardia helicoidal (porque «gira o rota alrededor de un punto») es un tipo específico de taquicardia ventricular (figura 33-11). El término se refiere a la polaridad del complejo QRS, que cambia de positiva a negativa y viceversa. La anomalía del complejo QRS se caracteriza por complejos QRS grandes, anómalos, polimórficos que varían en amplitud y dirección, a menudo de un latido al siguiente, además de la rotación de los complejos alrededor de la línea isoeléctrica. La frecuencia en esta taquicardia es de 100 lpm a 180 lpm, aunque puede llegar hasta 200 lpm a 300 lpm. La frecuencia es muy inestable y puede conducir a la fibrilación ventricular o revertirse a frecuencia sinusal.

Varios fármacos y condiciones que reducen la magnitud de las corrientes salientes de potasio repolarizadoras e intensifican la magnitud del flujo entrante despolarizante de sodio y calcio pueden causar SQTL. Por tanto, se retrasa la repolarización de los ventrículos con desarrollo de pospoteciales de despolarización temprana que inician la arritmia. Por lo general, el intervalo QT se mide en una derivación en la que la onda T sea prominente, como V2 o V3. Como el intervalo QT se acorta con la taquicardia y se prolonga con la bradicardia, casi siempre se corrige respecto a la frecuencia cardíaca y se indica como QTc. No obstante, un QTc mayor de 440 ms en varones o de 460 ms en mujeres se relaciona con episodios de síndromes de muerte súbita por arritmia. Además, con frecuencia la morfología de la onda T es anómala en los sujetos con SQTL.
El SQTL se clasifica en las formas hereditaria y adquirida, ambas relacionadas con el desarrollo de taquicardia helicoidal y muerte súbita cardíaca. Las formas hereditarias de SQTL se deben a trastornos en las proteínas de conductos iónicos de la membrana, existen defectos en el conducto del potasio o en el conducto del sodio.
El SQTL adquirido se vincula con diversas condiciones, como el consumo de cocaína, exposición a compuestos organofosforados, desequilibrios electrolíticos, bradicardia marcada, IM, hemorragia subaracnoidea, neuropatía autonómica, infección con el virus de inmunodeficiencia humana y ayuno con ahorro de proteínas. Los medicamentos relacionados con el SQTL incluyendigital, antiarrítmicos (ej. amiodarona, procainamida y quinidina), verapamilo (bloqueador del conducto de calcio), haloperidol (antipsicótico) y eritromicina (antibiótico). Las formas adquiridas del SQTL a menudo se clasifican como dependientes de pausa porque la taquicardia helicoidal derivada de ellas casi siempre ocurren con frecuencias cardíacas bajas o como respuesta a secuencias de intervalo R-R corto-largo-corto. El tratamiento de las formas adquiridas del SQTL se enfoca sobre todo en la identificación y eliminación del agente nocivo, aunque las medidas de emergencia que modulan la función de las corrientes iónicas transmembranarias pueden salvar la vida del paciente.
Arritmias ventriculares
Las arritmias que se originan en los ventrículos casi siempre se consideran más graves que las generadas en las aurículas porque conllevan la posibilidad de interferir con la acción de bombeo del corazón.
Contracciones ventriculares prematuras
Una contracción ventricular prematura (CVP) se produce por un marcapasos ventricular ectópico.
Después de la CVP, el ventrículo casi siempre es incapaz de repolarizarse lo suficiente para responder al siguiente impulso proveniente del nodo SA. Este retraso, a menudo denominado pausa compensatoria, ocurre mientras el ventrículo puede restablecer su frecuencia previa (figura 33-12).
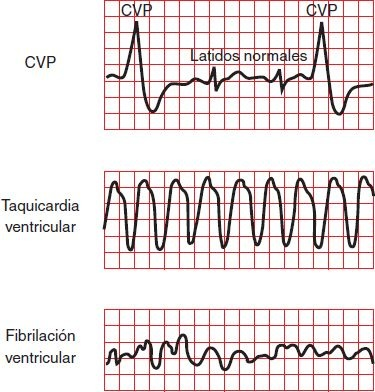
Cuando se produce una CVP, el volumen diastólico casi siempre es insuficiente para la expulsión al sistema arterial; por lo tanto, la CVP casi nunca genera un pulso variable o la amplitud del pulso está muy disminuida. EN ausencia de cardiopatía, las CVP casi siempre carecen de relevancia clínica. La incidencia de las CVP es mayor en presencia de isquemia, IM agudo, antecedente de IM, hipertrofia ventricular, infección, aumento en la actividad del sistema nervioso simpático o aumento de la frecuencia cardíaca. También pueden ser resultado de trastornos electrolíticos o medicamentos.
Existe un patrón especial de CVP llamado bigeminismo ventricular en el que cada latido normal va seguido de una CVP. Este patrón a menudo es indicación de toxicidad por digital o cardiopatía. La presencia de CVP frecuentes en el corazón enfermo predispone al desarrollo de otras arritmias más graves, como taquicardia ventricular y fibrilación ventricular.
Taquicardia ventricular
La taquicardia ventricular describe una frecuencia cardíaca originada después de la bifurcación del haz de His, en el sistema de conducción especializado del músculo ventricular o en ambos. Se caracteriza por una frecuencia ventricular de 70 lpm a 250 lpm; el inicio puede ser súbito o insidioso. Por lo general, la taquicardia ventricular se manifiesta en la ECG por complejos QRS anchos, altos y anómalos que persisten más de 0,12 s (figura 33-12). Los complejos QRS pueden tener apariencia uniforme (monomórficos) o pueden variar al azar, en forma repetitiva (ej. taquicardia helicoidal), con un patrón alternado (ej. bidireccional) o en forma estable, pero cambiante, en cuyo caso se denominan polimórficos. La taquicardia ventricular puede ser sostenida, cuando dura más de 30 s y amerita intervención, o no sostenida y se termina en forma espontánea. Esta frecuencia es peligrosa porque elimina el impulso auricular y puede reducir el tiempo de llenado diastólico hasta el grado que el gasto cardíaco esté muy disminuido o sea inexistente.
Flúter y fibrilación ventriculares
Estas arritmias son trastornos graves de la frecuencia cardíaca que causan la muerte en minutos, a menos que se tomen pronto medidas correctivas. El patrón ECG en el flúter ventricular tiene forma de onda sinusoidal, con grandes oscilaciones a una frecuencia de 150 lpm a 300 lpm. En la fibrilación ventricular, el ventrículo tiembla, pero no se contrae. El patrón ECG típico de la fibrilación ventricular es de desorganización evidente sin ondas ni intervalos identificables (figura 33-12). Cuando los ventrículos no se contraen, no existe gasto cardíaco y no hay pulsos palpables o audibles. Es obligatoria la desfibrilación inmediata con un shock eléctrico de corriente directa no sincronizada para la fibrilación ventricular y para el flúter ventricular que produjo pérdida de la conciencia.
Trastornos de la conducción auriculoventricular
En condiciones normales, la unión AV, consistente en el nodo AV con sus conexiones a las vías internodales auriculares entrantes, el haz AV y la parte no ramificada del haz de His, es la única vía para la transmisión de impulsos entre los sistemas de conducción auricular y ventricular. Las fibras de la unión en el nodo AV tienen características de alta resistencia que retrasan la transmisión de impulsos de las aurículas a los ventrículos. Este retraso proporciona el tiempo óptimo para la contribución auricular al llenado ventricular y protege a los ventrículos de las frecuencias demasiado rápidas originadas en las aurículas. Los defectos en la conducción del nodo AV casi siempre se relacionan con fibrosis o tejido cicatricial del sistema de conducción. Los defectos de conducción también pueden ser consecuencia de medicamentos, como la digoxina, bloqueadores β-adrenérgicos, bloqueadores del conducto de calcio y antiarrítmicos clase IA. Otros factores contribuyentes incluyen desequilibrios electrolíticos, IM agudo, fibrosis idiopática del sistema de conducción, enfermedad inflamatoria o cirugía cardíaca. Algunas causas menos frecuentes son trastornos infecciosos, autoinmunitarios, oncológicos y yatrógenos.
El bloqueo cardíaco es la alteración en la conducción del impulso. Puede ser normal, fisiológico (ej. tono vagal) o patológico. Es posible que se deba a un bloqueo en la conducción en la aurícula, en las fibras nodales AV o en el haz AV (haz de His), que se continúa con el sistema de conducción dePurkinje que se distribuye en los ventrículos. El intervalo PR de la ECG corresponde al tiempo que tarda el impulso cardíaco en pasar del nodo SA a las vías ventriculares. En condiciones normales, el intervalo PR varía de 0,12 s a 0,20 s.
Bloqueo AV de primer grado
El bloqueo AV de primer grado se caracteriza por intervalo PR prolongado (>0,20 s; figura 33-13). El intervalo PR prolongado indica retraso en la conducción AV, pero todos los impulsos auriculares se transmiten a los ventrículos. Esta condición casi siempre produce una frecuencia auricular y ventricular regular. La prolongación del intervalo PR con relevancia clínica puede producirse por retrasos en la conducción en el nodo AV mismo, en el sistema His-Purkinje o en ambos.
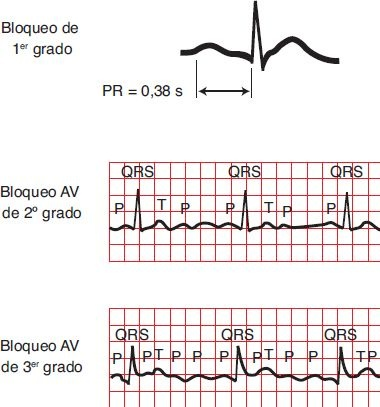
Cuando el complejo QRS tiene forma y duración normales, el retraso AV casi siempre se encuentra en el nodo AV, rara vez en el haz de His. En contraste, cuando el complejo QRS se ensancha, con patrón de bloqueo de rama, es probable que el retraso en la conducción se encuentre en el nodo AV o en el sistema His-Purkinje. El bloqueo de primer grado puede ser consecuencia de enfermedad en el nodo AV, como en la isquemia o infarto, o de infecciones como la fiebre reumática o la miocarditis. El bloqueo cardíaco de primer grado aislado casi nunca causa síntomas; no está indicado el control temporal o permanente de la frecuencia cardíaca, pero debe mantenerse bajo vigilancia.
Bloqueo AV de segundo grado
El bloqueo AV de segundo grado se caracteriza por insuficiencia intermitente en la conducción de uno o más impulsos de las aurículas a los ventrículos. La onda P no conducida puede aparecer de manera intermitente o frecuente. Un rasgo distintivo del bloqueo AV de segundo grado es que las ondas P conducidas se acompañan de complejos QRS con intervalos PR recurrentes; o sea, la relación de ondas P con complejos QRS no es aleatoria. El bloqueo AV de segundo grado se divide en 2 tipos: tipo I (Mobitz tipo I o fenómeno de Wenckebach) y tipo II (Mobitz tipo II). Un bloqueo AV Mobitz tipo I se caracteriza por la prolongación progresiva del intervalo PR hasta que se bloquea un impulso y la secuencia inicia de nuevo. A menudo ocurre en personas con IM de la pared inferior, sobre todo con infarto ventricular derecho concurrente. Este trastorno casi siempre se acompaña de una frecuencia ventricular adecuada y rara vez causa síntomas. Por lo general, es transitorio y no requiere control temporal de la frecuencia. En el bloqueo AV Mobitz tipo II, existe bloqueo intermitente de los impulsos auriculares, con intervalo PR constante (figura 33-13). A menudo acompaña al IM de la pared inferior y puede ameritar control temporal o permanente de la frecuencia. Este trastorno conlleva una elevada tasa de mortalidad. Además se relaciona con otros tipos de cardiopatía orgánica y muchas veces evoluciona al bloqueo cardíaco completo.
Bloqueo AV de tercer grado
El bloqueo AV de tercer grado, o completo, ocurre cuando se pierde el vínculo de la conducción entre las aurículas y los ventrículos, lo que hace que las despolarizaciones auriculares y ventriculares estén controladas por distintos marcapasos (figura 33,13). El marcapasos auricular puede ser sinusal o ectópico; el ventricular casi siempre se localiza justo debajo de la región del bloqueo. Por lo general, las aurículas conservan una frecuencia normal de latidos y los ventrículos desarrollan su propia frecuencia, que suele ser baja (30 lpm a 40 lpm). Las frecuencias auricular y ventricular son regulares, pero están disociadas. El bloqueo AV de tercer grado puede ser resultado de una interrupción en el nodo AV, en el haz de His o en el sistema de Purkinje. Los bloqueos de tercer grado en el nodo AV casi siempre son congénitos, mientras que los situados en el sistema de Purkinje suelen ser adquiridos. Por lo general, cuando el bloqueo es proximal al haz de His los complejos QRS son normales, con frecuencias de 40 lpm a 60 lpm complejos por min.
El bloqueo cardíaco completo reduce el gasto cardíaco, con posibilidad de episodios de síncope (desmayo), conocidos como ataque de Stokes-Adams. Otras manifestaciones incluyen mareo, fatiga, intolerancia al ejercicio o episodios de insuficiencia cardíaca aguda. La mayoría de las personas con bloqueo cardíaco completo requieren un marcapasos permanente.
Tipos hereditarios de arritmias
Por lo general, las arritmias ocurren en presencia de enfermedad cardíaca, trastornos electrolíticos u otras alteraciones demostrables. La cardiopatía isquémica es la principal causa de fibrilación ventricular y los defectos estructurales cardíacos, como las miocardiopatías hipertrófica y dilatada, explican la mayoría de los casos restantes. Sin embargo, entre los pacientes que durante muchos años tuvieron el diagnóstico de fibrilación ventricular idiopática, el 30% queda sin explicación después de la necropsia. En las últimas décadas se ha reunido evidencia considerable sugestiva de que estos casos implican alteraciones de origen genético en las proteínas de los conductos iónicos que controlan la actividad eléctrica del corazón. Al menos 9 genes se han vinculado con miocardiopatías arritmógenas y se espera que se identifiquen más y se relacionen con la muerte súbita en personas que tenían un corazón en apariencia sano. Entre los trastornos arritmógenos hereditarios están el SQTL, síndrome de QTcorto, síndrome de Brugada y taquicardia ventricular polimórfica catecolaminérgica.
Síndrome de QT largo congénito
El SQTL congénito es una enfermedad arritmógena hereditaria caracterizada por arritmias ventriculares que ponen en peligro la vida. Se han identificado cientos de mutaciones génicas en los 3 genes mayores y los 9 menores susceptibles para el SQTL. El rasgo ECG del SQTL consiste en un intervalo QT prolongado, morfología anómala de la onda T y una taquicardia ventricular polimórfica característica (taquicardia helicoidal). Por lo general, los síntomas aparecen en los primeros 20 años de vida, incluso en el período neonatal, en el que puede diagnosticarse de manera errónea como muerte súbita infantil. La gravedad de las manifestaciones clínicas del SQTL varían, van desde la enfermedad manifiesta con prolongación marcada del intervalo QT y síncope recurrente, hasta las formas subclínicas con prolongación limítrofe del intervalo QT, sin arritmias ni episodios de síncope.
Las formas hereditarias del SQTL casi siempre se consideran dependientes de la adrenalina porque casi siempre se desencadenan con el aumento en la actividad del sistema nervioso simpático. Según el gen afectado, a menudo son efectivos el tratamiento de largo plazo con bloqueadores del receptor β-adrenérgico, el control permanente de la frecuencia o la desnervación simpática cardíaca izquierda. Se recomienda la colocación de un cardioversor-desfibrilador implantable en personas con síncope recurrente, arritmias ventriculares sostenidas o paro cardíaco súbito a pesar del tratamiento.
Síndrome de QTcorto
El síndrome de QTcorto (SQTC) se describió por primera vez en 2000 y se caracteriza por un intervalo QT menor de 320 ms. Todavía hay pocos datos sobre este síndrome. Sin embargo, según la investigación realizada, la mayoría de las personas con este trastorno permanece asintomática y cerca del 25% tiene antecedente de síncope. Se han descubierto 5 genes susceptibles para el SQTC, pero aún no se aclaran las relaciones.
Síndrome de Brugada
Descrito por primera vez en 1992, el síndrome de Brugada es un trastorno autosómico dominante caracterizado por elevación del segmento ST en las derivaciones precordiales V1 a V3, bloqueo de rama derecha y susceptibilidad a la taquicardia ventricular. Hasta ahora se relaciona con un solo gen que codifica el conducto cardíaco para sodio. El trastorno casi siempre se manifiesta en el adulto con penetrancia muy incompleta y un alto porcentaje de portadores de la mutación permanece asintomático. Los incidentes cardíacos ocurren, por lo general, durante el sueño o el reposo. Aunque el trastorno se hereda como rasgo autosómico, entre los pacientes con manifestaciones existe una proporción 8:1 entre varones y mujeres.
Taquicardia ventricular polimórfica catecolaminérgica
La taquicardia ventricular polimórfica catecolaminérgica (TVPC) se describió por primera vez en 1978. Se informó que el trastorno se caracterizaba por taquicardia ventricular, síncope y muerte súbita en casos familiares o esporádicos en ausencia de enfermedad cardíaca o alteraciones ECG.
La ECG de los individuos con TVPC suele ser normal, salvo por bradicardia sinusal en algunos de ellos. La actividad física y las emociones súbitas son los desencadenantes específicos de arritmias en personas con TVPC. La complejidad de las arritmias aumenta de manera progresiva conforme se incrementa la poscarga, desde latidos prematuros aislados hasta bigeminismo y episodios de taquicardia ventricular. Aunque el diagnóstico clínico de TVPC es elusivo por la ausencia de hallazgos anómalos en la ECG, los análisis genéticos permiten identificar las mutaciones en cerca del 60% de las personas con el trastorno. Esto es muy importante porque sin tratamiento, este síndrome es maligno, aunque el pronóstico mejora mucho una vez que el problema se identifica de manera correcta y se implementa el tratamiento.
Un régimen antiadrenérgico con β-bloqueadores es la base terapéutica de la TVPC. Es necesario el empleo de un cardioversor-desfibrilador implantable cuando la prueba de esfuerzo y la vigilancia Holter indican que los β-bloqueadores no proporcionan una protección completa contra la arritmia.
Métodos diagnósticos
El diagnóstico de los trastornos de la frecuencia y la conducción cardíacas casi siempre se hace con base en la ECG superficial, vigilancia ECG Holter o registro ECG en ciclos implantable. Es posible aclarar mejor los defectos de la conducción y las arritmias con la prueba de esfuerzo físico y pruebas electrofisiológicas.
ECG superficial
La ECG superficial en reposo registra en la superficie del cuerpo los impulsos originados en el corazón. Estos impulsos se registran por un tiempo limitado y durante períodos de inactividad.
Aunque el procedimiento carece de complicaciones, los errores relacionados con un diagnóstico erróneo pueden generar enfermedad cardíaca yatrógena. La ECG en reposo es la primera herramienta para el diagnóstico clínico, pero se limita a los fenómenos que ocurren durante el período de vigilancia ECG.
La ECG con señal promediada es un tipo especial de ECG que se usa para detectar los potenciales de acción ventriculares tardíos que se consideran originados en las áreas de conducción lenta del miocardio. Los potenciales de acción tardíos ventriculares son ondas de baja amplitud y alta frecuencia en el complejo QRS terminal y persisten por décimas de milisegundos en el segmento ST. La presencia de potenciales tardíos indica un riesgo elevado de desarrollar taquicardia ventricular y muerte súbita cardíaca. Estos potenciales tardíos son detectables en las derivaciones de la ECG superficial cuando se hace el promedio de la señal.
La intención del promediado de la señal es reducir el ruido que dificulta el análisis de la ECG superficial. Esta técnica promedia múltiples muestras de las ondas QRS y crea un trazo que es el promedio de todas las señales repetitivas.
Se usa un filtro de paso alto para registrar los potenciales tardíos. Como resultado, cuando se combina varias señales que representan el mismo caso, se refuerza la señal coherente y el ruido se cancela.
El promedio de la señal es un proceso informatizado. La señal de cada electrodo se amplifica, se realiza un muestreo del voltaje o se mide a intervalos de 1 milisegundo o menos, y cada muestra se convierte en un número digital. La onda de la ECG se convierte de una onda análoga a números digitales que se convierten en una ECG legible para el ordenador.
Vigilancia ECG Holter
La vigilancia Holter es una forma de vigilancia de largo plazo durante el que una persona utiliza un dispositivo que hacer un registro digital de 2 o 3 derivaciones ECG hasta por 48 h. Durante ese tiempo, la persona lleva un diario de sus actividades y síntomas, que más tarde se relacionan con el registro ECG. La mayoría de los dispositivos de registro también tiene un botón marcador de accidentes que el individuo puede presionar cuando experimente síntomas, lo cual ayuda al técnico o al médico a relacionar el diario, los síntomas y los cambios ECG durante el análisis. Las grabadoras Holter más modernas son capaces de producir una ECG de 12 derivaciones calculadas. La vigilancia Holter ayuda a documentar arritmias, alteraciones de la conducción y cambios en el segmento ST. La exactitud de la interpretación de los registros Holter de largo plazo varía según el sistema que se use y la experiencia del médico. La mayoría de los paquetes de software computacional usados para examinar los registros Holter son lo bastante exactos para cumplir la demanda clínica. La mayoría de los pacientes con cardiopatía isquémica presenta CVP, sobre todo los que experimentaron un IM poco tiempo antes. La frecuencia de las CVP aumenta cada vez más en las primeras semanas y disminuye alrededor de 6 meses después del infarto. Los registros Holter también se usan para confirmar la eficacia de los fármacos antiarrítmicos, episodios de isquemia miocárdica, prolongación de QT y variabilidad de la frecuencia cardíaca.
Las grabadoras intermitentes de ECG, que son grabadoras de accidentes, también se usan en el diagnóstico de las arritmias y defectos de la conducción. Hay 2 tipos básicos de grabadoras que realizan este tipo de vigilancia. El primero vigila de manera constante la frecuencia cardíaca y está programada para detectar las anomalías. El segundo tipo de unidad no vigila la ECG de manera continua, por lo que no puede detectar las alteraciones de manera automática. En este caso, es necesario que el paciente active la unidad cuando percibe síntomas. Los datos se almacenan en la memoria o se transmiten por teléfono a un receptor de ECG, en el que se graban. Estos tipos de registros ECG son útiles en personas con síntomas transitorios y se usan hasta por 30 días.
Grabadora de ECG cíclica implantable
Si los monitores Holter y de accidentes no aportan información diagnóstica, puede implantarse una grabadora de ciclos. Este dispositivo se implanta bajo la piel en la parte superior izquierda del pecho.
Vigila de manera constante la ECG del individuo y puede programarse para que almacene los accidentes activados por el paciente cuando tenga síntomas. La grabadora cíclica puede permanecer instalada hasta por un año. Ayuda a documentar arritmias, la eficacia de fármacos antiarrítmicos, episodios de isquemia miocárdica, prolongación de QT, trastornos en la frecuencia cardíaca y variabilidad de la frecuencia cardíaca.
Prueba de esfuerzo
En la prueba de esfuerzo se induce la respuesta del cuerpo a los aumentos medidos en el ejercicio agudo. Esta técnica aporta información sobre los cambios en la frecuencia cardíaca, presión arterial, respiración e intensidad percibida de ejercicio. Ayuda a identificar las alteraciones inducidas por el ejercicio en la respuesta hemodinámica y los cambios isquémicos en el segmento ST; también permite detectar y clasificar los trastornos de la frecuencia y conducción cardíacos vinculados con el ejercicio. Estos cambios son indicativos de un mal pronóstico en personas con enfermedad coronaria conocida e IM reciente.
Pruebas electrofisiológicas
Las pruebas electrofisiológicas se usan para el diagnóstico y tratamiento de arritmias complejas. Implica el paso de 2 o más catéteres con electrodo hacia el lado derecho del corazón. Estos catéteres se introducen en las venas femoral, subclavia, yugular interna o antecubital y se sitúa con ayuda fluoroscópica en la parte alta de la aurícula derecha, cerca del nodo sinusal, el área del haz de His, el seno coronario que está en la hendidura AV posterior y en el ventrículo derecho. Los catéteres con electrodo se usan para estimular el corazón y registrar las ECG intracardíacas. Durante el estudio, a veces son necesarios el control de la frecuencia a sobremarcha, la cardioversión o desfibrilación para terminar la taquicardia inducida con los procedimientos de estimulación.
Las principales indicaciones para las pruebas electrofisiológicas son:
- Determinar la posibilidad de desarrollo de arritmia en una persona.
- Evaluar el síncope recurrente de origen cardíaco, cuando la ECG ambulatoria no proporciona el diagnóstico.
- Diferenciar las arritmias supraventriculares de las ventriculares.
- Localizar focos arritmógenos para intervenciones terapéuticas, como procedimientos de ablación con catéter o dispositivos contra la taquicardia.
Las pruebas también permiten definir las características que inducen una arritmia reproducible, que luego pueden utilizarse para evaluar la eficacia terapéutica de una modalidad terapéutica particular.
Los métodos electrofisiológicos también pueden utilizarse como intervenciones, las cuales incluyen control de la frecuencia en un paciente con taquicardia o tratamiento de ablación. La ablación es la destrucción de tejido miocárdico mediante la aplicación de energía eléctrica con electrodos instalados en un catéter que se sitúa junto a una zona que genera o mantiene las arritmias.
Los riesgos relacionados con las pruebas electrofisiológicas son bajos. La mayoría de estos procedimientos no incluyen acceso al lado izquierdo del corazón, por lo que el riesgo de IM, accidente cerebrovascular o embolia sistémica es menor que el de una arteriografía coronaria. La adición de maniobras terapéuticas, como la ablación, al procedimiento eleva el riesgo de complicaciones, las cuales incluyen trombosis y embolia pulmonar.
Tratamiento
El tratamiento de los trastornos de la frecuencia y la conducción cardíacas se enfoca en controlar la arritmia, corregir la causa y prevenir las arritmias más graves o mortales. La corrección puede implicar tan sólo el ajuste de un trastorno electrolítico o suspender un medicamento como la digital.
La prevención de arritmias más graves a menudo incluye fármacos, estimulación eléctrica o intervención quirúrgica.
Tratamiento farmacológico
Los fármacos antiarrítmicos actúan al modificar la formación y conducción alteradas de los impulsos que inducen la contracción miocárdica. Estos medicamentos se clasifican en 4 grupos principales (clase I a clase iv) según el efecto del compuesto en el potencial de acción de las células cardíacas. Aunque los fármacos de una categoría tengan efectos similares en la conducción, pueden tener variaciones sustanciales en sus efectos hemodinámicos. Dos tipos más de antiarrítmicos, los glucósidos cardíacos y la adenosina, no se incluyen en este esquema de clasificación. Los glucósidos cardíacos (fármacos de la digital) disminuyen la frecuencia cardíaca y se usan en el tratamiento de arritmias como la taquicardia auricular, flúter auricular y FA. La adenosina, un nucleósido endógeno presente en todas las células, se usa para el tratamiento intravenoso urgente de la taquicardia supraventricular paroxística que afecta al nodo AV. Interrumpe la conducción del nodo AV y reduce la frecuencia de descargas del nodo SA.
Fármacos clase I
Los medicamentos clase I actúan mediante el bloqueo de los conductos rápidos de sodio. Estos compuestos influyen en la conducción del impulso, excitabilidad y automatismo en varios grados, por lo que se dividieron en 3 grupos IA, IB y IC. Los fármacos de la clase IA (ej. quinidina, procainamida y disopiramida) disminuyen el automatismo porque deprimen la fase 4 del potencial de acción, reducen la conductividad mediante la prolongación moderada de la fase 0 y prolongan la repolarización mediante la extensión de la fase 3 del potencial de acción. Como estos fármacos son efectivos para suprimir los focos ectópicos y tratar las arritmias por reentrada, se usan para las arritmias supraventriculares y ventriculares.
Los fármacos de la clase IB (ej. lidocaína y mexiletina) disminuyen el automatismo porque deprimen la fase 4 del potencial de acción, tienen poco efecto en la conductividad, disminuyen el carácter refractario al disminuir la fase y acortan la repolarización porque aminoran la fase 3. Estos medicamentos tienen poco o ningún efecto en los conductos de sodio en las células en reposo. Sin embargo, acortan el potencial de acción y son inhibidores potentes de la conducción dependiente de sodio en las células despolarizadas, lo que los vuelve efectivos para impedir la conducción en las áreas isquémicas del corazón.
Los compuestos de este grupo se usan para tratar sólo arritmias ventriculares y tienen poco o ningún efecto en la contractilidad miocárdica. Los fármacos de la clase IC (ej. propafenona, moricizina y flecainida), disminuyen la conductividad mediante la depresión marcada de la fase 0 del potencial de acción, pero tienen poco efecto en el carácter refractario o en la repolarización. Su principal acción es inhibir la abertura de los conductos de sodio. Los medicamentos de esta clase se usan para las arritmias ventriculares las taquicardias ventriculares que ponen en peligro la vida.
Fármacos clase II
Los fármacos clase II (ej. propranolol, metoprolol, atenolol, timolol y sotalol) son bloqueadores β-adrenérgicos que actúan al amortiguar el efecto del estímulo nervioso simpático en el corazón, con lo que inhiben la abertura de los conductos de calcio. Estos medicamentos disminuyen el automatismo porque deprimen la fase 4 del potencial de acción. También aminoran la frecuencia cardíaca y la contractilidad cardíaca. Son efectivos en el tratamiento de las arritmias supraventriculares y las taquiarritmias porque contrarrestan la acción arritmógena de las catecolaminas. Sin embargo, no son muy efectivos para corregir las arritmias graves, como la taquicardia ventricular recurrente.
Fármacos clase III
Los fármacos clase III (ej. amiodarona, bretilio, ibutilida, dofetilida y sotalol) actúan por inhibición de la corriente de potasio y la despolarización, lo que prolonga el potencial de acción y el período refractario. Tienen poco efecto inhibidor en las corrientes despolarizantes. El sotalol tiene propiedades bloqueadoras del receptor β-adrenérgico (clase II) y prolongadoras del potencial de acción (clase III). Puede prolongar el intervalo QT y debe suspenderse si se detecta un aumento mayor al 15% con respecto al valor inicial.
El sotalol se utiliza para tratar la FA y la taquicardia ventricular relacionada con un IM antiguo.
La amiodarona no sólo puede prolongar el intervalo QT, también tiene otros efectos colaterales extracardíacos, como toxicidad tiroidea, hepática y pulmonar. Es necesario vigilar la aparición de estos efectos tóxicos de manera regular y tomarlos en cuenta cuando se decida iniciar el tratamiento para la FA y arritmias ventriculares.
La dofetilida se usa en el tratamiento de la FA y flúter auricular, así como para prevenir las recurrencias y para controlar la frecuencia cardíaca. A diferencia de la amiodarona, no tiene efectos tóxicos, pero prolonga el intervalo QT.
La ibutilida también puede prolongar el intervalo QT, pero éste se normaliza 3 h a 4 h después de suspender la infusión. Estos medicamentos se usan en el tratamiento de arritmias ventriculares graves.
Fármacos clase IV
Los fármacos clase IV (ej. verapamilo, diltiazem y mibefradilo) actúan mediante el bloqueo de los conductos lentos de calcio, lo que deprime la fase 4 y prolonga las fases 1 y 2 del potencial de acción. Al bloquear la liberación de iones calcio intracelulares, estos compuestos aminoran la fuerza de la contracción cardíaca, lo que reduce la demanda miocárdica de oxígeno. Se usan para enlentecer el marcapasos nodal SA e inhibir la conducción en el nodo AV, lo que retrasa la respuesta ventricular en las taquicardias auriculares, también terminan las taquicardias supraventriculares paroxísticas por reentrada cuando el nodo AV actúa como la vía de reentrada.
Intervenciones eléctricas
La corrección de los defectos de conducción, bradicardias y taquicardias puede ameritar la utilización de un marcapasos, cardioversión o desfibrilación. Las intervenciones eléctricas pueden emplearse en situaciones urgentes y electivas. Los esfuerzos dirigidos a la electroestimulación cardíaca comenzaron hace más de un siglo. Durante este tiempo se han hecho enormes avances en la efectividad del control de la frecuencia cardíaca.
Marcapasos cardíaco
Un marcapasos cardíaco es un dispositivo electrónico que emite un estímulo eléctrico al corazón. Se utiliza para iniciar latidos cardíacos en situaciones en las que falla el marcapasos cardíaco natural. Estas situaciones incluyen ciertos tipos de bloqueo AV, bradicardia sintomática en la que la frecuencia de la contracción cardíaca y el gasto cardíaco consecuente son insuficientes para la perfusión de los tejidos vitales y otras arritmias cardíacas. Un marcapasos puede utilizarse como medida temporal o permanente. Las derivaciones del marcapasos pueden controlar las frecuencias de las aurículas, los ventrículos o las aurículas y los ventrículos en secuencia, también puede utilizarse el control de la frecuencia por sobremarcha. El control de la frecuencia por sobremarcha se emplea en la taquicardia ventricular recurrente; para taquiarritmias auriculares o ventriculares con reentrada; y para terminar el flúter auricular.
Los marcapasos temporales son útiles para el tratamiento de bradicardias sintomáticas y para el control de la frecuencia por sobremarcha. Pueden situarse por vía transcutánea, transvenosa o epicárdica. El control de la frecuencia temporal externa, también conocida como control transcutáneo de la frecuencia, implica la colocación de grandes electrodos de parche en las paredes anterior y posterior del tórax que luego se conectan con un cable a un generador de pulsos externo. Muchos desfibriladores actuales tienen capacidad para control transcutáneo de la frecuencia.
El control interno temporal, también llamado control transvenoso de la frecuencia, es la introducción de un catéter venoso con electrodos en la punta hasta la aurícula o ventrículo derechos, donde se apone al endocardio. El electrodo se conecta con un generador de pulsos externo. Este procedimiento se realiza bajo guía fluoroscópica o dirección electrocardiográfica. Durante los procedimientos de toracotomía abierta a veces se colocan alambres epicárdicos para controlar la frecuencia. Estos alambres se extraen directamente por la pared torácica y también pueden conectarse con un generador de pulsos externo, en caso necesario.
Los marcapasos cardíacos permanentes pueden volverse necesarios por varias razones. Estos dispositivos requieren un generador de pulsos y la implantación de alambres en el epicardio que emiten los estímulos eléctricos. Es necesaria la evaluación periódica de la percepción, descarga y vida de la batería del marcapasos.
Cardioversión sincronizada y desfibrilación
La cardioversión sincronizada y la desfibrilación son 2 métodos confiables para tratar la taquicardia ventricular, y la cardioversión es el tratamiento definitivo para la FA. La emisión de una descarga eléctrica sincronizada con la onda R de la ECG se conoce como cardioversión sincronizada y la descarga no sincronizada se llama desfibrilación. El objetivo de estas 2 técnicas es aplicar un pulso eléctrico al corazón de tal manera que lo despolarice por completo durante el paso de la corriente. Esta corriente eléctrica interrumpe los impulsos desorganizados, lo que permite que el nodo SA recupere el control del corazón. La desfibrilación y la cardioversión sincronizadas pueden aplicarse de manera externa a través de grandes electrodos de parche sobre el tórax, o de manera interna mediante pequeños electrodos de paleta situados directamente sobre el miocardio, electrodos de parche suturados al epicardio o alambres transvenosos situados en el ventrículo derecho. Existen en la investigación dispositivos eléctricos que combinan el control de la frecuencia para corregir la taquicardia, cardioversión, desfibrilación y control de la frecuencia en la bradicardia.
Los cardioversores desfibriladores implantables automáticos (CDIA) se usan con éxito en el tratamiento de pacientes con taquiarritmias ventriculares que ponen en peligro la vida mediante la aplicación de un contrashock eléctrico intratorácico. La percepción y detección confiables de las taquiarritmias ventriculares son esenciales para el funcionamiento correcto del CDIA. La percepción y la detección se hacen mediante derivaciones endocárdicas. El CDIA responde a la taquiarritmia ventricular con la aplicación de un shock eléctrico entre los electrodos intratorácicos en los 10 s a 20 s siguientes a su inicio. Este marco temporal determina una probabilidad cercana al 100% dereversión de la arritmia, lo que respalda la utilidad de este dispositivo como una forma confiable y efectiva de prevenir la muerte súbita cardíaca en los sobrevivientes de un paro cardíaco fuera del hospital.
Ablación e intervenciones quirúrgicas
El tratamiento de ablación se usa para corregir taquiarritmias supraventriculares y ventriculares recurrentes que ponen en peligro la vida. Este tratamiento puede realizarse a través de un catéter o con técnicas quirúrgicas. Implica la destrucción localizada, aislamiento o excisión del tejido cardíaco que se considera generador de la arritmia.
Los primeros procedimientos de ablación por catéter se realizaron con shocks de corriente directa, pero esta fuente de energía ya casi se sustituyó por radiofrecuencia (RF), que se aplica mediante un generador externo y destruye el tejido mediante la generación de calor. Esta forma de ablación emplea ondas de RF para destruir las vías de conducción eléctrica defectuosas o anómalas.
La crioablación es la aplicación directa de una sonda fría en extremo al tejido cardíaco arritmógeno. La crioablación aplicada mediante un catéter causa daño mediante la congelación de estructuras celulares en las vías de conducción eléctrica anómalas.
Puede recurrirse a intervenciones quirúrgicas adicionales, como la revascularización arterial coronaria, ventriculotomía y resección endocárdica, para mejorar la oxigenación miocárdica, eliminar focos arritmógenos o alterar las vías de conducción eléctrica. La cirugía para revascularización arterial coronaria mejora la oxigenación cardíaca porque incrementa el suministro sanguíneo al miocardio. La ventriculotomía es la extirpación de tejido aneurismático, con sutura de las paredes miocárdicas para eliminar el movimiento ventricular paradójico y los focos de arritmia.
En la resección endocárdica, se extirpa el tejido endocárdico que se identificó como arritmógeno en las pruebas electrofisiológicas o en el mapeo transoperatorio. La ventriculotomía y la resección endocárdica se han realizado con crioablación o ablación por láser como tratamiento adjunto.