05. Cardiopatía valvular
En las décadas pasadas se han realizado avances notables en el tratamiento y pronóstico de las personas con cardiopatía valvular. No hay duda de que se debe a los mejores métodos para la vigilancia invasiva de la función ventricular, mejoría en las válvulas prostéticas, avances en los procedimientos de reconstrucción valvular y el desarrollo de directrices útiles para mejorar el momento de las intervenciones quirúrgicas. Sin embargo, la cardiopatía valvular todavía causa mortalidad y morbilidad considerables.
Trastornos hemodinámicos
La función de las válvulas cardíacas es asegurar el flujo unidireccional de la sangre por las cámaras cardíacas. La disfunción de las válvulas cardíacas puede ser consecuencia de muchos trastornos, como defectos congénitos, traumatismo, daño isquémico, cambios degenerativos e inflamación.
Aunque cualquiera de las 4 válvulas cardíacas puede alterarse, el compromiso más frecuente ocurre en las válvulas mitral y aórtica. Los trastornos de las válvulas pulmonar y tricúspide no son tan frecuentes debido a la presión baja en las cámaras derechas del corazón.
Las válvulas cardíacas consisten en hojas delgadas de tejido fibroso resistente y flexible cubierto con endotelio y adheridas con firmeza por su base con los anillos valvulares fibrosos. En la base de la valva existen capilares y músculo liso, pero no se extienden por ella. Las valvas de las válvulas cardíacas pueden dañarse o convertirse en el sitio de un proceso inflamatorio que deforma su línea de cierre. La reparación de las valvas a menudo se relaciona con aumento del contenido de colágeno y cicatrización, lo que hace que las valvas se acorten y se vuelvan más rígidas. Los bordes de las valvas en cicatrización pueden fusionarse, por lo que la válvula no se abre o cierra de manera apropiada.
En la cardiopatía valvular existen 2 tipos de alteraciones mecánicas: estrechamiento de la abertura valvular, por lo que no se abre de manera adecuada, y distensión de la válvula, por lo que no se cierra de manera normal (figura 32-17).
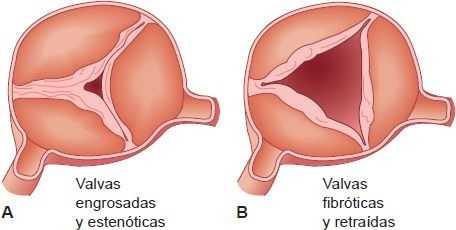
La estenosis se refiere al estrechamiento del orificio valvular y la incapacidad de las válvulas para abrirse de manera normal. El flujo sanguíneo por una válvula sana puede aumentar hasta 5 o 7 veces respecto al flujo en reposo; por consiguiente, la estenosis valvular debe ser grave para causar problemas. El estrechamiento significativo del orificio valvular aumenta la resistencia al flujo sanguíneo por la válvula, lo que convierte el flujo laminar suave en un flujo turbulento menos eficiente.
Esto incrementa el volumen y el trabajo para el vaciamiento de la cámara a través de una válvula estrecha, la aurícula izquierda en el caso de la estenosis mitral y el VI en la estenosis aórtica. Los síntomas casi siempre aparecen en situaciones con aumento en el flujo, como el ejercicio. Una válvula incompetente o insuficiente permite el flujo retrógrado cuando la válvula debiera estar cerrada, el flujo regresa hacia el VI durante la diástole cuando hay compromiso de la válvula aórtica y regresa a la aurícula izquierda durante la sístole cuando la afectada es la válvula mitral.
Los efectos de la cardiopatía valvular en la función cardíaca se deben a la alteración del flujo sanguíneo a través de la válvula y el aumento consecuente en la demanda de trabajo al corazón.
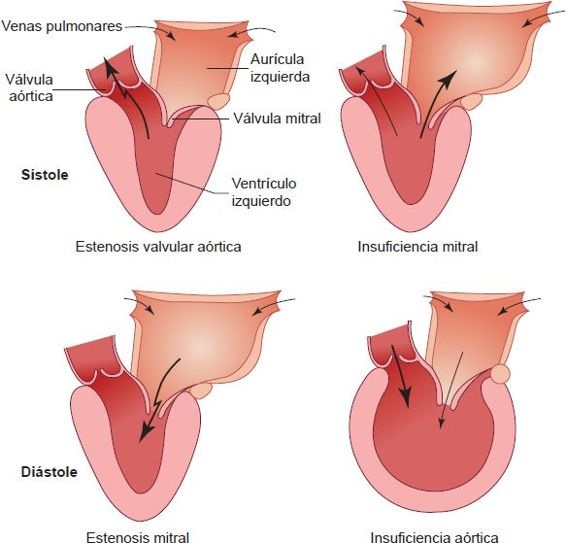
Muchos defectos valvulares cardíacos se caracterizan por soplos cardíacos causados por el flujo sanguíneo turbulento a través de una válvula anómala. Los trastornos en el flujo valvular y el tamaño de las cámaras cardíacas para las valvulopatías aórtica y mitral se ilustran en la figura 32-18.
La ecocardiografía, descrita antes en este capítulo, permite visualizar el movimiento valvular, los patrones de flujo y los patrones de cierre. La ultrasonografía Doppler en pulsos proporciona una estimación semicuantitativa o cualitativa de la gravedad de los gradientes transvalvulares, la presión sistólica ventricular derecha y la insuficiencia valvular. El Doppler de flujo a color presenta un patrón visual de la velocidad del flujo en una imagen ecocardiográfica 2D o tridimensional. Esto permite demostrar la turbulencia por las válvulas estenóticas e insuficientes.
La ecocardiografía transesofágica con ultrasonografía Doppler se emplea para obtener datos ecocardiográficos cuando la transmisión superficial de las ondas sonoras es deficiente. Proporciona imágenes más claras y permite visualizar mejor las válvulas AV y las válvulas cardíacas prostéticas.
Trastornos de la válvula mitral
La válvula mitral controla la dirección del flujo entre la aurícula izquierda y el VI. Los márgenes o cúspides de las válvulas AV son más delgados que los de las válvulas semilunares; están fijos a los músculos papilares mediante las cuerdas tendinosas. Durante gran parte de la sístole, la válvula mitral está sometida a la presión alta generada por el VI que bombea sangre a la circulación sistémica.
Durante este período de presión alta, las cuerdas tendinosas previenen la eversión de las valvas hacia la aurícula izquierda.
Estenosis valvular mitral
La estenosis mitral es la abertura incompleta de la válvula mitral durante la diástole, con distensión auricular izquierda y llenado anómalo del VI. Por lo general, la estenosis mitral es resulta do de FR. Con menor frecuencia, el defecto es congénito y se manifiesta durante la lactancia o infancia temprana, o se produce en adultos de edad avanzada por calcificación del anillo valvular. La estenosis mitral es un trastorno progresivo que continúa toda la vida, con evolución lenta y estable en los primeros años, y aceleración progresiva en los subsiguientes.
Patogénesis
La estenosis mitral se caracteriza por el reemplazo valvular del tejido valvular por fibroso, además de rigidez y fusión del aparato valvular (figura 32-19).
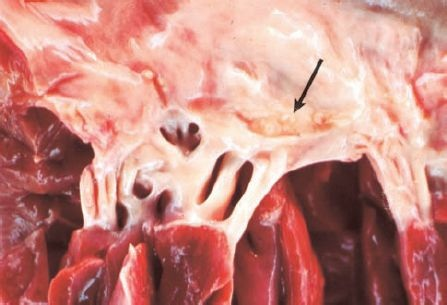
Por lo general, las cúspides mitrales se fusionan por los bordes y el compromiso de las cuerdas tendinosas causa acortamiento, lo que tira de las estructuras valvulares hacia un plano más profundo en los ventrículos. Conforme aumenta la resistencia al flujo por la válvula, la aurícula izquierda se dilata y la presión auricular izquierda se eleva. Al final, el aumento en la presión auricular izquierda se transmite al sistema venoso pulmonar, lo que causa congestión pulmonar.
La velocidad del flujo a través de la vás de la vávula depende del tamaño del orificio valvular, la presión de impulso (o sea, la presión auricular menos la ventricular) y el tiempo disponible para el flujo durante la diástole. La superficie normal de la válvula mitral es de 4 cm² a 5 cm². Los síntomas se desarrollan conforme se incrementa el gradiente a través de la válvula, por lo que la presión auricular izquierda se vuelve mayor que la ventricular izquierda. Conforme el trastorno avanza, aparecen síntomas de descenso en el gasto cardíaco durante el esfuerzo extremo u otras situaciones que causen taquicardia y, por tanto, acorten el tiempo de llenado diastólico. En las etapas avanzadas de la enfermedad, la resistencia vascular pulmonar aumenta y se desarrolla hipertensión pulmonar; esto aumenta la presión contra la que debe bombear el ventrículo derecho y al final causa insuficiencia cardíaca derecha.
Manifestaciones clínicas
Los signos y síntomas de la estenosis mitral dependen de la gravedad de la obstrucción y se relacionan con el aumento en la presión auricular izquierda y la congestión pulmonar, descenso del gasto cardíaco por el llenado ventricular izquierdo alterado y el crecimiento auricular izquierdo con desarrollo de arritmias auriculares y trombos murales. Los síntomas son los de la insuficiencia cardíaca, con congestión pulmonar, disnea paroxística nocturna y ortopnea. Las palpitaciones, dolor torácico, debilidad y fatiga son quejas frecuentes.
Los latidos auriculares prematuros, la taquicardia auricular paroxística y la fibrilación auricular pueden ser resultado de la distensión de la aurícula izquierda. La fibrosis de los haces internodales e interauriculares, junto con el daño al nodo senoauricular, pueden ser resultado del proceso reumático mismo. Entre el 30% y el 40% de los pacientes con estenosis mitral sintomática desarrolla fibrilación auricular. En conjunto, la fibrilación y la distensión predisponen a la formación de trombos murales. El riesgo de embolización arterial, en particular un accidente cerebrovascular, es mucho mayor en las personas con fibrilación auricular.
Diagnóstico
El soplo de la estenosis mitral se escucha durante la diástole, cuando la sangre fluye por el orificio valvular estrecho; por lo general, es un soplo grave y retumbante, se escucha mejor en la punta del corazón. El primer ruido cardíaco a menudo se acentúa y retrasa por el aumento de la presión auricular izquierda; es probable que un chasquido de abertura preceda al soplo diastólico como resultado del aumento en la presión auricular izquierda. Las ecocardiografías 2D y Doppler son las herramientas más usuales para diagnosticar la estenosis mitral. Estas ecocardiografías confirman el diagnóstico de estenosis mitral; permiten evaluar la morfología valvular mitral y la hemodinámica; y proporcionan medidas de la presión arterial pulmonar. También permiten descartar otras causas de estenosis mitral y ayudan a identificar el tratamiento más apropiado.
Tratamiento
El tratamiento médico de la estenosis mitral se enfoca en aliviar los signos del gasto cardíaco bajo y de la congestión pulmonar. Se inician diuréticos de asa para aliviar parte de la congestión. En la fibrilación auricular, los objetivos son controlar la frecuencia ventricular y prevenir la embolización sistémica con tratamiento anticoagulante. Se recomienda la profilaxis antibiótica contra la FR recurrente. Puede recurrirse a las intervenciones quirúrgicas, incluida la valvotomía con globo, comisurotomía y reparación o reemplazo valvular, para corregir la valvulopatía mitral degenerativa y funcional. La valvotomía mitral con globo es superior a la comisurotomía cerrada y abierta. Aunque en algunos países todavía se practica la comisurotomía cerrada, la mayoría de los centros eligen realizar el reemplazo valvular mitral si la valvotomía mitral con globo falla. El tipo de válvula de reemplazo depende un poco de las preferencias del paciente. Si se emplea una prótesis mecánica, es necesaria la anticoagulación de por vida.
Insuficiencia valvular mitral
La insuficiencia mitral se caracteriza por el cierre incompleto de la válvula mitral, el volumen por latido del ventrículo izquierdo se divide entre el volumen por latido anterógrado que fluye por la aorta y el volumen por latido regurgitante que regresa a la aurícula izquierda durante la sístole (figura 32-18).
Etiología y patogénesis
La insuficiencia mitral puede ser resultado de muchos procesos. La CPR se relaciona con una válvula rígida y engrosada que no se abre o cierra por completo. Además de la CPR, la insuficiencia mitral puede ser consecuencia de la ruptura de las cuerdas tendinosas o los músculos papilares, disfunción del músculo papilar o estiramiento de las estructuras valvulares por dilatación del VI o el orificio valvular. El prolapso de la válvula mitral es causa frecuente de la insuficiencia mitral.
La insuficiencia mitral aguda puede ocurrir en forma súbita, como en la disfunción del músculo papilar después de un infarto de miocardio, perforación valvular en la EI o ruptura de las cuerdas tendinosas en el prolapso de la válvula mitral. En la insuficiencia mitral aguda grave, la sobrecarga de volumen aguda aumenta la precarga ventricular izquierda, lo que permite un aumento modesto en el volumen por latido del ventrículo izquierdo. Sin embargo, el volumen por latido anterógrado (el que pasa por la aorta a la circulación sistémica) se reduce y el volumen por latido regurgitante produce un aumento rápido de la presión auricular izquierda, edema pulmonar y descenso del gasto cardíaco. La insuficiencia mitral aguda casi siempre causa síntomas. Si es grave, a menudo está indicado el reemplazo valvular.
Los cambios hemolíticos relacionados con la insuficiencia mitral crónica son más lentos, permiten la activación de mecanismos compensatorios. El aumento en el volumen ventricular izquierdo al final de la diástole permite aumentar el volumen por latido total, con restauración del flujo anterógrado hacia la aorta. La precarga aumentada y la poscarga normal o reducida (producida por la descarga del VI hacia la aurícula izquierda) facilitan la expulsión ventricular normal. Al mismo tiempo, un aumento gradual en el tamaño del ventrículo izquierdo permite que se adapte al volumen regurgitante con una presión de llenado más baja.
Manifestaciones clínicas
El aumento en el trabajo por volumen relacionado con la insuficiencia mitral es relativamente bien tolerado y muchas personas con el trastorno permanecen asintomáticas por muchos años, desarrollan síntomas entre 6 y 10 años después del diagnóstico. El grado de crecimiento ventricular izquierdo refleja la gravedad de la insuficiencia. Conforme el trastorno evoluciona, la función ventricular izquierda se altera, el volumen por latido anterógrado (aórtico) disminuye y la presión auricular izquierda aumenta, con el desarrollo subsiguiente de congestión pulmonar. Los síntomas típicos son los de la insuficiencia cardíaca del VI, como disnea de esfuerzo, disnea paroxística nocturna y ortopnea. La cirugía debe realizarse antes de que aparezcan estos síntomas.
Una manifestación característica de la insuficiencia mitral es el crecimiento del VI, un impulso ventricular izquierdo hiperdinámico y un soplo pansistólico (durante toda la sístole). Como la estenosis mitral, la insuficiencia mitral predispone a la fibrilación auricular.
Diagnóstico y tratamiento
La ecocardiografía Doppler 2D es útil en la insuficiencia mitral para evaluar el tamaño del ventrículo y aurícula izquierdos, medir la fracción de expulsión y ayudar en la toma de decisiones sobre la cirugía mediante la valoración de la gravedad de la insuficiencia. En algunas personas con insuficiencia mitral, la reducción de la precarga puede ser provechosa y puede tratarse con inhibidores de la ECA y control de la frecuencia biventricular. Las cirugías utilizadas en el tratamiento de la insuficiencia mitral incluyen reparación valvular y reemplazo valvular, con o sin retiro del aparato mitral. La cirugía valvular mitral se recomienda en la insuficiencia mitral grave o en pacientes sintomáticos, cuando es posible que la insuficiencia mitral se subestime. La reparación valvular mitral evita el empleo de anti-coagulantes necesarios en caso de implantar válvulas artificiales.
Prolapso de la válvula mitral
En ocasiones se denomina síndrome de válvula mitral floja, el prolapso mitral ocurre en el 1% al 2,5% de la población general.El trastorno es más frecuente en mujeres que en varones y tiene una base familiar. El prolapso mitral familiar se transmite como rasgo autosómico y se han identificado varios locus cromosómicos. Aunque casi siempre se desconoce la causa del trastorno, se relaciona con síndrome de Marfan, osteogénesis imperfecta y otros trastorno del tejido conectivo, así como con trastornos cardíacos, hemáticos, neuroendocrinos, metabólicos y psicológicos.
Patogénesis
Los hallazgos patológicos en personas con prolapso de la válvula mitral incluyen degeneración mixedematosa (mucinosa) de las valvas que aumenta su tamaño y las vuelve laxas, por lo que se prolapsan o regresan hacia la aurícula izquierda durante la sístole (figura 32-20).
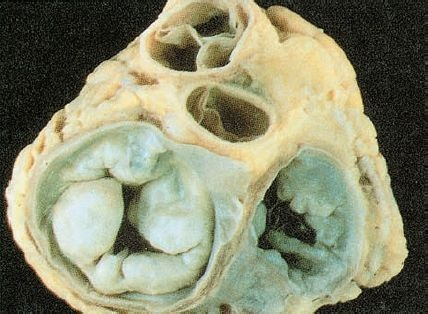
Los cambios fibróticos secundarios reflejan el estrés y la lesión que los movimientos de peloteo imponen a la válvula. Ciertas formas de prolapso mitral pueden deberse a trastornos miocárdicos que imponen un estrés excesivo a la válvula mitral por el movimiento anómalo de la pared ventricular o el músculo papilar. El prolapso de la válvula mitral puede o no causar insuficiencia mitral.
Manifestaciones clínicas y diagnóstico
La mayoría de las personas con prolapso de la válvula mitral permanece asintomática y el trastorno se descubre durante un examen clínico de rutina. Una minoría de los sujetos tiene dolor torácico semejante a angina, disnea, fatiga, ansiedad, palpitaciones y sensación de desmayo. A diferencia de la angina, el dolor torácico a menudo es prolongado, poco definido y no se relaciona con ejercicio ni esfuerzo. El dolor se atribuye a la isquemia causada por la tracción de las valvas prolapsadas.
La ansiedad, palpitaciones y arritmias pueden ser consecuencia de la función anómala del sistema nervioso autónomo que a menudo acompaña al trastorno. Este problema se caracteriza por un conjunto de hallazgos en la auscultación que van desde una forma silenciosa hasta uno o más chasquidos mesosistólicos seguidos por un soplo holosistólico o sistólico tardío. Los chasquidos se producen por la tensión súbita del aparato valvular mitral cuando las válvulas prolapsan. La ecocardiografía Doppler y la 2D son estudios no invasivos valiosos para el diagnóstico del prolapso de la válvula mitral.
Tratamiento
El tratamiento del prolapso valvular mitral se enfoca en aliviar los síntomas y prevenir las complicaciones. Las personas con palpitaciones y taquiarritmias leves o aumento de las manifestaciones adrenérgicas, así como aquellas con molestia torácica, ansiedad y fatiga, a menudo responden al tratamiento con bloqueadores β-adrenérgicos. En muchos casos, la eliminación de estimulantes como la cafeína, alcohol y cigarrillos puede ser suficiente para controlar los síntomas.
Los ataques isquémicos transitorios son más frecuentes en personas con prolapso de la válvulamitral. Por lo tanto, en personas con episodios confirmados que mantienen la frecuencia sinusal y no tienen trombos auriculares, se recomienda el tratamiento diario con ácido acetilsalicílico. A la mayoría de los pacientes con prolapso mitral se les alienta a practicar ejercicio regular y llevar una vida normal. Las personas que desarrollan disfunción valvular grave a veces requieren cirugía valvular.
Trastornos valvulares aórticos
La válvula aórtica se localiza entre el VI y la aorta. Tiene 3 cúspides y a veces se denomina válvula semilunar aórtica porque sus valvas tienen forma de media luna (figura 32-17). La válvula aórtica no tiene cuerdas tendinosas. Aunque sus estructuras son similares, las cúspides de la válvula aórtica son más gruesas que las de mitrales. La capa media de la válvula aórtica está engrosada cerca del medio, donde las 3 valvas se unen, lo que asegura un sello hermético. Entre el tejido engrosado y los márgenes libres, las valvas son más delgadas y ligeras.
Un aspecto importante de la válvula aórtica es la localización de los orificios para las 2 arterias coronarias principales, que se sitúan detrás de la válvula y en ángulos rectos con la dirección del flujo sanguíneo. La presión lateral en la aorta es lo que impulsa la sangre hacia las arterias coronarias. Durante la fase de expulsión del ciclo cardíaco, la presión lateral disminuye por la conversión de la energía potencial en energía cinética conforme la sangre se desplaza hacia la aorta.
Este proceso se exagera en la estenosis valvular aórtica porque la velocidad del flujo es muy alta.
Estenosis valvular aórtica
La estenosis valvular aórtica, a menudo referida sólo como estenosis aórtica, se caracteriza por aumento en la resistencia a la expulsión de sangre del VI a la aorta (figura 32-18). Las causas más frecuentes de estenosis aórtica son malformaciones congénitas de la válvula y calcificación adquirida de la válvula normal con 3 valvas. Las malformaciones congénitas pueden dar lugar a válvulas con una cúspide, bicúspides o con valvas malformadas. La estenosis aórtica adquirida casi siempre es consecuencia de la calcificación relacionada con el «desgaste y desgarro» normal de una válvula aórtica hasta entonces normal o de válvulas bicúspides congénitas (en cerca del 1% de lapoblación). La incidencia de estenosis valvular aórtica adquirida es del 2% al 4% en los adultos mayores de 65 años de edad.
Patogénesis
La progresión de la estenosis aórtica calcificada casi siempre es lenta y varía mucho de una persona a otra. Los cambios valvulares varían desde el engrosamiento leve sin obstrucción a la calcificación grave con alteración del movimiento de las valvas y obstrucción al flujo de salida del VI. Los procesos en el desarrollo de la valvulopatía aórtica calcificada son similares a los de la EAC. Ambos trastornos son más frecuentes en varones, personas de edad avanzada y personas con hipercolesterolemia; y ambos se deben en parte a un proceso inflamatorio. Las lesiones tempranas de la esclerosis aórtica muestran lesiones subendoteliales similares a placas, parecidas a la lesión ateroesclerótica en su fase inicial.
La esclerosis aórtica se distingue de la estenosis aórtica por el grado de compromiso valvular. En la esclerosis aórtica, las valvas están engrosadas, pero la obstrucción al flujo es mínima, mientras que en la estenosis aórtica, el área funcional de la válvula ha disminuido lo suficiente para causar obstrucción mensurable al flujo de salida. La calcificación de la válvula aórtica evoluciona de la base de las cúspides a las valvas. Esto reduce el movimiento de las valvas y la superficie efectiva, pero sin fusión de las comisuras. Conforme avanza la calcificación, las valvas se vuelven más rígidas, se agrava la obstrucción al flujo de salida ventricular izquierdo y la fusión de las comisuras causa estenosis aórtica.
Como la estenosis aórtica se desarrolla en forma gradual, el VI tiene tiempo para adaptarse. Con el aumento en la presión sistólica secundario a la obstrucción, la pared ventricular izquierda se vuelve más gruesa, o experimenta hipertrofia, pero se conserva el volumen normal de la cámara. Este aumento en el grosor de la pared puede mantener una fracción de expulsión normal. Existen pocas alteraciones hemodinámicas conforme el área de la válvula se reduce de su cifra normal a la mitad (de los 3 cm² a 4 cm² normales a 1,5 cm² a 2 cm²). Sin embargo, una reducción adicional del área valvular, de la mitad a un cuarto de la superficie normal, produce una obstrucción grave al flujo, con sobrecarga de presión progresiva en el VI. En ese momento, el trabajo aumentado del corazón empieza a rebasar la reserva de flujo sanguíneo coronario, lo que causa disfunción sistólica y diastólica, y signos de insuficiencia cardíaca.
Diagnóstico
La estenosis aórtica casi siempre se diagnostica por primera vez por auscultación de un soplo sistólico de expulsión intenso o un segundo ruido cardíaco único o con separación paradójica.
Al final se desarrollan las manifestaciones típicas de angina, síncope e insuficiencia cardíaca, aunque debe vigilarse de cerca la aparición de signos más sutiles de disminución en la tolerancia al ejercicio o disnea de esfuerzo. La angina ocurre en casi 2 tercios de las personas con estenosis aórtica avanzada y es similar a la observada en la EAC. La disnea, fatiga notable, cianosis periférica y otros signos de insuficiencia cardíaca con gasto bajo no son prominentes hasta una etapa avanzada de la enfermedad. La razón más frecuente del síncope (desmayo) es el decremento de la circulación cerebral que ocurre durante el esfuerzo, cuando la presión arterial disminuye como consecuencia de la vasodilatación en presencia del gasto cardíaco fijo.
Puede emplearse la ecocardiografía para evaluar la gravedad de las lesiones aórticas calcificadas, el tamaño y la función del ventrículo izquierdo, el grado de hipertrofia ventricular, y la presencia de trastornos valvulares relacionados. Esta herramienta forma parte importante en la toma de decisiones para el reemplazo valvular aórtico. La evaluación ecocardiográfica se recomienda:
- Cada año en personas con estenosis aórtica grave.
- Cada 1 a 2 años en caso de estenosis moderada.
- Cada 3 a 5 años con estenosis leve.
Tratamiento
No existe un tratamiento médico para la estenosis aórtica grave, aunque está indicada la modificación intensiva de los factores de riesgo, como la reducción de lípidos y el tratamiento antihipertensivo. En niños con estenosis aórtica congénita, las valvas están sólo fusionadas y la valvulotomía con globo puede producir un beneficio sustancial; el reemplazo valvular es el tratamiento más efectivo. Las intervenciones médicas se prescriben para aliviar los síntomas de la insuficiencia cardíaca en pacientes inelegibles para la intervención quirúrgica. Para pacientes con estenosis aórtica sintomática, el reemplazo valvular casi siempre mejora los síntomas.
Insuficiencia valvular aórtica
La insuficiencia valvular aórtica (insuficiencia aórtica) es resultado de la incompetencia valvular que permite el reflujo de sangre al VI durante la diástole (figura 32-18). Como resultado, el VI debe aumentar su volumen por latido para incluir la sangre que entra de los pulmones y la que refluye por la válvula insuficiente.
Etiología y patogénesis
Este defecto puede ser resultado de trastornos que causan cicatrización de las valvas o aumento del orificio valvular a un grado tal que las valvas ya no pueden cerrar. Hay varias causas de insuficiencia aórtica: FR, dilatación idiopática de la aorta, anomalías congénitas, EI y síndrome de Marfan. Otras causas incluyen hipertensión, traumatismo y fallo de una válvula prostética.
La insuficiencia aórtica aguda se caracteriza por la llegada de un gran volumen regurgitante súbito al VI de tamaño normal que no tuvo tiempo para adaptarse a la sobrecarga de volumen. Por lo general se debe a trastornos como la EI, traumatismo o disección aórtica. Aunque el corazón responde mediante mecanismos explicados por la ley de Frank-Starling y aumento en la frecuencia cardíaca, estos mecanismos compensatorios no pueden mantener el gasto cardíaco. Como resultado, hay un aumento intenso en la presión ventricular izquierda al final de la diástole que se transmite a la aurícula izquierda y las venas pulmonares, lo que culmina con edema pulmonar. El descenso en el gasto cardíaco activa la estimulación simpática, con aumento consecuente en la frecuencia cardíaca y la resistencia vascular periférica que agravan la insuficiencia valvular. La muerte por el edema pulmonar, arritmias ventriculares o colapso circulatorio es frecuente en la insuficiencia aórtica aguda grave.
La insuficiencia aórtica crónica, casi siempre de inicio gradual, es un trastorno que combina sobrecarga de volumen y presión en el ventrículo izquierdo. Conforme aumenta la deformidad valvular, el flujo regurgitante hacia el VI aumenta, la presión arterialdiastólica cae y el VI crece cada vez más. Desde el punto de vista hemodinámico, el aumento en el volumen ventricular izquierdo deriva en la expulsión de un volumen por latido grande, casi siempre adecuado para mantener el gasto cardíaco anterógrado hasta una fase avanzada de la enfermedad. La mayoría de las personas se mantiene asintomática durante esta fase compensada, que puede durar décadas. Es posible que durante muchos años el único signo sea un soplo aórtico sistólico suave.
Manifestaciones clínicas y diagnóstico
Conforme la enfermedad avanza, aparecen los signos y síntomas de insuficiencia ventricular izquierda, que incluyen disnea de esfuerzo, ortopnea y disnea paroxística nocturna. En la insuficiencia aórtica, la falta de cierre valvular aórtico durante la diástole causa una caída anómala en la presión diastólica. Como el flujo sanguíneo coronario es mayor durante la diástole, el descenso de la presión diastólica reduce la perfusión coronaria. Aunque la angina es rara, puede ocurrir cuando la frecuencia cardíaca y la presión diastólica caen mucho. Las personas con insuficiencia aórtica grave a menudo se quejan de una conciencia incómoda de sus latidos cardíacos, sobre todo cuando están acostados, y molestia torácica causada por el golpeteo del corazón contra la pared torácica. La taquicardia que ocurre durante el estrés emocional o el esfuerzo puede causar palpitaciones, sensación de golpeteo en la cabeza y contracciones ventriculares prematuras.
Los principales hallazgos físicos se relacionan con la ampliación de la presión del pulso arterial. Los sonidos de Korotkoff pueden persistir hasta cero, aunque la presión intraarterial rara vez es menor de 30 mm Hg. El volumen por latido grande y la presión amplia del pulso pueden causar pulsaciones carotídeas prominentes en el cuello (pulso de Corrigan), inclinaciones de la cabeza (signo de de Musset), pulsaciones sistólicas en el lecho ungueal de la mano bajo presión suave (pulso de Quincke), pulsos periféricos intensos y shock ventricular izquierdo que causa movimiento torácico con cada latido. El pulso hipercinético de la insuficiencia aórtica más grave, llamado pulso en martillo hidráulico, se caracteriza por distensión y colapso rápido de la arteria. La turbulencia del flujo a través de la válvula aórtica produce un soplo holodiastólico descendente que se escucha mejor en el borde esternal izquierdo En la insuficiencia aórtica grave puede escucharse un retumbo mesodiastólico en la punta llamado soplo de Austin-Flint.
Tratamiento
El tratamiento para la insuficiencia aórtica crónica grave es el reemplazo de la válvula.
La cirugía se recomienda siempre que los pacientes tengan síntomas, sin importar cuál sea la función ventricular izquierda. En pacientes asintomáticos existe controversia acerca del reemplazo valvular.
Sin embargo, en sujetos con disfunción ventricular izquierda o con dilatación ventricular izquierda grave también se recomienda el reemplazo valvular, incluso en ausencia de síntomas.
El tratamiento médico en la insuficiencia aórtica ha evaluado en estudios clínicos. Su objetivo es mejorar el volumen por latido anterógrado y reducir el volumen regurgitante, casi siempre con fármacos que reducen la poscarga. No hay una indicación sólida para el tratamiento médico según los estudios clínicos. Sólo existe una recomendación débil para disminuir la poscarga. El medicamento de primera línea recomendado para pacientes con insuficiencia aórtica grave asintomática, sobre todo en hipertensos, es un inhibidor de la ECA, La cirugía se mantiene como la principal terapéutica para la insuficiencia aórtica grave.