02. Enfermedad arterial coronaria
El término enfermedad arterial coronaria (EAC) describe la cardiopatía causada por la alteración del flujo sanguíneo coronario. En la mayoría de los casos, la EAC se debe a ateroesclerosis, que no sólo afecta las arterias coronarias, sino las de otras regiones del cuerpo. Las enfermedades de las arterias coronarias pueden causar isquemia de miocardio y angina, infarto de miocardio o ataque cardíaco, arritmias cardíacas, deficiencias en la conducción, insuficiencia cardíaca y muerte súbita. Cada año, más de 1,6 millones de estadounidenses tienen infartos de miocardio nuevos o recurrentes; un tercio de ellos muere en las primeras 24 h y muchos de los que sobreviven experimentan morbilidad significativa.
Los principales factores de riesgo para la EAC incluyen tabaquismo, presión arterial elevada, cifras altas de colesterol sérico total y de lipoproteína de baja densidad (LDL, por sus siglas en inglés), concentración baja de colesterol de lipoproteína de alta densidad (HDL, por sus siglas en inglés), diabetes, edad avanzada, obesidad abdominal e inactividad física. Las personas con diabetes y síndrome metabólico tienen un riesgo alto particular de EAC, con morbilidad sustancial por esta causa.
Circulación coronaria
Arterias coronarias
Las 2 principales arterias coronarias, la izquierda y la derecha, nacen del seno coronario, justo sobre la válvula aórtica (figura 32-3).
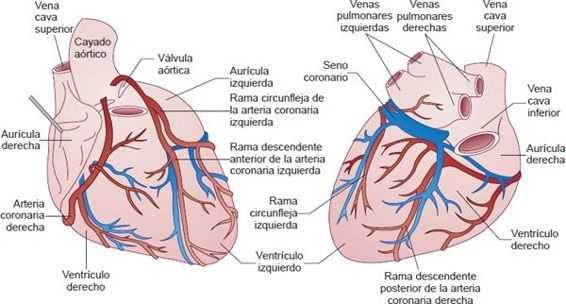
La arteria coronaria izquierda aporta el flujo sanguíneo a las porciones anterior y lateral izquierda del VI. La arteria coronaria izquierda principal se divide luego en las ramas izquierda descendente anterior y circunfleja. La arteria izquierda descendente anterior pasa por la hendidura entre ambos ventrículos, emite ramas diagonales que irrigan el VI y ramas perforantes que irrigan la parte anterior del tabique interventricular y el músculo papilar anterior del VI. La rama circunfleja de la arteria coronaria izquierda se dirige a la izquierda y hacia atrás por la hendidura que separa la aurícula y el ventrículo izquierdos, emite ramas que irrigan la pared lateral del VI. La arteria coronaria derecha se encuentra en la hendidura auriculoventricular derecha y sus ramas irrigan la mayor parte del ventrículo derecho y la parte posterior del VI en el 80% al 90% de las personas. Por lo general, la arteria coronaria derecha se dirige hacia la parte posterior del corazón, donde forma la arteria descendente posterior que en condiciones normales irriga la parte posterior del corazón, el tabique interventricular, los nodos senoauricular (SA) y auriculoventricular (AV) y el músculo papilar posterior. Por convención, la arteria coronaria que irriga el tercio posterior del tabique (ya sea la arteria coronaria derecha o la circunfleja izquierda) se llama dominante. En una circulación dominante derecha, presente en casi 4 quintas partes de las personas, la circunfleja izquierda irriga la pared lateral del VI y la arteria coronaria derecha irriga toda la pared libre del ventrículo derecho y el tercio posterior del tabique. Por tanto, tanto la oclusión de la arteriacoronaria derecha como la de la coronaria izquierda pueden causar daño ventricular izquierdo.
Las grandes arterias coronarias epicárdicas se encuentran en la superficie del corazón, con pequeñas arterias intramiocárdicas que se ramifican y penetran el miocardio antes de unirse con una red o plexo de vasos subendocárdicos. Aunque no existen conexiones entre las arterias coronarias grandes, existen conductos anastomóticos que unen las arterias pequeñas. Con la oclusión gradual de los vasos más grandes, las colaterales pequeñas aumentan de tamaño y representan vías alternativas para el flujo sanguíneo. Una de las razones por las que la EAC no produce síntomas hasta que está muy avanzada es que los conductos colaterales se desarrollan al mismo tiempo que los cambios ateroescleróticos.
El flujo sanguíneo en las arterias coronarias está controlado sobre todo por factores físicos, neurales y metabólicos. Las aberturas de las arterias coronarias se sitúan en la raíz de la aorta, justo fuera de la válvula aórtica. Por tanto, el principal factor determinante de la perfusión coronaria es la presión arterialaórtica generada por el corazón mismo. A su vez, el flujo sanguíneo miocárdico está controlado sobre todo por la actividad metabólica del miocardio y los mecanismos autorreguladores que controlan la dilatación vascular. Además de generar la presión aórtica que desplaza la sangre por los vasos coronarios, el miocardio contráctil influye en su propio suministro sanguíneo mediante la compresión de los vasos intramiocárdicos y subendocárdicos durante la sístole. El sistema nervioso autónomo ejerce sus efectos en el flujo sanguíneo coronario mediante cambios en la frecuencia cardíaca, contractilidad cardíaca y presión arterial.
El flujo sanguíneo coronario está regulado sobre todo por la necesidad de oxígeno del músculo cardíaco. Incluso en condiciones normales de reposo, el corazón extrae y utiliza el 70% del oxígeno que hay en la sangre que fluye por las coronarias. Como la reserva de oxígeno en la sangre es baja, las arterias coronarias deben aumentar su flujo para cubrir las necesidades metabólicas del miocardio durante los períodos de actividad intensa. El flujo sanguíneo en reposo normal promedio en las arterias coronarias es 225 ml/min, o cerca del 4% al 5% del gasto cardíaco total. Durante el ejercicio extenuante, el flujo coronario puede aumentar 4 o 5 veces para cubrir los requerimientos energéticos del corazón.
Uno de los factores determinantes del flujo sanguíneo coronario es la actividad metabólica del corazón. Se cree que muchos agentes, conocidos como metabolitos, actúan como mediadores de la vasodilatación que acompaña al gasto cardíaco. Estas sustancias incluyen iones potasio, ácido láctico,dióxido de carbono y adenosina, y se liberan de las células miocárdicas activas. De estas sustancias, la adenosina parece tener el mayor efecto vasodilatador y quizá sea el mediador crítico del flujo sanguíneo local.
Las células endoteliales que recubren los vasos sanguíneos, incluidas las coronarias, forman una barrera entre la sangre y la pared arterial. También sintetizan varias sustancias que al ser liberadas influyen en la relajación o constricción del músculo liso de la pared arterial. Los vasodilatadores potentes producidos por el endotelio incluyen óxido nítrico, prostaciclina y factor hiperpolarizante derivado del endotelio (EDHF, por sus siglas en inglés). El más importante de éstos es el óxido nítrico. La mayoría de los compuestos y estímulos vasodilatadores ejercen su efecto a través del óxido nítrico. Los productos de las plaquetas agregadas, la trombina, los productos de los mastocitos y el aumento en la fuerza en cizalla, causantes de la llamada vasodilatación mediada por el flujo, estimulan la síntesis y liberación de óxido nítrico. El endotelio también es la fuente de factores vasoconstrictores y los más conocidos son las endotelinas.
Suministro y demanda miocárdicos de oxígeno
La circulación coronaria suministra de miocardio el oxígeno y los nutrimentos que necesita para bombear sangre al resto del cuerpo. En una persona en reposo, el 75% del oxígeno de la sangre que pasa por el miocardio se extrae. Conforme cambian las necesidades metabólicas del cuerpo, la función cardíaca y el flujo sanguíneo coronario deben adaptarse para cubrir estas necesidades. Si existe un desbalance entre el suministro y la demanda miocárdicos de oxígeno, puede haber angina, infarto de miocardio e incluso muerte súbita.
Suministro miocárdico de oxígeno
El suministro miocárdico de oxígeno depende de las arterias coronarias y el flujo capilar, así como de la capacidad de la hemoglobina para transportar y suministrar oxígeno de miocardio. Los factores importantes en el transporte y suministro de oxígeno incluyen la fracción de oxígeno inspirado en la sangre y el número de eritrocitos con hemoglobina normal funcional. Incluso con flujo sanguíneo coronario adecuado, puede haber isquemia de miocardio en situaciones de hipoxia, anemia o intoxicación por monóxido de carbono.
Demanda miocárdica de oxígeno
Existen 3 factores determinantes de la demanda miocárdica de oxígeno (MVO2): la frecuencia cardíaca, contractilidad ventricular izquierda y presión sistólica o tensión de la pared miocárdica (figura 32-4).
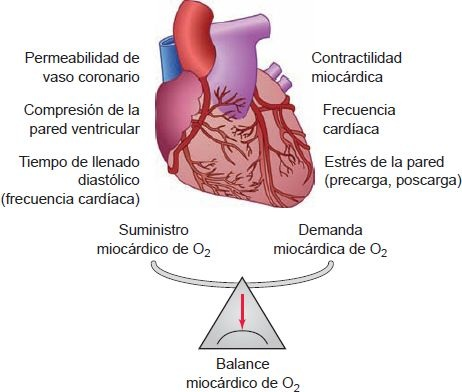
La frecuencia cardíaca es el factor principal en la demanda miocárdica de oxígeno por 2 razones:
- Conforme aumenta la frecuencia cardíaca, también se incrementa el consumo o demanda miocárdica de oxígeno.
- El flujo sanguíneo coronario subendocárdico se reduce porque hay menos tiempo para el llenado diastólico con las frecuencias cardíacas altas.
La contractilidad miocárdica es la capacidad intrínseca del músculo cardíaco para acortarse y generar fuerza. Refleja la interacción entre los iones calcio y las proteínas contráctiles (actina y miosina) de las fibras musculares. En condiciones normales, se determina por la frecuencia con la que se desarrolla la presión y se acorta el músculo. Con una mayor contractilidad cardíaca, aumenta la frecuencia de cambio en la tensión de la pared, lo que a su vez incrementa la captación miocárdica de oxígeno. Los factores que intensifican la contractilidad, como el ejercicio, el estímulo del sistema nervioso simpático y los agentes inotrópicos, aumentan el MVO.
El estrés de la pared se genera cuando se aplica tensión a una zona determinada. Puede pensarse en la tensión de la pared ventricular izquierda como la tensión promedio que las fibras musculares individuales deben generar para acortarse contra una presión intraventricular desarrollada. Es proporcional al producto de la presión intraventricular y el radio ventricular, dividido entre el grosor de la pared del ventrículo. Por tanto, a una presión determinada, la tensión de la pared aumenta con el incremento del radio (dilatación ventricular) y también se eleva con una reducción en el grosor de la pared.
El término precarga se emplea para describir la fuerza de distensión de la pared ventricular cuando se llena antes de la contracción. Los cambios en la precarga se valoran a través de la presión ventricular izquierda al final de la diástole. Esto puede medirse de manera indirecta si se emplea la presión arterial pulmonar por oclusión (o en cuña, obtenida mediante un catéter arterial pulmonar.
La poscarga es la «carga» contra la que el corazón debe contraerse para expulsar la sangre. Un componente principal de la poscarga ventricular izquierda es la presión aórtica, o la presión que el ventrículo debe generar para expulsar la sangre hacia la aorta.
El aumento en la tensión de la pared, ya sea causado por el aumento en la precarga o en la poscarga, incrementa el MVO2, ya que las fibras del músculo cardíaco desarrollan más tensión y utilizan con más rapidez el trifosfato de adenosina (ATP). Como la tensión de la pared mantiene una relación inversa con el grosor de la pared, la hipertrofia ventricular sirve como mecanismo de adaptación por el cual el ventrículo es capaz de contrarrestar el aumento en la tensión de la pared que acompaña al aumento de la presión aórtica o la estenosis valvular aórtica.
Valoración del flujo sanguíneo coronario y perfusión miocárdica
Entre los métodos utilizados para la evaluación del flujo sanguíneo coronario y la perfusión miocárdica están la electrocardiografía, pruebas de esfuerzo, ecocardiografía e imágenes por ecografía Doppler; IRM y TC cardíacas; y cateterismo cardíaco y angiografía. Estas herramientas de valoración varían mucho y experimentan avances tecnológicos constantes.
Electrocardiografía
La ECG de 12 derivaciones es el procedimiento diagnóstico cardiovascular más usual. Puede emplearse no sólo para el diagnóstico y tratamiento de la EAC, sino también para identificar defectos en la conducción ventricular, arritmias, desbalances electrolíticos, efectos farmacológicos y alteraciones eléctricas o estructurales de origen genético. La ECG estándar de 12 derivaciones emplea electrodos para registrar diferencias en el potencial eléctrico generadas por corrientes iónicas (potenciales de acción) durante el ciclo cardíaco entre sitios determinados del cuerpo. Es importante situar correctamente los electrodos y verificar que la posición del paciente sea correcta porque pueden cambiar los ámbitos registrados y los ejes de la ECG, lo cual influye en la interpretación.
La vigilancia ECG ambulatoria se emplea con frecuencia para detectar cambios transitorios en el segmento ST y la onda T que no se acompañan de síntomas (o sea, isquemia asintomática). La vigilancia ECG ambulatoria continua puede hacerse con un monitor Holter o un monitor de eventos.
Otro método, llamado ECG de señal promediada o de alta resolución, acentúa el complejo QRS para poder identificar los pospotenciales de baja amplitud, que a veces se relacionan con un riesgo elevado de arritmias ventriculares, y puede detectarse la muerte súbita.
Pruebas de esfuerzo
La prueba de esfuerzo es una forma de observar la función cardíaca en condiciones de estrés, casi siempre se realiza en adultos con síntomas de cardiopatía isquémica diagnosticada o sospechada. También se emplea para valorar la respuesta fisiológica después de un infarto de miocardio (IM) o revascularización; la capacidad funcional para un programa de ejercicio o rehabilitación cardíaca; la eficacia de tratamientos médicos o quirúrgicos; la gravedad de arritmias; antes de una operación se emplea para valorar el estado funcional; y para evaluar la claudicación intermitente.
El ejercicio en una banda sin fín, que es el método empleado con mayor frecuencia para la prueba de estrés cardiovascular, requiere un nivel de desempeño miocárdico más alto que otras formas de ejercicio. El objetivo es alcanzar el nivel máximo de esfuerzo para la edad, de ser posible.
Mientras se intenta hacerlo, se vigila la presión arterialdurante la prueba de ejercicio y se registra el patrón ECG para determinar la frecuencia cardíaca y detectar cambios isquémicos en el miocardio.
El dolor precordial, la disnea, arritmias, cambios en el segmento ST de la ECG y el descenso de la presión arterial sugieren EAC. Si aparecen uno o más de estos signos o síntomas casi siempre se termina la prueba.
La prueba de estrés farmacológico puede emplearse para simular el esfuerzo del ejercicio en personas que no pueden realizar ejercicio físico a causa de trastornos ortopédicos, neurológicos, vasculares periféricos u otros. Puede emplearse la infusión intravenosa de dipiridamol, adenosina o dobutamina. El dipiridamol bloquea la reabsorción celular de adenosina, un vasodilatador endógeno,y aumenta el flujo sanguíneo coronario 3 a 5 veces sobre el nivel basal. En personas con EAC significativa, los vasos de resistencia distales a la estenosis ya están dilatados al máximo para mantener el flujo normal en reposo. En estas personas, la vasodilatación adicional no aumenta el flujo sanguíneo. La dobutamina, un fármaco simpaticomimético, aumenta la contractilidad cardíaca y el volumen por latido. Durante la ecocardiografía con estrés, una dosis baja de dobutamina permite valorar la viabilidad miocárdica y las dosis altas identifican la isquemia de miocardio.
En algunas poblaciones, la prueba de esfuerzo resulta un desafío. Las mujeres que realizan una prueba de esfuerzo son menos sensibles a la depresión del segmento ST inducida por el ejercicio.
Para aumentar la exactitud de la prueba en las mujeres se ha sugerido la utilización de radionúclidos, pero no se incluyen en las directrices del American College of Cardiology/American Heart Association (ACC/AHA). La prueba también es difícil en los adultos mayores por su menor capacidad para realizar ejercicio. Por lo general experimentan mareo y fatiga por falta de condicionamiento y fatiga muscular. Esto requiere un protocolo modificado, pero no es contraindicación para la prueba de esfuerzo con ejercicio.
Ecocardiografía
La ecocardiografía todavía es la prueba diagnóstica más usual para valorar la estructura y función del corazón. Utiliza señales ultrasónicas inaudibles al oído humano. La ecografía se refleja (hace eco) siempre que el haz de sonido encuentra un cambio en la resistencia a su transmisión. Por tanto, es posible crear una imagen móvil de las estructuras internas del corazón, ya que la pared torácica, la sangre y las distintas estructuras cardíacas reflejan el sonido de manera diferente. La ecocardiografía es útil para determinar las dimensiones ventriculares y los movimientos valvulares, proporciona datos sobre el movimiento de la pared ventricular izquierda y el tabique; calcula volúmenes diastólico y sistólico; y permite visualizar el movimiento de los segmentos individuales de la pared ventricular izquierda durante la sístole y la diástole.
Existen distintas formas de ecocardiografía: imágenes bidimensionales, ecocardiografía en modo M, bidimensional, Doppler y ecocardiografía con contraste.
La ecocardiografía en modo M, que fue la primera forma de ultrasonografía cardíaca, utiliza un haz de ecografía estacionario para producir una vista unidimensional o «en picahielo» del corazón.
La ecocardiografía bidimensional (2D) utiliza un haz de ecografía móvil para producir una visión integrada del corazón formada por múltiples en forma de tarta.
La ecocardiografía Doppler utiliza la ecografía para registrar el flujo sanguíneo dentro del corazón. El empleo de contraste ha mejorado la delineación de estructuras en el lado izquierdo del corazón. Se pueden obtener imágenes tridimensionales del corazón mediante los nuevos transductores de una imagen ecocardiográfica tridimensional de volumen completo.
La ecocardiografía transesofágica emplea un transductor para ecocardiografía 2D situado en el extremo de un endoscopio flexible para obtener imágenes ecocardiográficas desde el esófago. La colocación del transductor en el esófago permite obtener imágenes de las estructuras cardíacas desde distintos puntos de vista, no sólo desde la superficie del tórax. La ecocardiografía transesofágica es muy útil para valorar la función valvular. La ecocardiografía con esfuerzo, con o sin el consumo de fármacos, se utiliza junto con el ejercicio dinámico. Se registran imágenes en reposo y con esfuerzo, se almacenan y luego se analizan para determinar el tamaño, forma y función total y del ventrículo izquierdo. La disminución del engrosamiento sistólico de la pared que se observa en la ecocardiografía con esfuerzo permite identificar la isquemia de miocardio.
Imágenes cardíacas nucleares
Las técnicas de imágenes cardíacas nucleares implican la utilización de radionúclidos (o sea, sustancias radiactivas) y no son invasivas. A menudo se emplean 3 tipos de pruebas cardiológicas nucleares: imágenes de perfusión miocárdica, tomografía por emisión de positrones (TEP) y angiocardiografía con radionúclido. En todas estas pruebas se emplea una cámara de centelleo (γ) para registrar la radiación emitida por el radionúclido. La técnica de imágenes más utilizada hoy en día es la tomografía computarizada por emisión de fotón único (TCEFU), que emplea una cámara de cabezas múltiples para obtener una serie de imágenes de planos en un arco de 180 a 360 grados alrededor del tórax.
La imagen de la perfusión miocárdica se utiliza para visualizar la distribución regional del flujo sanguíneo. La centelleografía de perfusión miocárdica emplea talio 201 o uno de los nuevos agentes de tecnecio que las células miocárdicas funcionales extraen de la sangre y captan. El talio 201, un análogo del potasio, se distribuye en el miocardio en proporción de la magnitud del flujo sanguíneo.
Después de la inyección, un dispositivo de detección externa registra la distribución del material radiactivo. Un área isquémica aparece como una «mancha fría» que carece de captación radiactiva. La aplicación más importante de esta técnica ha sido su empleo durante la prueba de esfuerzo para evaluar la cardiopatía isquémica.
La tomografía por emisión de positrones (TEP) emplea agentes emisores de positrones para demostrar la perfusión o el estado metabólico del miocardio. Los radioisótopos utilizados como emisores de positrones son los átomos naturales de peso atómico pequeño (ej. carbono, nitrógeno, oxígeno) que son los constituyentes predominantes de compuesto orgánicos como la glucosa.
Durante la isquemia, el músculo cardíaco cambia del metabolismo de ácidos grasos al de glucosa. Por tanto, puede emplearse un rastreador radiactivo como la fluorodesoxiglucosa para distinguir de miocardio con disfunción transitoria («aturdido») del tejido cicatricial mediante la confirmación del metabolismo persistente de glucosa en áreas con flujo sanguíneo reducido.
La angiocardiografía con radionúclido permite la visualización real de las estructuras ventriculares durante la sístole y diástole, y un medio para evaluar la función ventricular durante el reposo y las pruebas de esfuerzo. Para obtener este tipo de imágenes se utiliza un radioisótopo como la albúmina marcada con tecnecio, que no sale de los capilares, sino que permanece en la sangre y no se une con el miocardio. Este tipo de imágenes nucleares puede emplearse para conocer los volúmenes ventriculares derecho e izquierdo, las fracciones de eyección de movimiento regional de la pared y contractilidad cardíaca. Este método también es útil para el diagnóstico de cortocircuitos intracardíacos.
Imagen por resonancia magnética y tomografía computarizada
La IRM cardíaca crea un mapa de señales de radio con resolución espacial y, en comparación con las técnicas de radiografía, es mucho más segura. La IRM cardíaca emplea gadolinio como agente de contraste y activación mediante la ECG para prevenir los artefactos e imágenes borrosas de los ciclos cardíacos periódicos. En casi todos los escáneres actuales, esto se logra con la activación (disparo) de la obtención de datos para la IRM con la onda R de la ECG. La IRM cardíaca se utiliza para cuantificar el volumen, masa y función de los ventrículos. No puede emplearse en personas con marcapasos, desfibriladores u otros dispositivos. En fecha reciente, la FDA aprobó un marcapaso con derivaciones específicas que es compatible con la IRM. Sin embargo, se requieren ajustes de programación especiales antes de obtener las imágenes.
La TC es una técnica radiográfica que obtiene vistas transversales del cuerpo mediante la rotación del escáner de rayos X alrededor del paciente. Se han desarrollado varias generaciones de tecnología de TC: la TC convencional, con contraste y con haz de electrones. Las imágenes cardíacas por TC pueden obtenerse con o sin inyectar un agente de contraste. La TC sin contraste se emplea sobre todo para valorar la calcificación de las arterias coronarias. Los estudios con contraste pueden emplearse para valorar las cámaras cardíacas, los grandes vasos cardíacos y a veces, el lumen de las arterias coronarias. La TC con haz de electrones, desarrollada de manera específica para obtener imágenes cardíacas, es una técnica útil para identificar a las personas con riesgo de EAC. A diferencia de la TC convencional, en la que el escáner se mueve alrededor del paciente, en la TC con haz de electrones sólo se mueve este último.
Cateterismo cardíaco y arteriografía
El cateterismo cardíaco es uno de los procedimientos invasivos más usuales en la valoración de la EAC. Este procedimiento implica la introducción de catéteres flexibles hacia los grandes vasos y las cámaras cardíacas. En el cateterismo cardíaco derecho, el catéter se introduce en una vena periférica (casi siempre la femoral) y se avanza hasta el lado derecho del corazón. El catéter para el lado izquierdo del corazón se introduce en forma retrógrada por una arteria periférica (casi siempre la braquial o femoral) hasta la aorta y las cámaras izquierdas.
El laboratorio de cateterismo cardíaco, en el que se realiza el procedimiento, está preparado para visualizar y registrar las imágenes fluoroscópicas del corazón y los vasos torácicos, así como para medir las presiones en el corazón y los grandes vasos. También tiene equipo para medir el gasto cardíaco y para obtener muestras de sangre a fin de realizar un análisis de gases. Los estudios angiográficos se realizan mediante la inyección de un medio de contraste radiográfico al corazón para poder observar y filmar las estructuras en movimiento.
La angiografía coronaria implica la inyección de un medio de contraste radiográfico en las coronarias, lo que permite visualizar las lesiones en estos vasos. Se emplea para identificar y establecer el grado de estrechamiento coronario, realizar una intervención coronaria percutánea (ICP) y colocar endoprótesis arteriales coronarias, así como para establecer la disposición para una cirugía de revascularización con injerto arterial coronario. También pueden hacerse las mediciones fisiológicas intracoronarias (ultrasonografía Doppler, reserva de flujo fraccionado) con la nueva tecnología de alambre sensor.
Ateroesclerosis coronaria y patogénesis de la enfermedad arterial coronaria
La ateroesclerosis es la causa más frecuente de EAC; es lenta y progresiva; y puede iniciar a una edad muy joven en Estados Unidos y otros países desarrollados. La ateroesclerosis puede afectar una o las 3 arterias coronarias epicárdicas principales y sus ramas. Las lesiones clínicas significativas pueden localizarse en cualquier parte de estos vasos, pero tienden a predominar en los primeros centímetros de las arterias coronarias descendente anterior izquierda y la circunfleja izquierda, o en toda la extensión de la coronaria derecha. En ocasiones también afecta las principales ramas secundarias.
La enfermedad arterial coronaria a menudo se divide en 2 tipos de trastornos: el síndrome coronario agudo y la cardiopatía isquémica crónica. El síndrome coronario agudo (SCA) incluye un espectro de enfermedades cardíacas isquémicas agudas que van desde la angina inestable hasta el infarto de miocardio causado por la alteración de una placa ateroesclerótica.
La cardiopatía isquémica crónica se caracteriza por episodios recurrentes y transitorios de isquemia de miocardio y angina estable causados por el estrechamiento luminal de una arteria coronaria debido a la ateroesclerosis o espasmo.
Placa estable y placa inestable
Existen 2 tipos de lesiones ateroescleróticas:
- Placa fija o estable, que obstruye el flujo sanguíneo.
- Placa inestable, vulnerable o de alto riesgo, que puede romperse e inducir adherencia plaquetaria y formación de un trombo.
La placa fija o estable a menudo participa en la angina estable; la inestable en la angina inestable y el infarto de miocardio. En la mayoría de los casos, la isquemia de miocardio causante de la angina inestable, infarto de miocardio agudo, accidente cerebrovascular y en muchos casos, de la muerte súbita cardíaca (MSC), se desencadena por cambios súbitos en la placa, seguidos de trombosis. Los principales determinantes de la vulnerabilidad de la placa a la ruptura incluyen el tamaño del centro lipídico, la estabilidad y grosor de su cubierta fibrosa, la presencia de inflamación y la falta de células musculares lisas (figura 32-5). Las placas con una cubierta fibrosa delgada sobre un centro lipídico grande tienen riesgo alto de romperse.
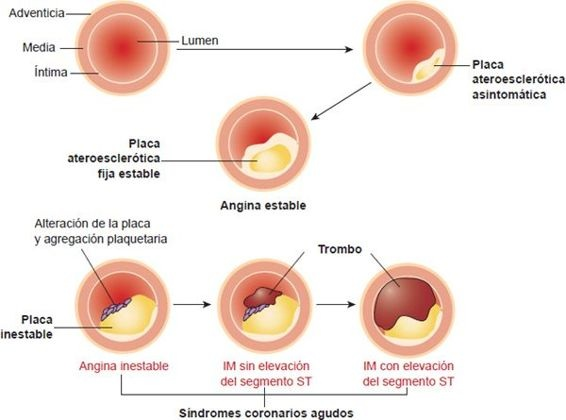
Aunque la alteración de la placa puede ser espontánea, a menudo se desencadena por factores hemodinámicos como las características del flujo sanguíneo y la tensión vascular. Por ejemplo, se cree que un incremento súbito en la actividad simpática con aumento de la presión arterial, frecuencia cardíaca, fuerza de la contracción cardíaca y flujo sanguíneo coronario aumenta el riesgo de ruptura de la placa. En realidad, muchas personas con infarto de miocardio refieren un acontecimiento desencadenante, casi siempre estrés emocional o actividad física. La alteración de la placa también tiene variación diurna, es más frecuente durante la primera hora después de levantarse, lo que sugiere que factores fisiológicos como aumentos súbitos en el tono arterial coronario y la presión arterial pueden inducir la alteración de la placa ateroesclerótica y el depósito plaquetario subsiguiente. Se ha sugerido que el sistema nervioso simpático se activa al levantarse, produce cambios en la agregación plaquetaria y la actividad fibrinolítica que tienden a favorecer la trombosis.
Trombosis y oclusión vascular
La trombosis local que ocurre después de la alteración de la placa se debe a la interacción compleja entre el centro lipídico, las células musculares lisas, macrófagos y colágeno. El centro lipídico representa un estímulo para la agregación plaquetaria y la formación de un trombo. Tanto las células musculares lisas como las células espumosas en el centro lipídico contribuyen a la expresión del factor tisular en las placas inestables. Una vez expuesto a la sangre, el factor tisular inicia la vía de coagulación extrínseca, lo que conduce a la generación de trombina y el depósito de fibrina.
Las plaquetas tienen un papel importante en la relación de la alteración de la placa con la EAC aguda. Como parte de la respuesta a la alteración de la placa, las plaquetas se adhieren al endotelio y liberan sustancias (ej. difosfato de adenosina [ADP], tromboxano A2 y trombina) que favorecen la agregación de más plaquetas y la formación de un trombo. La membrana plaquetaria, que contiene receptores para glucoproteínas que se unen con el fibrinógeno y agregan a las plaquetas, contribuye a la formación del trombo. La adhesión y la agregación plaquetarias ocurren en varios pasos.
Primero, la liberación de ADP, tromboxano A y trombina inicia el proceso de agregación. Segundo, se activan los receptores para glucoproteína IIb/IIIa en la superficie plaquetaria. Tercero, el fibrinógeno se une con los receptores para glucoproteína activados, lo que forma puentes entre las plaquetas adyacentes.
Existen 2 tipos de trombos que se forman como resultado de la alteración de la placa: trombos blancos que contienen plaquetas y trombos rojos que contienen fibrina. Los trombos en la angina inestable se describen como grisáceos y se supone que son ricos en plaquetas. Los trombos rojos, que se desarrollan con la oclusión vascular en el infarto de miocardio, son altos en fibrina y eritrocitos superpuestos al componente plaquetario y obstruyen por completo el flujo sanguíneo.
Síndrome coronario agudo
El síndrome coronario agudo incluye angina inestable, infarto de miocardio sin elevación del segmento ST (sin onda Q) e infarto de miocardio con elevación del segmento ST (con onda Q). Las personas sin elevación del segmento ST en la ECG son aquellas en las que la oclusión coronaria trombótica es subtotal o intermitente, mientras que los pacientes con elevación del segmento ST casi siempre tienen oclusión coronaria completa en la angiografía, al final, muchos tienen infarto de miocardio con onda Q.
Cambios electrocardiográficos
Los cambios ECG típicos que ocurren en el SCA incluyen inversión de la onda T, elevación del segmento ST y desarrollo de una onda Q anómala. Es posible que los cambios no aparezcan de inmediato con los síntomas y varían mucho según la duración del accidente isquémico (agudo o en evolución), su extensión (subendocárdico o transmural) y su localización (anterior frente a posteroinferior). Como estos cambios casi siempre requieren tiempo para desarrollarse y se observan en las derivaciones ECG que captan el área afectada del miocardio, está indicada la vigilancia en serie con ECG de 12 derivaciones.
La fase de repolarización del potencial de acción (onda T y segmento ST en la ECG) casi siempre es la primera en alterarse durante la isquemia y lesión miocárdicas. Conforme se produce la isquemia en el área afectada, se altera la repolarización miocárdica, lo que produce cambios en la onda T. Por lo general, esto se demuestra en la inversión de la onda T, aunque puede haber una elevación hiperaguda de la onda T como primer signo del infarto.
Los cambios en el segmento ST aparecen con la lesión isquémica del miocadio y según las derivaciones alteradas, puede indicar la lesión de interés.
En condiciones normales, el segmento ST de la ECG es casi isoeléctrico (plano sobre la línea basal) porque todas las células miocárdicas sanas alcanzan el mismo potencial durante la repolarización temprana.
La isquemia grave aguda reduce el potencial de membrana en reposo y acorta el potencial de acción en la región isquémica. Estos cambios crean una diferencia de voltaje entre las áreas normales e isquémicas del miocardio que producen la llamada corriente de lesión entre estas regiones. Estas corrientes de lesión son las representadas en la ECG superficial como desviación del segmento ST. Cuando la lesión aguda es transmural, el vector total ST se desvía en dirección del epicardio, lo que produce la elevación del segmento ST. En el infarto con onda Q se desarrollan ondas Q anómalas y se pierde la onda R porque no se conduce una corriente de despolarización desde el tejido necrótico. Cuando la lesión se limita sobre todo al subendocardio, el segmento ST total se desvía hacia la capa interna del ventrículo, lo que genera una depresión y no elevación del segmento ST.
Biomarcadores séricos
Aunque los biomarcadores cardíacos ayudan a los médicos a diagnosticar la angina inestable/infarto de miocardio sin elevación del segmento ST (AI/IMNEST) en casi un tercio de los pacientes la espera por los resultados retrasaría el tratamiento para reperfusión en el infarto de miocardio con elevación del segmento ST (IMEST). La ECG de 12 derivaciones debe indicar el inicio del tratamiento para reperfusión, ya que esta terapéutica es sensible al tiempo.
Los biomarcadores séricos del SCA incluyen la troponina I (TnI) y la troponina T (TnT) cardíacas específicas, y la cinasa de creatina MB (CK-MB). Conforme las células miocárdicas mueren, su contenido intracelular difunde al intersticio circundante y después a la sangre.
La velocidad con la que las enzimas aparecen en la sangre depende de su localización intracelular, su peso molecular y el flujo sanguíneo local. Por ejemplo, pueden aparecer antes de lo anticipado en pacientes que se sometieron a tratamiento de reperfusión exitoso.
Las pruebas de troponina son muy específicas para el tejido miocárdico y se han convertido en las principales pruebas de biomarcadores para el diagnóstico del infarto de miocardio.
El complejo troponina, que forma parte del filamento de actina, consiste en 3 subunidades (troponina C [TnC], TnT y TnI) que regulan el proceso contráctil de actina y miosina mediado por el calcio en el músculo estriado. La TnI y TnT, presentes en el músculo cardíaco, empiezan a elevarse 3 h después del inicio del infarto de miocardio y pueden mantenerse elevados durante 7 a 10 días después del accidente.
Esto resulta muy ventajoso para el diagnóstico tardío del infarto de miocardio.
La creatina cinasa es una enzima intracelular de las células musculares. Existen 3 isoenzimas de la CK, la isoenzima MB es muy específica de la lesión al tejido miocárdico. Las concentraciones séricas de CK-MB rebasan los intervalos normales 4 h a 8 h después de la lesión miocárdica y disminuyen hacia la normalidad en 2 o 3 días.
Cuando se comparan la troponina y CK-MB, la concentración de troponina identifica la necrosis del miocardio más temprano que la CK-MB. Los médicos que examinan los biomarcadores cardíacos deben enfocarse en la concentración de troponina, no en la de CK-MB, para hacer el diagnóstico y para determinar el éxito de la reperfusión.
Angina inestable/infarto de miocardio sin elevación del segmento ST
La AI/IMNEST se considera un síndrome clínico de isquemia de miocardio que varía desde la angina estable hasta el infarto de miocardio. Por lo general, la AI y el IMNEST difieren en que la isquemia sea lo bastante grave para causar daño miocárdico suficiente para liberar cantidades detectables de marcadores cardíacos en el suero. Se considera que las personas sin evidencia de marcadores séricos de daño miocárdico tienen AI, mientras que el diagnóstico de IMNEST se establece si hay marcadores séricos de lesión miocárdica.
La fisiopatología de AI/IMNEST puede dividirse en 5 fases:
- Desarrollo de la placa inestable que se rompe o erosión de una placa con trombosis superpuesta no oclusiva.
- Obstrucción causada por espasmo, constricción, disfunción o estímulo adrenérgico.
- Estrechamiento grave del lumen coronario.
- Inflamación
- Cualquier estado fisiológico que cause isquemia derivada de la disminución del suministro de oxígeno, como fiebre o hipotensión.
La inflamación puede tener un papel prominente en la inestabilidad de la placa, las células inflamatorias liberan citocinas que adelgazan la capa fibrosa y la vuelven más susceptible a la ruptura o erosión. El dolor relacionado con la AI/IMNEST es persistente e intenso, se caracteriza por al menos uno de los siguientes 3 elementos:
- Ocurre en reposo (o con esfuerzo mínimo), casi siempre dura más de 20 min (si no se alivia con nitroglicerina).
- Es intenso y se describe como dolor franco y nuevo (o sea, menos de un mes de antigüedad).
- Es más intenso, prolongado o frecuente de lo que se había experimentado antes.
La estratificación de riesgo de las personas que se presenten con AI/IMNEST es importante porque el resultado varía desde excelente, con poco cambio en el tratamiento, hasta IMNEST o muerte, lo que amerita tratamiento intensivo. La AI/IMNEST se clasifica por gravedad con base en la historia clínica, patrón ECG y biomarcadores séricos en:
- Clase I (angina intensa de nuevo inicio).
- Clase II (angina en reposo en el mes previo, pero no en las últimas 48 h).
- Clase III (angina en reposo en las últimas 48 h).
El patrón ECG de la AI/IMNEST tiene depresión del segmento ST (o elevación transitoria del segmento ST) y cambios en la onda T. El grado de desviación del segmento ST es una medida importante de la isquemia y el pronóstico.
Infarto de miocardio con elevación del segmento ST
El IMEST, también conocido como ataque cardíaco, se caracteriza por la muerte isquémica del tejido miocárdico debido a la enfermedad ateroesclerótica de las arterias coronarias. El área de infarto depende de la arteria coronaria afectada y la distribución del flujo sanguíneo (figura 32-6).
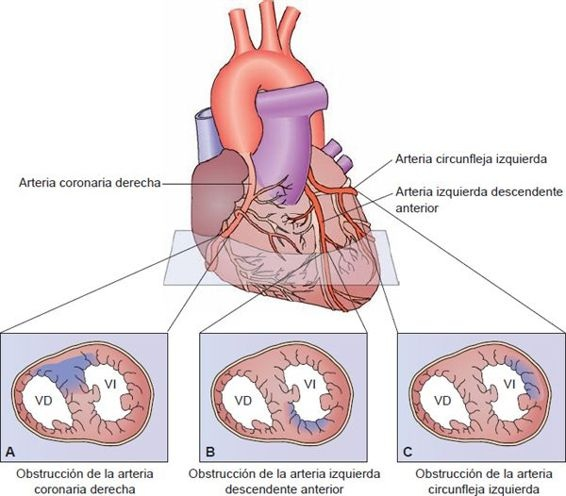
Cerca del 30% al 40% de los infartos afecta la arteria coronaria derecha, del 40% al 50% afecta la arteria descendente izquierda anterior y del 15% al 20% restante afecta la arteria circunfleja izquierda.
Fisiopatología
La extensión del infarto depende de la localización y la extensión de la oclusión, la cantidad de tejido miocárdico irrigado por el vaso, la duración de la oclusión, las necesidades metabólicas del tejido afectado, la extensión de la circulación colateral y otros factores, como la frecuencia cardíaca, presión arterial y frecuencia cardíaca. Un infarto puede afectar al endocardio, miocardio, epicardio o una combinación de ellos. Los infartos transmurales afectan todo el grosor de la pared ventricular y casi siempre ocurren cuando se obstruye una sola arteria (figura 32-7).
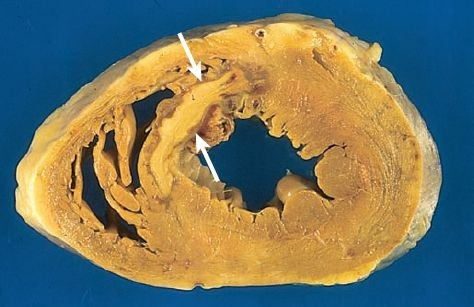
Los infartos subendocárdicos afectan un tercio a la mitad de la pared ventricular y son más frecuentes en presencia de arterias con estrechamientos graves, pero aún permeables. La mayoría de los infartos es transmural, afecta la pared libre del VI y el tabique interventricular.
La principal consecuencia bioquímica del infarto de miocardio es la conversión del metabolismo aeróbico al anaeróbico con producción insuficiente de energía para mantener la función miocárdica normal. Como resultado, hay una pérdida muy intensa de la función contráctil en los 60 s siguientes al inicio. Los cambios en la estructura celular (o sea, agotamiento de glucógeno y edema mitocondrial) se desarrollan en varios minutos. Estos cambios tempranos son reversibles si se restaura el flujo sanguíneo. Aunque los cambios tisulares macroscópicos no son aparentes horas después del inicio del infarto de miocardio, la zona isquémica cesa su función en cuestión de minutos; el daño celular irreversible se produce en cerca de 40 min. La muerte celular miocárdica irreversible (necrosis) ocurre después de 20 min a 40 min de isquemia grave. La lesión microvascular ocurre en cerca de 1 h y sigue a la lesión celular irreversible. Si el infarto es lo bastante grande, deprime la función ventricular izquierda global y sobreviene el fallo de la bomba.
Múltiples cambios estructurales dinámicos mantienen la función cardíaca en personas con IMEST. Las áreas infartadas y no infartadas del ventrículo experimentan cambios progresivos en el tamaño, forma y grosor que comprenden adelgazamiento temprano de la pared, cicatrización, hipertrofia y dilatación, lo que en conjunto se denomina remodelación ventricular. Conforme el músculo no funcional de la zona infartada se vuelve delgado y se dilata, el músculo de la región circundante no infartada se engruesa conforme experimenta hipertrofia de adaptación para que pueda realizar el trabajo del músculo infartado. Sin embargo, el efecto adaptador de la remodelación puede ser rebasada por la formación de un aneurisma o el decremento de la función miocárdica, lo que causa daño adicional de la función ventricular.
Manifestaciones clínicas
EL IMEST puede ocurrir de manera súbita o como progresión de AI/IMNEST. El inicio del IMEST casi siempre es abrupto, con dolor como el síntoma principal. Por lo general, el dolor es intenso y constrictivo, a menudo se describe como aplastante, sofocante o «como algo sentado sobre mi pecho». Muchas veces es retroesternal, se irradia al brazo izquierdo,cuello o mandíbula, aunque puede experimentarse en otras partes del pecho. A diferencia de la angina, el dolor del IMEST es más prolongado y no se alivia con reposo o nitroglicerina; a menudo requiere narcóticos. Algunas personas no lo describen como dolor, sino como «molestia». Con frecuencia las mujeres experimentan molestia torácica isquémica atípica, mientras que los adultos mayores se quejan de disnea más a menudo que de dolor precordial.
Son frecuentes las molestias gastrointestinales. Es posible que haya una sensación de dolor epigástrico; puede haber náuseas y vómito. Se cree que estos síntomas se relacionan con la intensidad del dolor y la estimulación vagal. La molestia epigástrica puede confundirse con indigestión y es factible que la persona busque alivio con antiácidos u otros remedios caseros, que sólo retrasan la búsqueda de atención médica. Son frecuentes las quejas de fatiga y debilidad, sobre todo de brazos y piernas. El dolor y el estímulo simpático se combinan para causar taquicardia, ansiedad, inquietud y sentimientos de desgracia inminente. En ocasiones hay tos productiva con esputo rosado y espumoso. La piel suele encontrarse pálida, fría y húmeda. La disfunción miocárdica puede causar hipotensión y shock.
La muerte súbita por IMEST es la que ocurre en la hora siguiente al inicio de los síntomas. Casi siempre se atribuye a arritmias mortales, que pueden ocurrir sin evidencia de infarto. La hospitalización temprana después del inicio de los síntomas mejora mucho la probabilidad de evitar la muerte súbita porque se cuenta con instalaciones para la reanimación apropiada en caso de arritmia ventricular.
Tratamiento del síndrome coronario agudo
Como el diagnóstico específico de IMEST a menudo es difícil de establecer al momento de ingresar a una institución de salud, el tratamiento inmediato de AI/IMNEST y el IMEST casi siempre es el mismo. El pronóstico del IMEST depende mucho del desarrollo de 2 tipos de complicaciones:
arritmias y complicaciones mecánicas (fallo de la bomba). La mayoría de las muertes por IMEST se debe al desarrollo súbito de arritmias ventriculares. Por lo tanto, los elementos principales del tratamiento para el IMEST incluyen:
- Identificación de los síntomas y búsqueda temprana de atención médica.
- Despliegue rápido de un equipo médico de urgencias capaz de realizar procedimientos de reanimación, incluida la desfibrilación.
- Transporte expedito a un hospital preparado para el tratamiento de arritmias y apoyo cardíaco vital avanzado.
- Implementación expedita del tratamiento de reperfusión en 60 min a 90 min.
Las personas con manifestaciones de IMEST a menudo retrasan la solicitud de atención, a pesar de la información pública sobre los beneficios del tratamiento temprano. Los individuos que retrasan la búsqueda de tratamiento hospitalario incluyen adultos mayores, mujeres, personas de etnia negra, las de estado socioeconómico bajo, sujetos con antecedente de angina o diabetes y los que consultan a un familiar o a un médico.
Los objetivos de la sala de urgencias para el tratamiento del SCA incluyen identificación de personas que son prospectos para el tratamiento de reperfusión. El interrogatorio y la exploración física deben ser minuciosos, pero eficientes para no retrasar la reperfusión. Deben confirmarse los episodios previos de ECV, incluidos SCA, cirugía para revascularización coronaria o ICP. Es esencial la valoración de la molestia principal del paciente, por lo general, el dolor precordial, junto con otros síntomas acompañantes para distinguir el SCA de otros diagnósticos.
Siempre que alguna persona se presente a la sala de urgencias con síntomas de SCA, 10 min antes del arribo a la sala de urgencias debe contarse con una ECG de 12 derivaciones interpretado por el médico. Es posible que los cambios ECG típicos no aparezcan de inmediato con los síntomas, salvo por arritmias. Los trazos ECG diagnósticos (o sea, elevación del segmento ST, prolongación de la onda Q e inversión de la onda T) pueden ser difíciles de identificar en personas con IMEST que acuden por dolor precordial. Por lo tanto, deben obtenerse trazos ECG en serie. Algunas dificultades adicionales incluyen las contracciones ventriculares prematuras, que son arritmias frecuentes después de un infarto de miocardio. La presencia de otras arritmias y defectos de la conducción depende de las zonas del corazón y las vías de conducción afectadas por el infarto. Un bloqueo de rama nuevo, sobre todo el de la rama izquierda, también sirve como criterio para IMEST y es indicación para una reperfusión pronta.
Los regímenes terapéuticos indicados a menudo incluyen la administración de oxígeno, ácido acetilsalicílico, nitratos, analgésicos antiplaquetarios, anticoagulantes y bloqueadores β-adrenérgicos (β-bloqueadores). Las personas con evidencia ECG de infarto deben recibir tratamiento inmediato para la reperfusión con un trombolítico o ICP antes de 60 min a 90 min. La importancia del control intensivo de la insulina para mantener la glucemia normal (80 mg/dl a 110 mg/dl) en pacientes graves se respalda con múltiples estudios. Las directrices actuales del ACC/AHA recomiendan mantener el control estricto de la glucemia durante el IMEST.
El alivio del dolor es el principal objetivo terapéutico en el IMEST. Se logra con una combinación de oxígeno, nitratos, analgésicos (ej. morfina) y bloqueadores β-adrenérgicos. La administración de oxígeno eleva el contenido del oxígeno en el aire inspirado y la saturación de oxígeno de la hemoglobina. Es posible que la concentración arterial de oxígeno caiga de manera precipitada después del IMEST y el suministro de oxígeno ayuda a mantener el contenido de este gas en la sangre de la circulación coronaria. En pacientes con insuficiencia cardíaca grave por IMEST a veces son necesarias la ventilación con presión positiva continua o la intubación endotraqueal con apoyo mediante ventilación mecánica.
Se administra nitroglicerina por su efecto vasodilatador y su capacidad para aliviar el dolor de origen coronario. Los efectos vasodilatadores del fármaco disminuyen el retorno venoso (o sea, reduce la poscarga) y la presión arterial arterial (o sea, reduce la poscarga), lo que disminuye el consumo de oxígeno. La nitroglicerina también limita el tamaño del infarto y es más efectivo si se administra en las 4 h siguientes al inicio de los síntomas. Por lo general, la nitroglicerina se administra por vía sublingual al principio, después de lo cual se valora la necesidad de infusión intravenosa. El empleo de nitroglicerina intravenosa está indicado para el tratamiento del dolor isquémico continuo, para controlar la hipertensión o para tratar la congestión pulmonar. La nitroglicerina no debe administrarse a pacientes con hipotensión grave o que hayan recibido un inhibidor de la fosfodiesterasa para disfunción eréctil en las 24 h previas.
Aunque se han empleado varios analgésicos para tratar el dolor del IMEST, por lo general, la morfina es el fármaco de elección. Está indicada si el dolor torácico no se alivia con oxígeno y nitratos. El alivio de la ansiedad que produce la morfina contribuye a disminuir la inquietud y la actividad del sistema nervioso autónomo, con el descenso subsiguiente en las demandas metabólicas del corazón. A menudo se administra por vía intravenosa por su rápido inicio de acción y porque la vía intravenosa no eleva la concentración de las enzimas, además que evita la absorción variable de los sitios subcutáneos o intramusculares, que a menudo tienen hipoperfusión por el descenso del gasto cardíaco consecuencia del infarto.
Los bloqueadores β-adrenérgicos actúan como antagonistas que bloquean las funciones del sistema nervioso simpático mediadas por los β-receptores, con lo que reducen la demanda miocárdica de oxígeno al disminuir la frecuencia y la contractilidad cardíacas, y la presión arterialarterial. La prolongación de la diástole causada por la frecuencia cardíaca más baja puede mejorar la perfusión miocárdica, sobre todo del subendocardio. Los β-bloqueadores también alteran los potenciales de membrana miocárdica en reposo y pueden reducir las arritmias ventriculares que ponen en peligro la vida. Como la actividad del sistema nervioso simpático aumenta las demandas metabólicas del miocardio, casi siempre se administran β-bloqueadores orales o intravenosos en las primeras horas después del inicio del IMEST. No deben administrarse en el IMEST causado por consumo de cocaína porque puede intensificar el espasmo coronario. Otras contraindicaciones relativas a los β-bloqueadores incluyen la bradicardia sintomática, hipotensión, insuficiencia ventricular izquierda moderada a grave, shock y bloqueo cardíaco de segundo o tercer grado.
Las plaquetas tienen un papel central en la respuesta trombótica a la ruptura de la placa ateroesclerótica; por lo tanto, la inhibición de la agregación plaquetaria es un aspecto importante del tratamiento temprano de AI/IMEST y el IMEST. El ácido acetilsalicílico es el antiplaquetario preferido para prevenir la agregación de los trombocitos en el SCA. Este fármaco inhibe la síntesis de la prostaglandina tromboxano A2, se cree que favorece la reperfusión y disminuye la probabilidad de trombosis recidivante. Los efectos del ácido acetilsalicílico se relacionan con la presencia del grupo acetilo, que se une de manera irreversible con la enzima plaquetaria crucial, la ciclo-oxigenasa, necesaria para la síntesis del tromboxano A2. Como su efecto es irreversible, el efecto del ácido acetilsalicílico en la función plaquetaria dura toda la vida de las plaquetas, cerca de 8 a 10 días.
En pacientes que no pueden tomar este fármaco por hipersensibilidad o intolerancia gastrointestinal puede consumirse clopidogrel. El clopidogrel es un derivado de la tienopiridina que reduce la agregación plaquetaria porque inhibe la vía plaquetaria de ADP. A diferencia del ácido acetilsalicílico, no tiene efecto en la síntesis de prostaglandinas. Los resultados de varios estudios dieron lugar a recomendaciones de la AHA para consumir clopidogrel junto con el ácido acetilsalicílico en pacientes con AI/IMEST, y como impregnación previa a procedimientos y tratamiento prolongado en personas que se someten a ICP. Los fármacos antitrombina también se emplean en el tratamiento del SCA. La anticoagulación, con efecto en la vía de coagulación y el desarrollo del coágulo de fibrina, se hace con heparina no fraccionada y heparina de bajo peso molecular. La justificación para emplear un régimen antitrombótico en el IMEST es la profilaxis de trombosis venosa profunda, embolia pulmonar y embolia cerebral.
Los inhibidores de la enzima convertidora de angiotensina (ECA) se emplea a menudo durante la etapa temprana y la convalecencia del IMEST; como efecto beneficioso, reduce la tasa de mortalidad. Los inhibidores de la ECA aumentan el gasto cardíaco y el volumen por latido; reducen la resistencia vascular sistémica y la presión capilar pulmonar por oclusión. A su vez, esto reduce la disfunción VI y la MSC. El mayor beneficio lo obtienen los pacientes con infartos previos, insuficiencia cardíaca y taquicardia. Por lo general, los inhibidores de la ECA se inician en las primeras 24 h, después de completar el tratamiento fibrinolítico. El empleo de los inhibidores de la ECA suele iniciarse con dosis orales bajas que se aumentan de manera constante hasta la dosis completa. Aunque el consumo de estos fármacos en el tratamiento de corto plazo en pacientes con AI/IMEST no parece aportar beneficios, el consumo prolongado ayuda a prevenir los episodios isquémicos recurrentes.
Estrategias para reperfusión
El término reperfusión se refiere al restablecimiento del flujo sanguíneo mediante el consumo de fármacos (fibrinolíticos), ICP o colocación de injerto para revascularización arterial coronaria (IRAC). Todas las personas con IMEST deben valorarse lo más pronto posible para determinar la pertinencia del tratamiento para reperfusión al ingresar a la institución médica. Deben considerarse el tiempo desde el inicio de los síntomas, el riesgo de IMEST, los posibles riesgos relacionados con el tratamiento fibrinolítico y el tiempo necesario para el traslado a un laboratorio con capacidad de ICP.
La reperfusión temprana (en 15 min a 20 min) después del inicio de la oclusión puede prevenir la necrosis y mejorar la perfusión en la zona de infarto. La reperfusión después de un intervalo prolongado puede salvar algunas de las células miocárdicas que habrían muerto con un período más largo de isquemia. También previene la lesión microvascular que se produce en el largo plazo.
Aunque gran parte del miocardio viable que existe al momento de la reperfusión al final se recupera, es probable que persistan alteraciones en la función bioquímica que causan disfunción ventricular. La zona del corazón que se recupera a menudo se llama miocardio en hibernación. Como la función miocárdica se pierde antes de que haya muerte celular, es posible que el miocardio en hibernación no pueda sostener la vida y los pacientes con grandes áreas de miocardio disfuncional requieren apoyo vital hasta que las regiones aturdidas recuperan su función.
Tratamiento fibrinolítico
Los fármacos fibrinolíticos disuelven los coágulos sanguíneos y plaquetarios, y se utilizan para disminuir la mortalidad, limitar el tamaño del infarto, alentar la cicatrización del infarto y la remodelación miocárdica, además de disminuir las arritmias que ponen en peligro la vida. Estos fármacos interactúan con el plasminógeno para generar plasmina, que disuelve los coágulos de fibrina, digiere los factores de coagulación V y VIII, la protrombina y el fibrinógeno. Los fibrinolíticos incluyen la estreptocinasa, alteplasa, reteplasa y tenecteplasa-tPA. Los mejores resultados se obtienen si el tratamiento se inicia en los 30 min siguientes al inicio de los síntomas. La magnitud del beneficio disminuye después de este período, pero es posible obtener cierto provecho hasta 12 h después del inicio del dolor. El paciente debe ser un prospecto de bajo riesgo para las complicaciones hemorrágicas, sin hemorragia intracraneal ni traumatismos significativos en los 3 meses previos. La principal complicación del tratamiento fibrinolítico es la hemorragia intracraneal, que casi siempre ocurre en las primeras 24 h del tratamiento.
Intervención coronaria percutánea
La ICP está indicada como procedimiento invasivo temprano para pacientes con AI/IMEST sin morbilidad concurrente grave y que tienen lesiones susceptibles de corrección con este procedimiento. La ICP incluye la angioplastia coronaria transluminal percutánea (ACTP), colocación de endoprótesis vascular, aterectomía y trombectomía. El objetivo de la ICP es realizar el procedimiento en los 90 min siguientes al primer contacto médico del paciente («el intervalo de la puerta al globo»).
La ACTP con globo es la dilatación de una placa ateroesclerótica causante de estenosis mediante un globo inflable (figura 32-8).
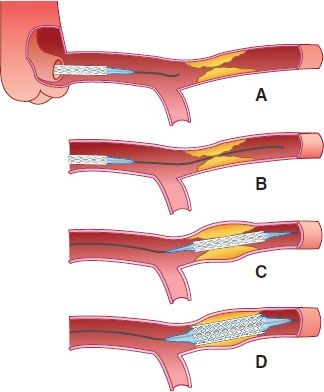
El procedimiento es similar al cateterismo cardíaco para angiografía coronaria, ya que se introduce un catéter de doble lumen para dilatación con globo por vía percutánea en la arteria femoral o la braquial y se avanza bajo guía fluoroscópica hasta la zona de estenosis del vaso coronario afectado. Una vez ahí, se emplea para ampliar el lumen arterial coronario mediante estiramiento y desgarro de la placa ateroesclerótica y, en menor medida, mediante la distribución de la placa en su eje longitudinal. Este procedimiento a menudo se emplea junto con la colocación de endoprótesis, pero ahora rara vez se emplea solo. Las complicaciones agudas de la ACTP incluyen trombosis y disección del vaso; las complicaciones de largo plazo incluyen estenosis recidivante del vaso dilatado.
El empleo de endoprótesis vasculares coronarias mejora los resultados de corto y largo plazo en comparación con la ACTP sola. Los pacientes a los que se colocan endoprótesis reciben antiplaquetarios y anticoagulantes para prevenir la trombosis, que es un riesgo mayor del procedimiento. Las endoprótesis metálicas desnudas de malla de alambre que se expanden por sí solas que se utilizaban en un principio conllevaban una tasa elevada de trombosis y se han sustituido por endoprótesis expandibles con el globo. La braquiterapia (radiación) se empleaba para mejorarlas tasas de estenosis recidivante; implica la aplicación localizada de radiación intracoronaria para reducir la estenosis recidivante en la endoprótesis. Está registrado que el procedimiento inhibe la proliferación celular y la formación de lesiones vasculares, y previene la remodelación arterial constrictiva. Este procedimiento tiene limitaciones, incluida la necesidad de radioterapia y está demostrado que es inferior a las endoprótesis liberadoras de fármaco. Las endoprótesis metálicas desnudas se utilizan en el 20% al 30% de los pacientes que requieren ICP.
Las endoprótesis liberadoras de fármaco (con sirolimus, paclitaxel, zotarolimus y everolimus) también se emplean para suprimir la proliferación local de la neoíntima que causa estenosis recidivante de la arteria coronaria. Estudios clínicos recientes concluyeron que se recomienda el consumo prolongado hasta por un año de ácido acetilsalicílico y clopidogrel para prevenir la estenosis recidivante. La aterectomía (corte de la placa ateroesclerótica con una hoja circular de alta velocidad desde dentro del vaso) es una técnica mecánica para eliminar el tejido ateroesclerótico durante la angioplastia. También se utilizan dispositivos para angioplastia por láser. Sin embargo, con la disponibilidad de las endoprótesis, estos procedimientos se utilizan con menor frecuencia que antes. La trombectomía (extracción del trombo) implica el empleo de un catéter especial para fracturar el trombo en pequeñas piezas y luego extraer los fragmentos fracturados por la punta del catéter para desplazarlos en sentido proximal y retirarlos.
Injerto para revascularización arterial coronaria
El IRAC es una de las operaciones practicadas con mayor frecuencia en el mundo, alivia la angina, mejora la tolerancia al ejercicio y prolonga la vida. El procedimiento implica la revascularización del miocardio afectado mediante la colocación de un injerto de vena safena entre la aorta y la arteria coronaria afectada, en un punto distal a la oclusión o mediante la utilización de la arteria mamaria interna para revascularizar la arteria coronaria descendente anterior o sus ramas (figura 32-9). A menudo se realizan de una a 5 anastomosis distales.
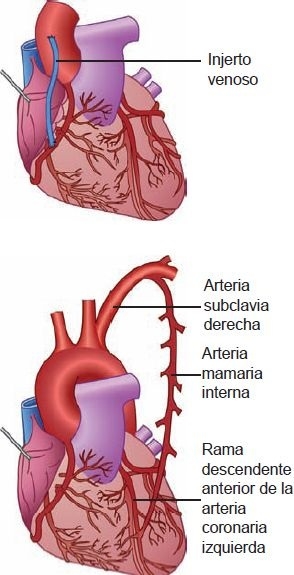
El IRAC urgente como estrategia para la reperfusión está indicado en situaciones como la ICP fallida con dolor persistente o inestabilidad hemodinámica, y en pacientes que no son prospectos para el ICP o el tratamiento fibrinolítico. Cuando se considera el IRAC como opción terapéutica, deben considerarse el riesgo de mortalidad intrahospitalaria y otras complicaciones. La edad avanzada, la función ventricular izquierda deficiente y la urgencia con la que se realice la operación aumentan el riesgo de mortalidad temprana. Las complicaciones graves, como el accidente cerebrovascular, mediastinitis y disfunción renal, también elevan la mortalidad y morbilidad relacionadas con el IRAC. El consumo de antibióticos preoperatorios y la administración preoperatoria y postoperatoria de β-bloqueadores ayudan a reducir la incidencia de infección y fibrilación auricular posoperatorias.
El IRAC no altera la evolución de la EAC y aunque la tasa de reincidencia de la angina es baja en los primeros 5 años, cerca del 50% de los injertos venosos están cerrados 10 años después de la operación. Sin embargo, la utilización de injertos de la arteria mamaria interna conlleva una tasa excelente de permeabilidad tardía. El ácido acetilsalicílico es el fármaco de elección para prevenir el cierre temprano del injerto de vena safena y se continúa de manera indefinida. Las nuevas técnicas quirúrgicas para el tratamiento de la EAC continúan en evolución en un esfuerzo por reducir los efectos adversos de la esternotomía medial, la circulación extracorpórea y el paro cardiopléjico. Algunas de estas opciones incluyen IRAC sin circulación extracorpórea, el desarrollo del injerto coronario robótico y la revacularización transmiocárdica con láser.
Período de recuperación posterior al infarto
Después de un infarto miocárdico, casi siempre existen 3 zonas de daño tisular: una región de tejido miocárdico necrótico por la falta absoluta de flujo sanguíneo; una zona circundante de células lesionadas, algunas de las cuales se recuperan; y una zona externa de células isquémicas que pueden salvarse si se restablece el flujo sanguíneo (figura 32-10).
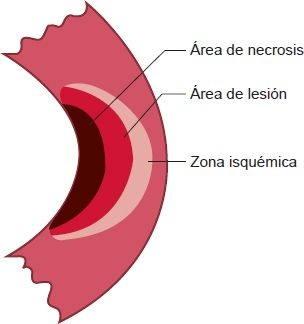
Los límites de estas zonas pueden cambiar con el tiempo después del infarto y con el éxito de las medidas terapéuticas para restablecer el flujo sanguíneo. Si éste puede restablecerse en 20 min a 40 min, la pérdida de viabilidad celular es nula o mínima. La progresión de la necrosis isquémica casi siempre comienza en la región subendocárdica y se extiende por el miocardio para afectar cada vez más el grosor transmural de la zona isquémica.
Las células miocárdicas que experimentan necrosis son sustituidas poco a poco por tejido cicatricial. Se desarrolla una respuesta inflamatoria aguda en el área de necrosis unos 2 a 3 días después del infarto. A partir de entonces, los macrófagos empiezan a eliminar el tejido necrótico; la región dañada se sustituye poco a poco por tejido de granulación muy vascularizado, que con el tiempo se vuelve menos vascular y más fibroso. En cerca de 4 a 7 días, el centro del área infartada está blando y amarillo; si ocurre la ruptura del ventrículo, del tabique interventricular o de estructuras valvulares, casi siempre ocurre en este período. El reemplazo del tejido miocárdico necrótico casi siempre se completa para la séptima semana. Las zonas de miocardio que se sustituyeron por tejido cicatricial no tienen capacidad de contraerse e iniciar o conducir potenciales de acción.
Complicaciones
Las etapas de la recuperación del IMEST dependen mucho del tamaño del infarto y los cambios que ocurran en el área infartada. El tejido cicatricial fibroso carece de las propiedades contráctiles, elásticas y de conducción del miocardio normal; los efectos residuales y las complicaciones dependen sobre todo de la extensión y localización de la lesión. Entre las complicaciones del IMEST están la muerte súbita, pericarditis, accidente cerebrovascular, tromboembolia y defectos mecánicos (ej. insuficiencia mitral, ruptura del tabique interventricular, ruptura de la pared ventricular izquierda y aneurisma ventricular izquierdo). Según la gravedad, elinfarto de miocardio puede afectar la acción de bombeo del corazón. La insuficiencia cardíaca y el shock cardiógeno son complicaciones temidas del IMEST.
Las arritmias que ponen en peligro la vida pueden ser el primer síntoma del SCA, su mecanismo difiere del de la angina estable. En el SCA, los mecanismos se relacionan con la reentrada, automatismo anómalo y desequilibrios electrolíticos, sobre todo del potasio y el magnesio. La bradicardia sintomática y el bloqueo cardíaco también son complicaciones del SCA y se tratan según las directrices para la implantación de marcapasos cardíacos y dispositivos antiarrítmicos.
La pericarditis tiende a ocurrir en pacientes con grandes infartos, fracción de eyección más baja y mayor incidencia de insuficiencia cardíaca. Puede aparecer desde el segundo o tercer día después del infarto o hasta varias semanas más tarde. Esta complicación tardía, llamada síndrome de Dressler, ocurre semanas a meses después del IMEST y se cree que es una respuesta autoinmunitaria. En contraste con el dolor causado por el IMEST, el de la pericarditis es agudo y penetrante, se agrava con la inspiración profunda y los cambios de posición. Esta complicación se ha reducido mucho con el tratamiento de reperfusión.
El accidente cerebrovascular agudo es otra complicación del IMEST. Los factores de riesgo incluyen hipertensión, edad avanzada, antecedente de un accidente cerebrovascular previo, fracción de eyección disminuida y fibrilación auricular. La tromboembolia, que se presenta como trombosis venosa profunda o embolia pulmonar, no es tan frecuente como antes gracias al tratamiento anticoagulante.
Los defectos mecánicos se deben a los cambios que ocurren en el miocardio necrótico y luego inflamado, e incluyen ruptura del tabique interventricular, del músculo papilar o de la pared ventricular libre (figura 32-11).
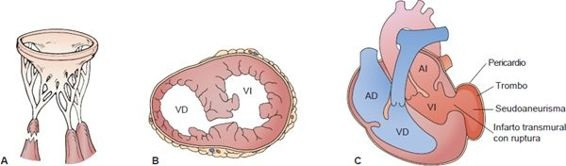
La ruptura parcial o completa de un músculo papilar es una complicación rara, pero a menudo mortal del infarto de miocardio transmural. Se detecta por la presencia de un nuevo soplo sistólico y deterioro clínico, a menudo con edema pulmonar. Lo más frecuente es que la insuficiencia mitral posterior a infarto se deba a la disfunción isquémica temprana del músculo papilar y el miocardio subyacente. La ruptura del tabique interventricular es menos frecuente que antes por la utilización del tratamiento de reperfusión. Aunque antes se pensaba que sólo ameritaba intervención quirúrgica en pacientes sintomáticos, ahora se recomienda la reparación quirúrgica para todas las personas con ruptura septal ventricular. La ruptura completa de la pared libre del ventrículo infartado se produce en el 1% al 6% de los casos y casi siempre causa la muerte inmediata. Por lo general, ocurre 3 a 7 días después del infarto, casi siempre afecta la pared anterior y es más frecuente en mujeres de edad avanzada. Es posible que el pericardio selle una ruptura parcial o incompleta, lo que crea un seudoaneurisma. Requiere intervención quirúrgica temprana porque es frecuente la ruptura completa tardía.
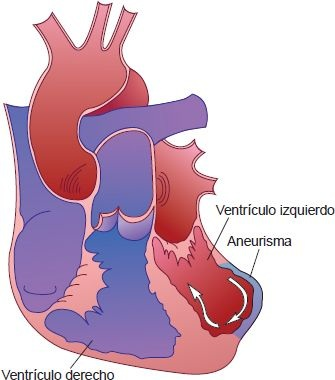
El aneurisma ventricular izquierdo es un área bien delimitada de tejido cicatricial que sobresale de manera paradójica durante la sístole (figura 32-12) y se desarrolla en el 10% de los pacientes con IMEST que mueren en el hospital. Por lo general se forma en la parte anterior del VI después de la oclusión de la arteria coronaria descendente izquierda anterior y se vuelve evidente 4 a 8 semanas después del infarto. Rara vez se rompen, pero pueden relacionarse con embolia arterial, arritmias ventriculares e insuficiencia cardíaca. Puede practicarse la resección quirúrgica para estas indicaciones cuando fallan otras medidas terapéuticas.
Rehabilitación cardíaca
Los programas de rehabilitación cardíaca se recomiendan después del SCA e incorporan estrategias para mejorar la observancia al tratamiento médico y los cambios en el estilo de vida. Los componentes de la rehabilitación cardíaca incluyen ejercicio, nutrición, terminación del tabaquismo, medidas psicosociales y educación. La educación es un elemento esencial de los programas de rehabilitación cardíaca y a menudo se incorpora con otros aspectos del programa. Se incluye la educación relacionada con el ejercicio, nutrición, eliminación del tabaquismo y medicamentos. La observancia del programa de rehabilitación cardíaca o de cualquiera de sus componentes puede ser difícil en extremo. Entre los factores que influyen en la participación y cumplimiento están la referencia al médico, aspectos del reembolso, distancia y transporte, y apoyo social.
Un programa de ejercicio es parte integral de la rehabilitación cardíaca. Incluye actividades como marcha, natación y ciclismo. Estos ejercicios implican cambios en la longitud muscular y contracciones rítmicas de los grupos musculares. La mayoría de los programas de ejercicio se diseñan de manera individualizada para cubrir las necesidades físicas y psicológicas de la persona. El objetivo del programa de ejercicio es incrementar el consumo máximo de oxígeno en los tejidos musculares para que estos sujetos puedan realizar un mayor trabajo con frecuencia cardíaca y presión arterial más bajas.
Además del ejercicio, la modificación de los factores de riesgo cardíacos incorpora estrategias para suspender el tabaquismo, perder peso, disminuir el estrés y controlar la hipertensión y diabetes, si existen. La asesoría nutricional tiene efectos directos en el peso, lípidos séricos, presión arterial,diabetes y otros factores. La elección de la dieta se basa en el efecto beneficioso, así como en las necesidades sociales y culturales del paciente. Se valoran los patrones dietéticos y se establecen objetivos específicos, que se comunican a la persona. Los programas de rehabilitación cardíaca deben incluir una valoración de los problemas psicosociales, como depresión, ansiedad y aislamiento social. Pueden suministrarse tratamiento conductual, como el desarrollo de habilidades para manejo del estrés, y tratamiento individual o grupal; también pueden hacerse referencias a otros especialistas.
Cardiopatía isquémica crónica
La isquemia de miocardio se produce cuando la capacidad de las arterias coronarias para suministrar sangre es insuficiente para cubrir las demandas metabólicas del corazón. Las limitaciones en el flujo sanguíneo coronario casi siempre son consecuencia de ateroesclerosis, aunque el vasoespasmo puede ser un factor desencadenante o contribuyente. Existen varios tipos principales de enfermedad coronaria isquémica crónica: angina estable crónica, isquemia de miocardio asintomática, angina variante o por vasoespasmo, dolor precordial con angiografía normal y miocardiopatía isquémica.
Angina estable
La angina estable crónica se produce por obstrucción coronaria fija que causa disparidad entre el flujo sanguíneo coronario y las demandas metabólicas del miocardio. La angina estable es la manifestación inicial de la cardiopatía isquémica en casi la mitad de las personas con EAC. Aunque la mayoría de los pacientes con angina estable tienen cardiopatía ateroesclerótica, la angina no se desarrolla en un número considerable de personas con ateroesclerosis coronaria avanzada. Es probable que esto se deba a su estilo de vida sedentario, al desarrollo de circulación colateral adecuada o a la incapacidad de estas personas para percibir el dolor. En muchos casos, el infarto de miocardio ocurre sin antecedente de angina.
Por lo general, la angina de pecho se desencadena por situaciones que aumentan la demanda de trabajo cardíaco, como el esfuerzo físico, exposición al frío y estrés emocional. El dolor casi siempre se describe como una sensación constrictiva, de compresión o sofocante. Por lo general, permanece estable, sólo aumenta de intensidad al principio y al final del ataque. El dolor de la angina a menudo se localiza en la región precordial o retroesternal; es similar al del infarto de miocardio en que puede irradiarse al hombro izquierdo, mandíbula, brazo y otras áreas del pecho (figura 32-13).
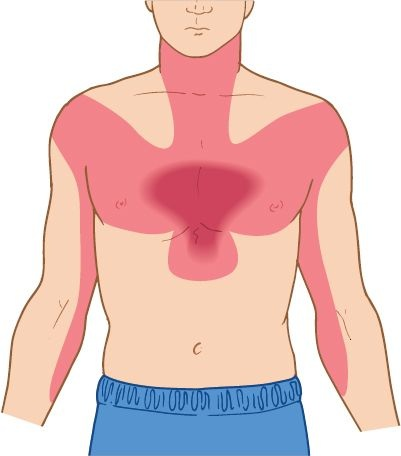
En algunas personas, el dolor del brazo o del hombro se confunde con artritis; en otras, el dolor epigástrico se confunde con indigestión. La angina a menudo se clasifica con base en su aparición con el ejercicio, en reposo, si es de inicio reciente o si tiene intensidad creciente.
Por lo general, la angina estable crónica se desencadena con el esfuerzo o el estrés emocional y se alivia en minutos con el reposo o el consumo de nitroglicerina. Un retraso mayor de 5 min al 10 min antes de obtener alivio sugiere que los síntomas no se deben a la isquemia o que se trata de isquemia grave. La angina que se manifiesta en reposo, que es de nuevo inicio o que se agrava en intensidad o duración indica un mayor riesgo de infarto de miocardio y debe valorarse de inmediato con los criterios para el SCA.
Isquemia de miocardio asintomática
La isquemia de miocardio asintomática ocurre en ausencia de dolor anginoso. Los factores que la causan parecen los mismos que los causantes de la angina: alteración del flujo sanguíneo por los efectos de la ateroesclerosis o vasoespasmo coronarios. La isquemia de miocardio asintomática afecta a 3 poblaciones: personas asintomáticas sin evidencia de EAC, sujetos que tuvieron un infarto de miocardio y aún tienen episodios de isquemia asintomática, y personas con angina que también tienen episodios de isquemia asintomática. Se desconoce la razón de los episodios indoloros de isquemia. Los episodios pueden ser más cortos y afectan a menos tejido miocárdico que los causantes de dolor. Otra explicación es que estas personas tienen defectos en el umbral del dolor o en la transmisión del mismo, o neuropatía autonómica con desnervación sensorial. Hay evidencia de una mayor incidencia de isquemia de miocardio silenciosa en personas con diabetes mellitus, quizá como resultado de la neuropatía autonómica, que es una complicación frecuente de la diabetes. EL IMEST asintomático representa un porcentaje significativo de todos los IMEST en los adultos de edad avanzada.
Angina variante (por espasmo vascular)
La angina variante también se llama vasoespástica o angina de Prinzmetal. No se comprenden del todo las causas de la angina variante, pero es posible que la causa sea una combinación de procesos patológicos. Se ha sugerido que puede ser resultado de la disfunción endotelial, respuestas excesivas del sistema nervioso simpático, defectos en la utilización del calcio en el músculo liso vascular o de una alteración en la síntesis de óxido nítrico. En algunas personas se acompaña de aumento en la contractilidad del músculo liso vascular y se acompaña de cefaleas migrañosas o fenómeno de Raynaud.
A diferencia de la angina inestable que ocurre con el esfuerzo o el estrés, la angina variante casisiempre ocurre en reposo o con ejercicio mínimo, a menudo durante la noche (entre medianoche y las 8 a.m.). Las arritmias son frecuentes cuando el dolor es intenso y la mayoría de las personas están conscientes de su presencia durante un ataque. Los cambios ECG durante el ataque son significativos.
Incluyen elevación o depresión del segmento ST, ondas T puntiagudas, inversión de ondas U y trastornos de la frecuencia. Los pacientes con angina variante con arritmias graves durante los episodios dolorosos espontáneos tienen mayor riesgo de muerte súbita.
Dolor precordial con angiografía coronaria normal
El dolor precordial inducido por el ejercicio en presencia de angiografía coronaria normal a menudo se describe como síndrome cardíaco X. Este trastorno no debe confundirse con el síndrome metabólico, que antes se llamaba síndrome S. No se conoce la causa del dolor torácico, pero se cree que es reflejo de un problema microvascular o del aumento en la percepción del dolor cardíaco. Se sugirió el nombre alternativo angina microvascular para este trastorno.
Miocardiopatía isquémica
La miocardiopatía isquémica describe la EAC que causa disfunción miocárdica. Puede manifestarse por síntomas de miocardiopatía sin antecedente conocido de EAC, en personas con múltiples IM o con arterias ocluidas. Es importante reconocer la diferencia entre la miocardiopatía isquémica y la miocardiopatía dilatada (MCD), ya que la primera puede revertirse en cuanto se presenta. La miocardiopatía isquémica causada por múltiples infartos de miocardio tiene mal pronóstico, ya que existe mayor daño que en pacientes con oclusiones vasculares que pueden revertirse.
Diagnóstico
El diagnóstico de la angina se basa en el historial detallado del dolor, la presencia de factores de riesgo, estudios invasivos y no invasivos, y análisis de laboratorio. Hay que descartar las causas no coronarias de dolor torácico, como el reflujo gastroesofágico o los trastornos musculoesqueléticos.
Las pruebas no invasivas de la angina crónica estable incluye ECG, ecocardiografía, prueba de esfuerzo, estudios de imágenes nucleares, TC y quizá IRM cardíaca. Como la ECG en reposo a menudo es normal, a menudo se emplea la prueba de esfuerzo para valorar a los pacientes con angina. La isquemia asintomática en reposo se detecta mediante la inducción del dolor precordial típico o cambios en el segmento ST en la ECG. Aunque las pruebas no invasivas son valiosas en el diagnóstico de la angina crónica estable, se requieren cateterismo cardíaco y arteriografía coronaria para establecer el diagnóstico definitivo. Los marcadores bioquímicos séricos de infarto de miocardio son normales en pacientes con angina crónica estable. Con frecuencia se detectan alteraciones metabólicas, como hipercolesterolemia y otras dislipidemias, intolerancia a los carbohidratos y resistencia a la insulina.
Tratamiento
Los pacientes con angina crónica estable requieren una valoración integral e individualizada, cambios en el estilo de vida y tratamiento. Los objetivos terapéuticos para la angina estable se enfocan en disminuir los síntomas y prevenir el infarto de miocardio con estrategias no farmacológicas, medicamentos e intervenciones coronarias. La ICP alivia los síntomas en personas con angina crónica estable, pero no prolonga la vida. Por lo general, está indicado el IRAC en pacientes con compromiso de 2 o de vasos.
Los métodos no farmacológicos se enfocan en controlar los síntomas y modificar el estilo de vida a fin de reducir los factores de riesgo para la enfermedad coronaria. Incluyen eliminación del tabaquismo en los fumadores, alivio del estrés, un programa de ejercicio regular, limitación de la ingestión en la dieta de colesterol y grasas saturadas, pérdida de peso en caso de obesidad y evitar el frío y otras causas de estrés que causan vasoconstricción. El objetivo de la terapéutica farmacológica de la angina es aliviar la isquemia y aliviar los síntomas; prevenir el infarto de miocardio y la muerte; y mejorar la calidad de vida. Los medicamentos utilizados en la angina estable crónica incluyen ácido acetilsalicílico o clopidogrel; β-bloqueadores en personas sin contraindicaciones o antagonistas del calcio, si los β-bloqueadores están contraindicados; e inhibidores de la ECA en pacientes que también tienen diabetes o disfunción sistólica ventricular. En personas con EAC establecida, incluida angina crónica estable, se recomienda el consumo de fármacos hipolipémicos o estatinas, incluso en presencia de aumentos leves a moderados de colesterol LDL.
Los nitratos, de acción corta o prolongada, son vasodilatadores empleados en el tratamiento de la angina crónica estable y en la isquemia de miocardio asintomática. Los nitratos ejercen su efecto sobre todo porque disminuyen el retorno venoso al corazón, con el descenso consecuente en el volumen ventricular. La presión arterial también disminuye. El descenso en la presión y volumen intraventriculares se relacionan con un decremento en la tensión de la pared y el requerimiento miocárdico de oxígeno. Aunque no son vasodilatadores, los β-bloqueadores son muy útiles en el tratamiento de la angina desencadenada por el esfuerzo. Los beneficios de estos medicamentos se deben sobre todo a sus efectos hemodinámicos: descenso de la frecuencia cardíaca, presión arterial y contractilidad miocárdica, con decremento en los requerimientos miocárdicos de oxígeno en reposo y durante el ejercicio.
Los bloqueadores del conducto de calcio, también llamados antagonistas del calcio, bloquean los conductos de calcio tipo L activados y desactivados en el músculo cardíaco y liso. Los efectos terapéuticos de estos fármacos derivan de la dilatación arterial coronaria y periférica, y de la reducción en el metabolismo miocárdico relacionado con la contractilidad miocárdica disminuida. Los pacientes con angina variante casi siempre responden al tratamiento con antagonistas del calcio.