04. Trastornos infecciosos e inmunitarios
Endocarditis infecciosa
La endocarditis infecciosa (EI) es una infección grave de la superficie interna del corazón que puede poner en peligro la vida. Se caracteriza por colonización o invasión de las válvulas cardíacas y el endocardio mural por un agente microbiano, lo que conduce al desarrollo de vegetaciones voluminosas y friables, con destrucción de los tejidos cardíacos subyacentes.
La incidencia, demografía y características de la EI han cambiado en la última década. El cuadro típico de una persona con cardiopatía reumática (CPR) y bacteriemia adquirida en la comunidad ya no representa la mayoría de los casos de EI. Ahora, las causas más frecuentes son el prolapso de la válvula mitral y los dispositivos implantables, como marcapasos y desfibriladores. Los factores predisponentes del hospedador incluyen neutropenia, inmunodeficiencia, neoplasias malignas, inmunosupresión terapéutica, diabetes y consumo de alcohol o fármacos intravenosos. Las infecciones de estos dispositivos intracardíacos, arteriales y venosos se adquieren en los centros médicos de todos los países desarrollados.
Lo usual ha sido clasificar la EI con base en el cuadro clínico en forma aguda o subaguda-crónica, según el inicio, etiología y gravedad de la enfermedad. Por lo general, el inicio de los casos agudos es rápido y afecta a pacientes con válvulas cardíacas normales que están saludables y tal vez tengan antecedente de consumo de fármacos intravenosos, o estén debilitados. Los casos subagudos-crónicos evolucionan durante meses; estos pacientes casi siempre tienen alteraciones valvulares. El desarrollo de cepas de microorganismos resistentes a los medicamentos por el consumo indiscriminado de antibióticos y el aumento en el número de personas inmunocomprometidas ha dificultado más la clasificación de los casos agudos y subagudos-crónicos.
Etiología y patogénesis
Las infecciones estafilocócicas ya se convirtieron en la principal causa de EI, los estreptococos y enterococos son las otras 2 causas más frecuentes. Otros agentes causales incluyen el grupo llamado HACEK (especie Haemophilus, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens y Kingella kingae), bacilos gramnegativos y hongos. Los agentes causales difieren un poco en los grupos de alto riesgo. Por ejemplo, Staphylococcus aureus es la causa principal en los consumidores de fármacos intravenosos, mientras que en la EI en válvulas prostéticas, la causa suelen ser estafilococos coagulasa-negativos (ej. Staphylococcus epidermidis).
Además, S. epidermidis se ha relacionado con dispositivos implantables e infecciones vinculadas con atención médica. Lo principal entre los factores que conducen al desarrollo de la EI es la siembra de microbios en la sangre. La vía de entrada a la sangre puede ser una infección evidente, un procedimiento dental o quirúrgico que cause bacteriemia transitoria, la inyección directa a la sangre de una sustancia contaminada entre drogadictos o una fuente oculta en la cavidad bucal o el intestino.
La lesión endotelial, la bacteriemia y la alteración hemodinámica pueden inducir la formación de un trombo de fibrina y plaquetas en el endotelio. El trombo es susceptible a la siembra bacteriana por la bacteriemia transitoria, lo que causa activación continua de los monocitos y citocinas, y síntesis de factor tisular. Esto produce crecimiento progresivo de las vegetaciones valvulares infectadas.
En la forma aguda y subaguda-crónica de la EI se forman vegetaciones friables, voluminosas y potencialmente destructivas en las válvulas cardíacas (figura 32-16).
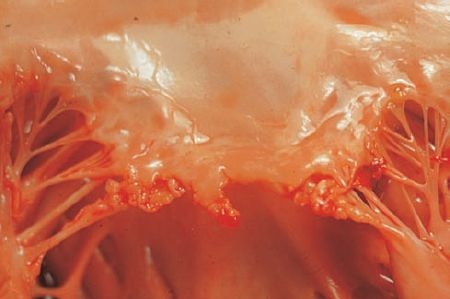
Las válvulas aórtica y mitral son los sitios de infección más frecuentes, aunque también el lado derecho puede estar afectado, sobre todo entre los consumidores de fármacos intravenosos. Estas lesiones vegetativas consisten en una acumulación de organismos infectantes y detritos celulares contenidos en la red de hebras de fibrina de la sangre coagulada. Las lesiones pueden ser únicas o múltiples, pueden crecer hasta medir varios centímetros y casi siempre se encuentran unidas de manera laxa con los bordes libres de la válvula.
Los focos infecciosos liberan bacterias de manera continua hacia la corriente sanguínea y son fuente de bacteriemia persistente. Conforme las lesiones crecen, causan destrucción valvular, lo que causa insuficiencia valvular, abscesos en el anillo valvular con bloqueo cardíaco, pericarditis, aneurisma y perforación valvular.
Las lesiones vegetativas intracardíacas también tienen efectos locales y sistémicos distantes. La organización laxa de estas lesiones permite que los organismos y fragmentos de las lesiones formen émbolos y viajen en la corriente sanguínea, por lo que causan émbolos cerebrales, sistémicos o pulmonares. Los fragmentos pueden alojarse en los vasos sanguíneos pequeños, causan pequeñas hemorragias, abscesos e infarto tisular. La bacteriemia también puede iniciar respuestas inmunitarias consideraras causantes de las manifestaciones cutáneas, poliartritis, glomerulonefritis y otros trastornos inmunitarios.
Manifestaciones clínicas
El período de incubación para el inicio de los síntomas es de 2 semanas o menos en más del 80% de las personas. Sin embargo, si la infección es por Candida, el período de incubación puede ser de hasta 5 meses. Los síntomas iniciales de la EI incluyen fiebre y signos de infección sistémica, cambio en el carácter de un soplo cardíaco preexistente y evidencia de distribución embólica de las lesiones vegetativas. En la forma aguda, la fiebre casi siempre es en espigas y se acompaña de escalofrío.
En la forma subaguda, la fiebre casi siempre es ligera, de inicio gradual y a menudo se acompaña de otros signos sistémicos de inflamación, como esplenomegalia, anorexia, malestar y letargo. A menudo se forman pequeñas hemorragias petequiales cuando los émbolos se alojan en los vasos diminutos de la piel, lechos ungueales y mucosas. Son frecuentes las hemorragias en astilla (líneas rojas oscuras) bajo las uñas de las manos y pies. Puede haber tos, disnea, artralgia o artritis, diarrea y dolor abdominal o en el flanco como resultado de la embolia sistémica. Es factible que haya insuficiencia cardíaca congestiva por destrucción valvular, embolia arterial coronaria o miocarditis.
La insuficiencia renal también es posible por destrucción o toxicidad de antibióticos.
Diagnóstico
La EI todavía presenta desafíos sustanciales para el diagnóstico y tratamiento, a pesar de los avances en su epidemiología y microbiología. El diagnóstico de EI no puede hacerse mediante alguna prueba sencilla, sino que incluye los hallazgos clínicos, de laboratorio y ecocardiográficos. Los criterios de Duke, que fueron modificados por un comité de la AHA en 2005, proporcionan a los médicos una valoración estandarizada de los pacientes con sospecha de EI; integran la evidencia de infección en el hemocultivo, hallazgos ecocardiográficos, hallazgos clínicos e información de laboratorio.
Los criterios de Duke modificados se clasifican en mayores (hemocultivo positivo para EI, evidencia de compromiso endocárdico) y menores (predisposición a la EI, trastornos cardíaco predisponente o consumo de fármacos intravenosos; fiebre con temperatura >38 °C; fenómeno vascular como evidencia de embolia arterial; fenómeno inmunitario como glomerulonefritis; evidencia microbiológica como hemocultivo que no cumpla los criterios mayores). Los casos se clasifican como «definitivos» si cumplen 2 criterios mayores, uno mayor más 2 menores o 5 menores. Los casos se definen como «posibles» si cumplen un criterio mayor y uno menor o 3 criterios menores. El diagnóstico de EI se descarta si se hace un diagnóstico alternativo, si la infección se resuelve con tratamiento antibiótico por 4 días o menos, o si no hay evidencia histológica de infección.
El hemocultivo se mantiene como el procedimiento diagnóstico más definitivo y es esencial para guiar el tratamiento. Deben obtenerse 3 juegos separados de hemocultivos de 3 sitios distintos de punción venosa en 24 h. Sin embargo, el consumo indiscriminado de antibióticos ha hecho mucho más difícil la identificación del organismo causal. Los criterios de Duke modificados recomiendan la inclusión de S. aureus como criterio mayor, ya sea como infección intrahospitalaria o adquirida en la comunidad, así como Streptococcus viridans, Streptococcus bovis y los microorganismos del grupo HACEK. Un hemocultivo positivo único para Coxiella burnetti y un título de anticuerpo antifase IgG >1:800 también se consideran criterios mayores. Es posible que los hemocultivos sean negativos, lo que retrasa el diagnóstico y el tratamiento, y tiene un profundo efecto en el resultado. Esto puede ocurrir por la administración previa de antibióticos o porque los microorganismos causales son de crecimiento lento, requieren un medio de cultivo especial o no son fáciles de cultivar.
La ecocardiografía es la principal técnica para detectar vegetaciones y complicaciones cardíacas de la EI, y es una herramienta importante para el diagnóstico y tratamiento de la enfermedad. El ACC/AHA recomienda la ecocardiografía a todos los pacientes con sospecha de EI. La evidencia ecocardiográfica del compromiso endocárdico ahora es el principal criterio en los criterios de Duke modificados. Se recomienda utilizar la ecocardiografía transtorácica cuando el riesgo o la sospecha clínica son bajos, y la ecocardiografía transesofágica cuando la sospecha clínica es moderada o alta.
Las personas con sospecha elevada incluyen aquellas con válvulas prostéticas, EI previa, enfermedad congénita compleja, insuficiencia cardíaca o soplo cardíaco de reciente aparición.
Tratamiento
EL tratamiento de la EI se enfoca en la identificación y eliminación del microorganismo causal, lo que minimiza los efectos cardíacos residuales, y en corregir los efectos de las embolias. La elección del antibiótico depende del microorganismo cultivado y de que se encuentre en una válvula natural o una prostética. S. aureus, la causa más frecuente de EI, casi siempre causa infecciones intrahospitalarias por catéteres intravasculares, heridas quirúrgicas y dispositivos prostéticos permanentes. Las directrices para la prevención y tratamiento de las infecciones relacionadas con dispositivos cardiovasculares se encuentran en la bibliografía. El surgimiento diseminado de organismos resistentes a múltiples fármacos, incluido S. aureus, impone un desafío terapéutico difícil para el tratamiento de la EI. Además del tratamiento antibiótico, es posible que se requiera cirugía para una infección no resuelta, insuficiencia cardíaca grave y embolia significativa.
La mayoría de los pacientes con EI se cura con tratamiento médico o quirúrgico. Los que han tenido endocarditis infecciosa deben recibir instrucción sobre los signos y síntomas, además de estar informados sobre la posibilidad de recaída o recurrencia. Deben buscar atención médica inmediata si recurren las manifestaciones clínicas. La prevención de la EI con antibióticos es controversial. Las recomendaciones actuales concluyen que sólo una cantidad muy pequeña de casos de EI puede prevenirse con profilaxis antibiótica antes de procedimientos dentales. Por lo tanto, la profilaxis sólo se recomienda para personas con EI previa, cardiopatía congénita (como cardiopatía cianógena no reparada, reparada con material prostético o con defectos residuales), válvulas cardíacas prostéticas y trasplante cardíaco que desarrollan valvulopatía. No se recomienda con base sólo en un riesgo de por vida más alto para contraer EI.
Cardiopatía reumática
La fiebre reumática (FR) y la cardiopatía reumática (CPR) son complicaciones de la respuesta inmunitaria a la infección faríngea por estreptococo del grupo A (hemolítico β). El aspecto más grave de la FR es el desarrollo de trastornos valvulares que causan disfunción cardíaca permanente y a veces insuficiencia cardíaca mortal años más tarde. Aunque la FR y la CPR son raras en países desarrollados, todavía son problemas de salud graves en países no desarrollados, donde la atención sanitaria inadecuada, la desnutrición y las condiciones de hacinamiento prevalecen.
Patogénesis
Los estreptococos hemolíticos β se dividen en varios grupos serológicos con base en su antígeno polisacárido de la pared celular. El grupo A se subdivide en más de 130 tipos M distintos, que son los causantes de la mayoría de las infecciones. La proteína M define mejor la virulencia de la bacteria y se ha estudiado de manera intensiva respecto a su reactividad cruzada con el tejido cardíaco.
Aunque el estreptococo del grupo A (EGA) causa faringitis e infecciones cutáneas (impétigo), sólo la faringitis se vincula con FR y CPR.
La patogénesis de la FR aún se desconoce. El marco temporal para el desarrollo de síntomas en relación con la faringitis y la presencia de anticuerpos contra EGA son muy sugestivos del origen inmunitario. Se cree que los anticuerpos dirigidos contra la proteína M de ciertas cepas de estreptococos tienen reacción cruzada con los antígenos glucoproteína en el corazón, articulaciones y otros tejidos, donde inducen una respuesta autoinmunitaria mediante un fenómeno llamado mimetismo molecular. El inicio de los síntomas 2 o 3 semanas después de la infección y la ausencia de estreptococos en la lesión apoyan esta idea. Aunque sólo un pequeño porcentaje de personas con faringitis por EGA desarrolla FR, la incidencia de recurrencia con una infección subsiguiente no tratada es mucho mayor. Estas observaciones y los estudios más recientes sugieren una predisposición genética al desarrollo de la enfermedad. Además, los elementos ambientales pueden influir en el desarrollo de la FR. Se ha observado que las personas que viven en áreas hacinadas, como barracas militares, tienen mayor incidencia de FR por la elevada virulencia y transmisión rápida.
Manifestaciones clínicas
La FR puede manifestarse como un trastorno agudo, recurrente o crónico. La etapa aguda de la FR incluye el antecedente de una infección estreptocócica y compromiso subsiguiente de elementos del tejido conectivo del corazón, vasos sanguíneos, articulaciones y tejidos subcutáneos. Un elemento común es una lesión llamada cuerpo de Aschoff, que es una zona localizada de necrosis tisular rodeada por células inmunitarias.
La fase recurrente casi siempre implica extensión de los efectos cardíacos.
La fase crónica de la FR se caracteriza por deformidad permanente de las válvulas cardíacas y es causa frecuente de estenosis mitral.
La CPR crónica casi nunca aparece hasta al menos 10 años después del ataque inicial, a veces décadas más tarde.
La mayoría de las personas con FR tiene antecedente de faringitis, cefalea, fiebre (38,3 °C a 40 °C), dolor abdominal, náuseas, vómito, ganglios inflamados (casi siempre en el ángulo mandibular) y otras manifestaciones de infección estreptocócica. Otras manifestaciones clínicas del episodio agudo de la FR se relacionan con el proceso inflamatorio agudo y las estructuras afectadas por la enfermedad.
La evolución de este trastorno se caracteriza por un conjunto de hallazgos que incluyen poliartritis migratoria de articulaciones grandes, carditis, eritema marginado, nódulos subcutáneos y corea de Sydenham. Los marcadores de laboratorio para la inflamación aguda incluyen aumento del conteo de leucocitos, de la VES y de la PCR. Esta elevación de los reactantes de fase aguda no es específica de la FR, pero aportan evidencia de una respuesta inflamatoria aguda.
Poliartritis
La poliartritis es la manifestación más frecuente, y a menudo la primera, de FR en el 75% de los casos. Puede ser el único criterio mayor en adolescentes y adultos. La artritis, que varía desde artralgia hasta artritis incapacitante, con frecuencia afecta articulaciones grandes, en particular rodillas y tobillos; es menos frecuente en muñecas, codos, hombros y caderas. Casi siempre es migratoria, afecta una articulación y luego cambia a otra. Sin tratamiento, la artritis dura alrededor de 4 semanas. Una característica llamativa de la artritis reumática es la respuesta drástica (casi siempre en 48 h) a los salicilatos. Por lo general, la artritis cura por completo y no deja secuelas funcionales.
Carditis
La carditis reumática aguda, que complica la fase aguda de la FR, puede afectar el endocardio, miocardio o pericardio. El compromiso del endocardio y las estructuras valvulares es la causa de los efectos permanentes e incapacitantes de la FR. La carditis se manifiesta casi siempre como insuficiencia mitral, menos a menudo como insuficiencia aórtica, aunque puede afectar las 4 válvulas. Durante la etapa inflamatoria aguda de la enfermedad, las estructuras valvulares se encuentran rojas e inflamadas, y se desarrollan pequeñas lesiones vegetativas en las valvas valvulares. Los cambios inflamatorios agudos avanzan de manera gradual hasta el desarrollo de tejido cicatricial fibroso, que tiende a contraerse y deforman las valvas, con acortamiento de las cuerdas tendinosas. En algunos casos, los bordes o comisuras de las valvas se fusionan conforme procede la curación.
Las manifestaciones clínicas de la endocarditis/valvulitis sin antecedente de CPR incluyen un soplo holosistólico apical de insuficiencia mitral o soplo diastólico temprano basal de insuficiencia aórtica. En algunos pacientes con antecedente de CPR, un cambio en las características de estos soplos o un nuevo soplo indicaría carditis reumática aguda.
Nódulos subcutáneos, eritema marginado y corea de Sydenham
Los nódulos subcutáneos son duros, indoloros y móviles, casi siempre se encuentran en los músculos extensores de la muñeca, codo, tobillo y rodilla; su tamaño varía desde 0,5 cm a 2 cm. Los nódulos subcutáneos rara vez aparecen solos en la FR, suelen formarse en presencia de carditis moderada o grave.
Las lesiones del eritema marginado son máculas semejantes a mapas que, por lo general, aparecen en el tronco o cara interna del brazo o muslo, pero nunca en la cara. Aparecen en una fase temprana de un ataque reumatoide y tienden a acompañarse de nódulos subcutáneos, como en la carditis. Estas manchas son transitorias y desaparecen durante la evolución de la enfermedad.
La corea de Sydenham es la principal manifestación del sistema nervioso central en la FR. Se observa con mayor frecuencia en niñas pequeñas y rara vez ocurre después de los 20 años de edad.
Por lo general existe irritabilidad y otros trastornos del comportamiento de inicio insidioso. El niño a menudo está inquieto, llora con facilidad, comienza a caminar con torpeza y deja caer objetos. Los movimientos coreiformes son espontáneos, rápidos, sin propósito, erráticos que interfieren con las actividades voluntarias. Son frecuentes los gestos faciales, incluso puede afectar el habla. La corea se autolimita, casi siempre evoluciona en semanas o meses, pero no son infrecuentes las recurrencias.
Sólo es posible detectar una infección estreptocócica previa en 2 tercios de los casos, lo que dificulta más el diagnóstico diferencial.
Diagnóstico
No hay pruebas de laboratorio específicas que puedan establecer el diagnóstico de FR. Debido a la variedad de signos y síntomas, se diseñaron los criterios de Jones para el diagnóstico de FR, propuestos por primera vez en 1944 y sometidos a múltiples revisiones de la AHA y la Organización Mundial de la Salud (OMS), para ayudar a estandarizar el diagnóstico de la FR. Los criterios de Jones dividen las manifestaciones clínica en una categoría mayor y otra menor con base en la prevalencia y especificidad. La presencia de 2 signos mayores (carditis, poliartritis, corea, eritema marginado y nódulos subcutáneos) o un signo mayor y 2 menores (artralgia, fiebre y elevación de la VES, PCR o conteo de leucocitos), acompañados de evidencia de una infección previa por EGA, señalan una probabilidad alta de FR. La revisión más reciente de la OMS, en 2004, propone el diagnóstico de un episodio primario de FR, ataques recurrentes de FR con o sin CPR, corea reumática, carditis reumática de inicio insidioso y CPR crónica. La situación epidemiológica en la que se hace el diagnóstico de FR también se considera importante.
El empleo de la ecocardiografía ha mejorado la comprensión de la CPR aguda y crónica. Ayuda a valorar la gravedad de la estenosis o insuficiencia valvular; el tamaño de las cámaras y la función ventricular; y la presencia y tamaño de derrames pleurales. La ultrasonografía Doppler puede ayudar a identificar lesiones cardíacas en personas que no tienen signos típicos de compromiso cardíaco durante un ataque de FR, pero por ahora no se considera en criterio de Jones mayor o menor.
Tratamiento y prevención
Es importante el diagnóstico y tratamiento temprano de las infecciones estreptocócicas para prevenir la FR. El estándar de referencia para detectar la infección estreptocócica es el cultivo faríngeo. Sin embargo, se requieren 24 h a 48 h para obtener los resultados, lo que retrasa el tratamiento. El desarrollo de pruebas rápidas para detección de antígenos de EGA representa una solución al problema, al menos parcial. Tanto el cultivo faríngeo como las pruebas rápidas de antígeno son muy específicas para la infección por EGA, pero están limitadas por su sensibilidad (el paciente puede tener un resultado negativo, pero tiene infección estreptocócica). Cuando se sospecha la infección, un resultado negativo de la prueba de antígeno debe confirmarse con un cultivo faríngeo. La presencia de EGA en la vía respiratoria superior puede indicar un estado portador o infeccioso; este último puede definirse por una respuesta ascendente de anticuerpos. Las pruebas serológicas para anticuerpos estreptocócicos (antiestreptolisina O y antidesoxirribonucleasa B) se realizan para obtener información retrospectiva de infecciones estreptocócicas recientes en personas con sospecha de FR aguda. Sin embargo, no hay una prueba de laboratorio individual que sea patognomónica para FR aguda o recurrente.
El tratamiento de la FR se diseñó para controlar la respuesta inflamatoria aguda y prevenir las complicaciones cardíacas y la recurrencia de la enfermedad. Durante la fase aguda, se prescriben antibióticos, antiinflamatorios y restricción selectiva de actividades. Ningún aislado clínico de EGA es resistente a la penicilina; por lo tanto, la penicilina u otro antibiótico (en pacientes hipersensibles a la penicilina) son el tratamiento de elección para la infección por EGA. Las cefalosporinas de espectro estrecho también se administran con éxito, pero deben evitarse en personas con antecedente de reacción anafiláctica a la penicilina. Pueden consumirse salicilatos y corticoesteroides para suprimir la respuesta inflamatoria, pero no deben administrarse hasta que se confirme el diagnóstico de FR. La cirugía está indicada para la valvulopatía reumática crónica y depende de la gravedad de los síntomas o la evidencia de que la función cardíaca tiene daño significativo. Los procedimientos utilizados incluyen comisurotomía mitral cerrada, reparación valvular y reemplazo valvular.
La persona que ya ha tenido un ataque de FR tiene riesgo alto de recurrencia después de infecciones faríngeas subsiguientes por EGA. La penicilina es el tratamiento de elección para la profilaxis secundaria, pero pueden consumirse sulfadiazina o eritromicina en personas alérgicas a penicilina. La duración de la profilaxis depende de que haya o no alteraciones valvulares residuales.
Se recomienda que las personas con valvulopatía persistente reciban profilaxis al menos durante 5 años después del último episodio de FR aguda o hasta los 21 años de edad en ausencia de carditis.
En la carditis moderada se recomienda que la reciban 10 años o hasta los 21 años de edad y en caso de CPR se recomienda profilaxis por 10 años o hasta los 40 años de edad. La observancia de un plan para la administración profiláctica de penicilina requiere que el paciente y su familia comprendan la justificación de tales medidas. También es necesario instruirlos para que informen las posibles infecciones estreptocócicas a su médico e informen a su odontólogo sobre la enfermedad para que reciban la protección adecuada durante procedimientos dentales que puedan causar traumatismos a la mucosa bucal.