04. Trastornos de los intestinos delgado y grueso
Existen muchas similitudes entre las afecciones que alteran la integridad y la función de los intestinos delgado y grueso. Las paredes de éstos están conformadas por 5 capas:
- Una capa mucosa interna, que recubre el lumen del intestino.
- Una capa submucosa.
- Una capa muscular circular.
- Una capa de fibras musculares de distribución longitudinal.
- Una capa serosa externa.
Entre las condiciones que generan anomalías en la función intestinal se encuentran el síndrome de intestino irritable (SII), la enfermedad intestinal inflamatoria (EII), la diverticulitis, la apendicitis, los trastornos de la motilidad intestinal (ej. diarrea, constipación y obstrucción intestinal), el síndrome por malabsorción y los cánceres del colon y el recto.
Síndrome de intestino irritable
El concepto de síndrome de intestino irritable se utiliza para describir un trastorno GI funcional caracterizado por una combinación variable de síntomas intestinales crónicos y recurrentes que no pueden explicarse a partir de anomalías estructurales o bioquímicas. Existe evidencia que sugiere que entre el 10% y el 15% de la población estadounidense padece el trastorno, así como 1 de cada 4 personas en el mundo.
La enfermedad de intestino irritable se caracteriza por síntomas persistentes o recurrentes de dolor abdominal, anomalías de la función intestinal y malestares diversos, como flatulencia, distensión, náuseas y anorexia, estreñimiento o diarrea, y ansiedad o depresión. Un marco de referencia del SII es el dolor abdominal que se alivia con la defecación y se relaciona con un cambio en la consistencia o la frecuencia de las evacuaciones. El dolor abdominal suele ser intermitente, tipo cólico y afectar el hemiabdomen inferior. No suele presentarse durante la noche o interferir con el sueño. Se cree que esta condición se debe a una regulación anómala de la actividad motora intestinal y de las funciones neurales GI moduladas por el SNC. Las personas con SII tienden a experimentar aumento de la motilidad y contracciones intestinales anómalas, en respuesta a tensiones psicológicas y fisiológicas. El papel que juegan los factores psicológicos en la enfermedad es incierto. Si bien, los cambios en la actividad intestinal son respuestas normales al estrés, estas respuestas parecen ser exageradas en personas con SII. La enfermedad tiene mayor incidencia en mujeres que en varones y, a menudo, la menarca se asocia al inicio del trastorno. Es frecuente que las mujeres observen alguna exacerbación de los síntomas durante el período premenstrual, lo que sugiere un componente hormonal.
Manifestaciones clínicas y diagnóstico
Puesto que el SII carece de marcadores anatómicos o fisiológicos, el diagnóstico suele basarse en los signos y síntomas de dolor o malestar abdominal, distensión y estreñimiento o diarrea, o bien por episodios alternantes de estreñimiento y diarrea. Una serie de criterios diagnósticos de empleo frecuente requieren la presencia de síntomas continuos o recurrentes con duración de por lo menos 12 semanas (que pueden no ser consecutivas) con malestar abdominal o dolor en los 12 meses precedentes, con 2 de 3 de las siguientes características acompañantes: alivio con la defecación, inicio relacionado con una modificación en la frecuencia de las evacuaciones e inicio asociado a un cambio de la forma (aspecto) de las heces.
Otros síntomas que respaldan el diagnóstico de SII incluyen una frecuencia anómala de evacuaciones (más de 3 veces por día o menos de 3 veces por semana), la forma anómala de las heces (escíbalos/induración o semidiarreicas/acuosas), las anomalías que se presentan durante la defecación (pujo, urgencia o tenesmo), la expulsión de moco y la distensión o sensación de distensión abdominal. El antecedente de intolerancia a la lactosa debe tomarse en consideración, ya que en algunas personas la intolerancia a éste y otros azúcares pudiera ser un factor precipitante. El inicio agudo de los síntomas incrementa la probabilidad de que exista enfermedad orgánica, al igual que la pérdida ponderal, la anemia, la fiebre, la sangre oculta en heces, los síntomas nocturnos, o los signos y síntomas de malabsorción. Estos signos y síntomas hacen necesaria una valoración adicional de los diagnósticos diferenciales.
Tratamiento
El tratamiento de la SII se concentra en las técnicas para el control del estrés, en particular el que se relaciona con la inducción de los síntomas. Es importante reconfortar al paciente. Por lo general, no existe indicación para una dieta especial; no obstante, suele recomendarse un consumo adecuado de fibra. Evitar las sustancias lesivas mediante el seguimiento de dietas que eliminan los alimentos grasosos y los que generan gases, el alcohol y las bebidas que contengan cafeína, pudiera ser una medida benéfica.
Distintos medicamentos, como los antiespasmódicos y anticolinérgicos, se han utilizado con éxito variable para el tratamiento del trastorno. El alosetrón, un antagonista 5-HT3, fue el primer medicamento específico autorizado por la FDA para el tratamiento de la enfermedad por intestino irritable. Actúa al reducir la secreción intestinal, disminuir la actividad aferente nerviosa visceral (con lo que decrece el dolor abdominal) y al disminuir la motilidad intestinal. El medicamento, que se encontraba indicado para el tratamiento de mujeres con la variante diarreica grave de la enfermedad, se retiró del mercado al fines del año 2000 al causar efectos colaterales graves, entre otros, colitis isquémica y estreñimiento grave; luego, se reintrodujo en 2002 mediante un programa para prescripción restringida.
Enfermedad intestinal inflamatoria
El concepto de enfermedad intestinal inflamatoria (EII) se emplea para designar 2 afecciones intestinales inflamatorias relacionadas: la enfermedad de Crohn y la colitis ulcerosa. La prevalencia mundial de la EII es de 396 casos por 10.000 personas. Si bien, estas 2 enfermedades difieren en grado suficiente para poder distinguirse, tienen muchas características en común. Los 2 trastornos generan inflamación del intestino, ambos carecen de evidencia para confirmación relacionada con un agente causal comprobado, los 2 cuentan con un patrón de distribución familiar y también se acompañan de manifestaciones sistémicas. La enfermedad de Crohn afecta con más frecuencia las regiones distal del intestino delgado y proximal del colon; no obstante, puede afectar cualquier región del tubo GI, desde el esófago hasta el ano, en tanto que la colitis ulcerosa se limita al colon y al recto (figura 45-7).
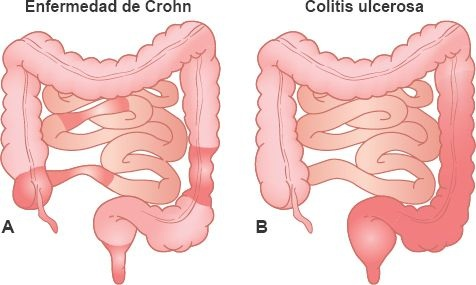
La diferenciación entre las características de la enfermedad de Crohn y la colitis ulcerosa se resumen en la tabla 45-1.
| Características | Enfermedad de Crohn | Colitis ulcerosa |
|---|---|---|
| Tipos de inflamación | Granulomatosa | Ulcerativa y exudativa |
| Nivel de afectación | Submucoso, de manera primordial | Mucoso, de manera primordial |
| Extensión de la afectación | Lesiones intercaladas | Continua |
| Áreas de afectación | Íleon de manera primordial, colon en forma secundaria | Recto y hemicolon izquierdo de manera primordial |
| Diarrea | Común | Común |
| Hemorragia rectal | Rara | Común |
| Fístulas | Comunes | Raras |
| Estenosis | Comunes | Raras |
| Abscesos perianales | Comunes | Raras |
| Desarrollo de cáncer | Poco frecuente | Relativamente común |
Etiología y patogénesis
Una característica notable del tubo GI es que el sistema inmunitario de la mucosa siempre está listopara responder contra los patógenos ingeridos, pero no responde ante la microflora intestinal normal. De acuerdo con la hipótesis que se acepta en la actualidad, este estado normal de homeostasis se altera en la EII, lo que genera respuestas inmunitarias exageradas y carentes de regulación. Persiste la interrogante de si la respuesta corresponde a un mecanismo de defensa apropiado contra un patógeno o si se trata del sistema inmunitario que responde de manera inapropiada. Así, al igual que muchos trastornos autoinmunitarios, la patogénesis de la enfermedad de Crohn y la colitis ulcerosa implica un fallo en la regulación inmunitaria, la predisposición genética y un desencadenante ambiental, en particular flora microbiana.
Susceptibilidad genética
Durante mucho tiempo se ha sospechado que existe una base genética para la EII. Los parientes en primer grado de los pacientes con diagnóstico de EII tienen una incidencia entre 30 y 100 veces mayor de la enfermedad. En el caso de la enfermedad de Crohn, un estudio reciente encontró una tasa de concordancia del 27% en gemelos monocigóticos y del 2% en gemelos dicigóticos. En la colitis ulcerosa, este componente genético parece ser más débil, pero existe. Estas asociaciones indican con claridad que la susceptibilidad genética desempeña un papel importante en el desarrollo de la EII. Sin embargo, no se identifica un patrón de herencia mendeliano clásico y, por ende, la EII no puede atribuirse a un solo gen. Se sabe que muchos genes candidatos se relacionan con el desarrollo de EII y, quizá, contribuyan al mismo. Incluyen asociaciones con los antígenos leucocitarios humanos (ALH).
La evidencia que se está acumulando también sugiere que tanto la enfermedad de Crohn como la colitis ulcerosa se vinculan con trastornos profundos de la inmunidad de la mucosa. En fecha reciente se demostró que el locus IBD1 en el cromosoma 16 contribuye a la enfermedad de Crohn. El producto del gen implicado, la NOD2 (denominada así debido a que la proteína codificada tiene un dominio de oligomerización de nucleótidos) activa al factor de transcripción del factor nuclear κ β (FN-κβ). La proteína NOD2 se expresa en muchos tipos de leucocitos y también en las células epiteliales, y se cree que actúa como un receptor intracelular para los lipopolisacáridos de los microbios. Al unirse los productos microbianos, pudieran desencadenar la vía del FN-κβ, lo que conduce a la síntesis de citocinas y de otras proteínas que participan en la defensa inmunitaria innata contra los microorganismos.
Las mutaciones de la NOD2 que se relacionan con la enfermedad de Crohn pudieran reducir la actividad de la proteína, lo que origina la persistencia de los microbios intracelulares y respuestas inmunitarias prolongadas. Otra región estudiada en forma extensa es la IBD3 en el cromosoma 6. Se trata del área que incluye al complejo del ALH que se ha vinculado con la enfermedad de Crohn y la colitis ulcerosa. Otra área que tiene un vínculo específico con la enfermedad de Crohn se ubica en el brazo cromosómico 5q (IBD5); que es rica en genes que codifican varias citocinas y que pudieran contribuir a la enfermedad.
Papel de los factores ambientales
Estudios en animales han determinado de manera definitiva la importancia de la flora intestinal en la EII. Los sitios afectados por la EII, el íleon distal y el colon, contienen gran cantidad de bacterias. Si bien, es poco probable que la EII sea generada por los microbios, parece probable que éstos pudieran proveer el desencadenante antigénico para la respuesta inmunitaria carente de regulación.
Otro factor ambiental relacionado con la EII es el tabaquismo. La enfermedad de Crohn se vincula más a menudo con personas que presentan tabaquismo activo; en tanto, la colitis ulcerosa se asocia con individuos que nunca han fumado o dejaron de fumar. Se cree que la relación entre la nicotina y la EII deriva de coagulopatías que se verifican en el intestino, o que son consecuencia de una respuesta inmunitaria.
Manifestaciones clínicas
Las manifestaciones clínicas tanto de la enfermedad de Crohn como de la colitis ulcerosa son, por último, resultado de la activación de las células inflamatorias, con síntesis de mediadores inflamatorios que inducen daño tisular inespecífico. Los 2 trastornos se caracterizan por remisiones y exacerbaciones de cuadros diarreicos, urgencia fecal y pérdida ponderal. Durante los cuadros de enfermedad fulminante pueden presentarse complicaciones agudas, como obstrucción intestinal (figura 45-8).
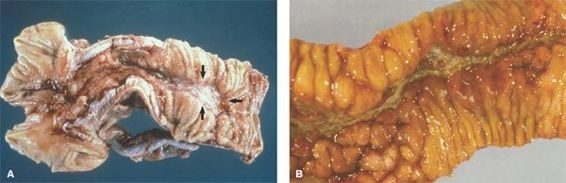
En personas con enfermedad de Crohn y colitis ulcerosa se han identificado distintas manifestaciones sistémicas. Incluyen artritis axial, que afecta la columna vertebral en las articulaciones sacroiliacas, así como artritis oligoarticular, que afecta las articulaciones grandes de los brazos y las piernas; condiciones inflamatorias oftálmicas, por lo general uveitis; lesiones cutáneas, en especial eritema nodoso; estomatitis, anemia autoinmunitaria, hipercoagulabilidad y colangitis esclerosante. En ocasiones estas manifestaciones sistémicas pueden anunciar la recurrencia de la enfermedad intestinal. En los niños puede presentarse retraso del crecimiento, en particular si los síntomas son prolongados y el consumo de nutrimentos ha sido deficiente.
Enfermedad de Crohn
Es una variante granulomatosa recurrente, de respuesta inflamatoria, que puede afectar cualquier área del tubo GI. El íleon terminal, o el ciego, son las estructuras del intestino donde se desarrolla la inflamación con mayor frecuencia. Se trata de una enfermedad de evolución lenta, progresiva y con frecuencia discapacitante. El trastorno suele afectar a las personas en la tercera o cuarta décadas de la vida y las mujeres la padecen con una frecuencia un poco superior, en comparación con los varones.
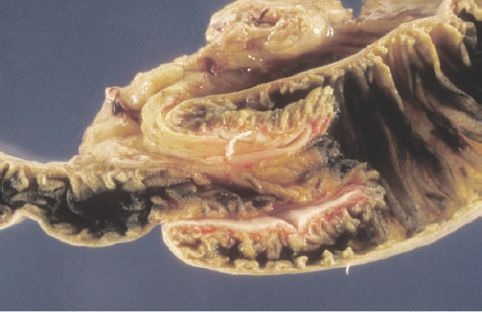
Una característica de la enfermedad de Crohn corresponde a las lesiones granulomatosas bien delimitadas y circundadas por tejido mucoso de aspecto normal. Cuando las lesiones son múltiples,suelen denominarse lesiones intercaladas, dado que se encuentran distribuidas entre lo que parecen segmentos normales de intestino. Aunque se afectan todas las capas del intestino, la submucosa es la que se altera en mayor medida. Por lo regular, la superficie del intestino inflamado presenta un aspecto de «empedrado», que deriva de las fisuras y grietas que se forman, circundadas por áreas con edema submucoso (figura 45-9).
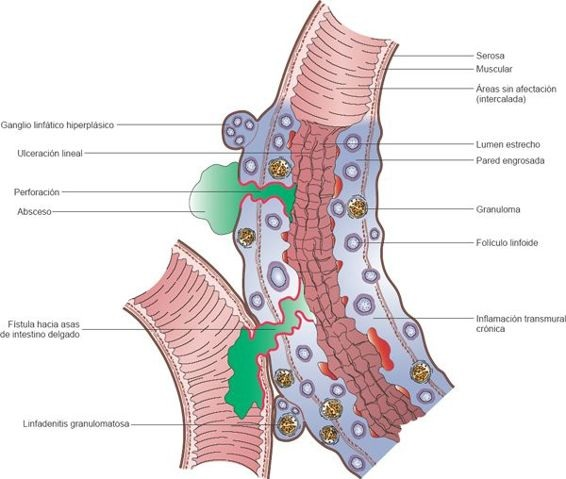
Suele existir un respeto relativo de las capas de músculo liso del intestino, con cambios inflamatorios y fibróticos marcados en la capa submucosa. Después de algún tiempo, la pared intestinal suele engrosarse y volverse inflexible; su aspecto se ha comparado con el de una tubería de plomo o una manguera de hule. El mesenterio adyacente puede desarrollar inflamación; los ganglios linfáticos regionales y los canales linfáticos pueden aumentar su tamaño.
Manifestaciones clínicas
La evolución clínica de la enfermedad de Crohn es variable; con frecuencia existen períodos de exacerbación y remisión, con síntomas que se relacionan con la ubicación de las lesiones. Los síntomas principales, que dependen de la zona del sistema GI afectada, incluyen diarrea, dolor abdominal, pérdida ponderal, trastornos hidroelectrolíticos, malestar general y febrícula. Puesto que la enfermedad de Crohn afecta la capa submucosa en mayor medida que la capa mucosa, la diarrea hemática es menos frecuente que en la colitis ulcerosa. La ulceración de la piel perianal es común, en gran medida por la intensidad de la diarrea. La superficie de absorción del intestino puede comprometerse; es posible el desarrollo de insuficiencias nutricionales que se vinculan con el segmento específico del intestino afectado. Cuando la enfermedad de Crohn se presenta en la niñez, una de sus manifestaciones principales puede ser el retraso del crecimiento y la desnutrición intensa.
Las complicaciones de la enfermedad de Crohn incluyen la formación de fístulas, el desarrollo de abscesos abdominales y la obstrucción intestinal. Las fístulas son conductos similares a tubos que forman conexiones entre distintos puntos del tubo GI. También pueden desarrollarse hacia otras estructuras, entre otras, la vejiga, la vagina, la uretra y la piel. Las fístulas perineales que se originan en el íleon son relativamente comunes. Las fístulas entre los segmentos del tubo GI pueden conducir al desarrollo de malabsorción, síndromes por sobrecrecimiento bacteriano y diarrea. También pueden infectarse y originar abscesos.
Diagnóstico
El diagnóstico de la enfermedad de Crohn hace necesario un interrogatorio clínico y una exploración física detallados. La sigmoidoscopia se utiliza para visualizar de manera directa las áreas afectadas y tomar biopsias. Se toman medidas para excluir a los agentes infecciosos como causa del trastorno. Esto suele lograrse mediante coprocultivos y el análisis de especímenes frescos de heces para identificar huevos y parásitos. En personas en quienes se sospecha enfermedad de Crohn, los estudios radiológicos con contraste aportan un medio para determinar la extensión de la afectación del intestino delgado e identificar la presencia y la naturaleza de las fístulas. Puede recurrirse a estudios de TC para detectar una masa inflamatoria o un absceso.
Tratamiento
Las estrategias terapéuticas se concentran en detener la respuesta inflamatoria y promover la cicatrización, mantener una nutrición adecuada y prevenir y tratar las complicaciones.
Varios medicamentos han tenido éxito para suprimir la reacción inflamatoria, entre otros, corticoesteroides, sulfasalazina, metronidazol, azatioprina, 6-mercaptopurina, metotrexate e infliximab. Puede ser necesaria la resección quirúrgica del intestino dañado, el drenaje de losabscesos o la reparación de los tractos fistulosos.
La sulfasalazina es un medicamento con actividad tópica con efectos antiinflamatorios variables. Sus efectos benéficos se atribuyen a uno de sus componentes, el ácido 5-aminosalicílico (5-ASA).
Los fármacos que contienen 5-ASA afectan sitios múltiples de la vía del ácido araquidónico, que es fundamental para la patogénesis de la inflamación. La sulfasalazina contiene 5-ASA con una sulfapiridina unida mediante un enlace azo. El medicamento se absorbe poco a partir del intestino y el enlace azo es degradado por la flora bacteriana en el íleon y el colon, para liberar el 5-ASA.
El metronidazol es un antibiótico que se emplea para el tratamiento del sobrecrecimiento bacteriano en el intestino delgado. Un metaanálisis reciente encontró que 2 tiopurinas, la azatioprina y la 6-mercaptopurina, son efectivas para reducir la reincidencia de la enfermedad de Crohn. El consumo del metotrexate es otra alternativa para los clínicos que desean sustituir las tiopurinas; no obstante, los estudios relativos a su consumo son limitados. El infliximab es un anticuerpo monoclonal, cuyo objetivo es destruir al factor de necrosis tumoral (FNT), un mediador de la respuesta inflamatoria, cuya expresión se incrementa en los procesos inflamatorios como la enfermedad de Crohn. Se trata del primer fármaco autorizado de manera específica para la enfermedad de Crohn y se emplea en el tratamiento de quienes padecen enfermedad de Crohn activa moderada o grave que presentaron una respuesta inadecuada a los corticoesteroides u otros moduladores inmunitarios. Si bien el infliximab es en la actualidad el único medicamento antiFNT autorizado para el tratamiento de personas con EII, se están realizando estudios controlados con otros fármacos antiFNT e inmunomoduladores, como talidomida, adalimumab y certolizumab pegol.
En la enfermedad de Crohn las insuficiencias nutricionales son comunes, debido a la diarrea, la esteatorrea y otros problemas derivados de malabsorción. Se recomienda una dieta nutritiva rica en calorías, vitaminas y proteínas. Ya que las grasas con frecuencia agravan la diarrea, se recomienda evitarlas. Las dietas elementales, que aportan una nutrición balanceada pero carecen de residuos y volumen, pueden recomendarse durante la fase aguda de la enfermedad. Estas dietas se absorben en gran medida en el yeyuno y permiten que el intestino inflamado repose.
La nutrición parenteral total (es decir, hiperalimentación parenteral) consiste en la infusión intravenosa de soluciones hipertónicas de glucosa, a las que se agregan aminoácidos y lípidos. Esta variante de tratamiento nutricional puede ser necesaria cuando no es posible la absorción de los alimentos en el intestino. Debido a la hipertonicidad de estas soluciones, deben administrarse a través de una vena central de gran diámetro.
Colitis ulcerosa
Es una condición inflamatoria inespecífica del colon. La enfermedad es más frecuente en Estados Unidos y los países occidentales. El trastorno puede manifestarse a cualquier edad, con una incidencia máxima entre los 15 y los 25 años. A diferencia de la enfermedad de Crohn, que afecta distintas regiones del tubo GI, la colitis ulcerosa se limita al recto y al colon. Suele iniciar en el recto y extenderse en sentido proximal, para afectar de manera primordial la capa mucosa, aunque puede extenderse hasta la submucosa. La distancia de la extensión proximal varía. Puede afectar sólo al recto (proctitis ulcerosa), al recto y al colon sigmoides (proctosigmoiditis) o a todo el colon (pancolitis). El proceso inflamatorio tiende a confluir y mostrar continuidad, en vez de dejar áreas respetadas, como la enfermedad de Crohn.
Características de la enfermedad son las lesiones que se forman en las criptas de Lieberkühn, en la base de la capa mucosa. El proceso inflamatorio tiende a la formación de hemorragias mucosas puntiformes, que con el tiempo presentan supuración y se convierten en abscesos crípticos. Estas lesiones inflamatorias pueden desarrollar necrosis y ulcerarse. Si bien las ulceraciones suelen ser superficiales, a menudo se extienden y generan grandes áreas denudadas (figura 45-10).
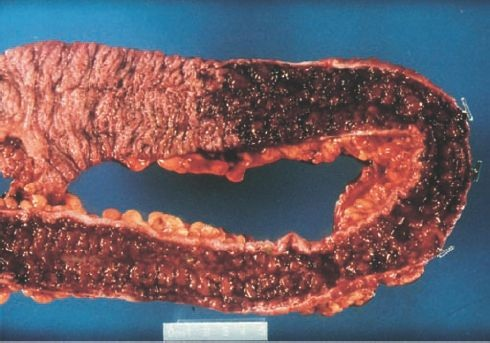
Como consecuencia del proceso inflamatorio, la capa mucosa con frecuencia desarrolla proyecciones similares a lengüetas que se asemejan a pólipos y, por ende, se denominan seudopólipos. La pared intestinal se engrosa en respuesta a los episodios repetidos de colitis.
Manifestaciones clínicas
La colitis ulcerativa presenta de manera típica desórdenes reincidentes marcados por cuadros de diarrea. La diarrea puede persistir días, semanas o meses, y luego ceder, para reincidir después de un intervalo asintomático de varios meses, años o incluso décadas. Debido a que la colitis ulcerosa afecta la capa mucosa del intestino, la presencia de sangre y moco en las heces es una característica. Cuando los síntomas diurnos son intensos suele haber diarrea nocturna. Pueden presentarse dolor cólico intestinal leve e incontinencia fecal. Anorexia, debilidad y tendencia a la fatiga son comunes.
Con base en los hallazgos clínicos y endoscópicos, la enfermedad se describe de acuerdo con la extensión afectada del colon y el grado de inflamación. Según su gravedad se define como leve, moderada, grave o fulminante. La variante más frecuente de enfermedad es la leve, en que la persona tiene menos de 4 evacuaciones por día, con o sin sangre, carece de signos sistémicos de toxicidad y presenta una velocidad de sedimentación globular (VSG) normal.
Las personas con enfermedad moderada presentan más de 4 evacuaciones por día y signos mínimos de toxicidad. La enfermedad grave se manifiesta por más de 6 evacuaciones sanguinolentas por día, con evidencia de toxicidad, según lo revelan la fiebre, taquicardia, anemia y la elevación de la VSG (figura 45-11).
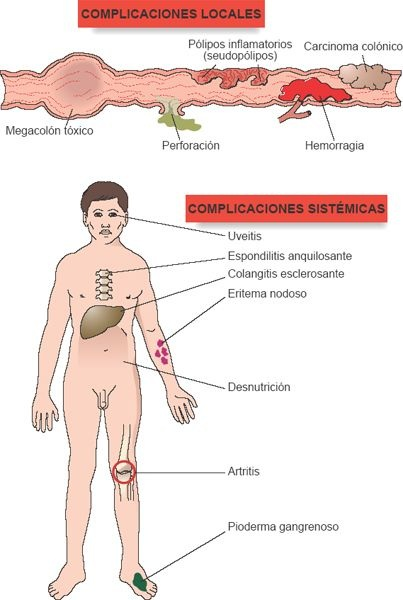
Los individuos con enfermedad fulminante se caracterizan por tener más de 10 evacuaciones por día, hemorragia continua, fiebre y otros signos de toxicidad; hipersensibilidad a la palpación abdominal y distensión; necesidad de transfusiones sanguíneas y dilatación colónica en la radiografía abdominal. Estas personas se encuentran en riesgo de desarrollar megacolon tóxico, que se caracteriza por la dilatación del colon y por signos de toxicidad sistémica. Se debe a la expansión de la respuesta inflamatoria, con afectación de los componentes neurales y vasculares del intestino.
Diagnóstico y tratamiento
El diagnóstico de la colitis ulcerosa se basa en el interrogatorio clínico y la exploración física. Suele confirmarse mediante sigmoidoscopia, colonoscopia, biopsia y resultados negativos en los estudios de heces que buscan descartar agentes infecciosos y de otros tipos. La colonoscopia debe evitarse en personas con enfermedad grave, por el riesgo de perforación, pero puede practicarse una vez que se demuestra mejoría para determinar la extensión de la enfermedad y la necesidad de vigilancia subsecuente a fin de detectar desarrollo de cáncer.
El tratamiento depende de la extensión de la enfermedad y la gravedad de los síntomas. Incluye medidas para controlar las manifestaciones agudas del trastorno y prevenir su recurrencia. Algunas personas con síntomas leves o moderados pueden controlar éstos con sólo evitar el consumo de cafeína, lactosa (leche) y alimentos condimentados o que producen gases. Los complementos de fibra pueden utilizarse para disminuir la diarrea y los síntomas rectales. El tratamiento quirúrgico (es decir, extirpación del recto y el colon en su totalidad), con la formación de una ileostomía o una anastomosis ileoanal, puede ser necesario en quienes no responden a los medicamentos o a las medidas conservadoras.
Los medicamentos que se utilizan para el tratamiento de la colitis ulcerosa son similares a los que se utilizan para el manejo de la enfermedad de Crohn. Incluyen compuestos no absorbibles de 5-ASA (ej. mesalamina, olsalazina). Los corticoesteroides se emplean de manera selectiva para disminuir la respuesta inflamatoria aguda. Muchos de éstos pueden administrarse por vía rectal, en supositorios o en enemas. Puede recurrirse a fármacos inmunomoduladores y antiFNT para el manejo de personas con colitis grave.
El cáncer del colon es una de las complicaciones temidas de la colitis ulcerosa a largo plazo. La colitis ulcerosa se caracteriza por el daño al ácido desoxirribonucleico (ADN), con inestabilidad microsatelital en las células de la mucosa. En fechas recientes se detectó inestabilidad genómica en áreas carentes de displasia en personas con colitis ulcerosa; lo anterior sugiere que existe en ellas una insuficiencia para la reparación del ADN e inestabilidad genómica en todo el tracto intestinal. Un metaanálisis que se concentró en los estudios realizados en individuos con colitis ulcerosa reveló que el riesgo acumulado de cáncer colorrectal fue del 1,6% a los 10 años; el 8,6% a los 20 años y el 18,4% a los 30 años. Todas las personas con este diagnóstico deben practicarse colonoscopia con fines de detección durante los siguientes 8 años después de haber iniciado los síntomas. La frecuencia con que deben realizarse las colonoscopias para vigilancia varía muchas veces entre 1 y 3 años, y depende de los resultados obtenidos de las exploraciones y las biopsias.
Enterocolitis infecciosa
Distintos agentes microscópicos, entre otros virus, bacterias y protozoarios, pueden infectar el tubo GI, causar diarrea y, a veces, producir cambios ulcerativos e inflamatorios en el intestino delgado o grueso. La enterocolitis infecciosa es un problema mundial, que genera más de 12.000 muertes por día en niños que habitan en países en desarrollo. Si bien, es mucho menos común en países industrializados, estos trastornos aún cuentan con tasas de infección que sólo son precedidas por el resfriado común. La mayoría de las infecciones se diseminan por vía orofecal, en muchas ocasiones a través del agua o los alimentos contaminados.
Infección viral
La mayoría de las infecciones virales afecta al epitelio superficial del intestino delgado, destruyendo estas células y comprometiendo su función de absorción. La recuperación de las vellosidades del intestino delgado por mediación de enterocitos inmaduros y la conservación de las células secretorias de las criptas conduce a una secreción neta de agua y electrolitos, que se conjunta con una absorción incompleta de nutrimentos y con la diarrea osmótica. La enfermedad sintomática se debe a distintos virus específicos, entre otros, rotavirus, que afecta con más frecuencia a niños de 6 a 24 meses de edad; el norovirus (o virus Norwalk), responsable de la mayoría de los casos de gastroenteritis epidémica no bacterianos transmitidos por alimentos en todos los grupos de edad y los adenovirus entéricos, que de manera primordial afectan a niños menores de 24 meses de edad.
Rotavirus
El rotavirus es la causa principal de diarrea grave en todo el mundo y se calcula que por año genera la muerte de 527.000 niños menores de 5 años. Antes de 2006, la enfermedad era responsable de 400.000 consultas médicas y entre 20 y 60 muertes en niños menores de 5 años en Estados Unidos. En 2006, la FDA autorizó una vacuna oral con virus vivos contra el rotavirus. En 1998 se autorizó una vacuna distinta con virus vivos, pero se retiró del mercado menos de un año después, cuando varios lactantes desarrollaron intususcepción tras recibir el biológico.
La enfermedad tendía a ser más grave en niños de 3 a 24 meses de edad. Los lactantes menores de 3 meses de edad se encontraban relativamente protegidos por los anticuerpos de adquisición transplacentaria y, quizá, por la lactancia materna. El virus se disemina por vía orofecal y son comunes los brotes en niños que acuden a guarderías. El virus se elimina varios días antes y después del desarrollo del cuadro clínico. Se requieren muy pocos viriones infectantes para generar el trastorno en un hospedero susceptible.
De manera característica, la infección por rotavirus inicia tras un período de incubación de 1 a 3 días, con fiebre leve o moderada y vómito, a los que sigue el desarrollo de evacuaciones acuosas frecuentes. La fiebre y el vómito suelen desaparecer alrededor del segundo día, pero la diarrea persiste entre 5 y 7 días. La deshidratación puede desarrollarse con rapidez, en particular en lactantes.
El tratamiento es en gran medida de soporte. La prevención y el tratamiento de la deshidratación son las metas principales.
Infección bacteriana
La enterocolitis infecciosa puede derivar de distintas bacterias. Existen varios mecanismos patogénicos para la enterocolitis bacteriana: ingestión de toxinas preformadas presentes en alimentos contaminados; infección por microorganismos toxigénicos, que proliferan en el lumen intestinal y sintetizan una enterotoxina, o infección por microorganismos enteroinvasivos, que proliferan en el lumen e invaden y destruyen las células del epitelio mucoso. Los efectos patogénicos de las infecciones bacterianas dependen de la capacidad del microorganismo para adherirse a las células del epitelio mucoso, sintetizar enterotoxinas y luego invadir a las células de la mucosa.
En general, las infecciones bacterianas generan efectos más graves que las infecciones virales.
Las complicaciones de la enterocolitis bacteriana se deben a la pérdida masiva de líquidos o a la destrucción de la mucosa intestinal, e incluyen deshidratación, septicemia y perforación. Entre los microorganismos que generan enterocolitis bacteriana se encuentran Staphylococcus aureus (toxinas asociadas con la «intoxicación alimentaria»), Escherichia coli, especies de Shigella, Salmonella y Campylobacter. Dos variantes en particular graves de enterocolitis bacteriana se deben a Clostridium difficile y a E. coli O157:H7.
Colitis por Clostridium difficile
Este tipo de colitis se relaciona con el tratamiento antibiótico.
Clostridium difficile es un bacilo grampositivo formador de esporas, que es parte de la flora normal en 1% a 3% de los humanos. Las esporas son resistentes al ambiente ácido del estómago y se convierten en formas vegetativas en el colon. El tratamiento con antibióticos de amplio espectro predispone a la disrupción de la flora bacteriana protectora normal del colon, lo que permite la colonización por C. difficile, junto con la liberación de toxinas que generan daño e inflamación en la mucosa. Casi cualquier antibiótico puede inducir colitis por C. difficile, pero los de amplio espectro que tienen actividad contra las bacterias entéricas gramnegativas son los medicamentos causales más frecuentes. Una vez que el tratamiento antibiótico deja al intestino susceptible la infección, tiene lugar la colonización por C. difficile por vía orofecal. La infección por C. difficile suele adquirirse en el hospital, donde a menudo se encuentra el microorganismo.
En general, C. difficile no es invasivo. El desarrollo de colitis y diarrea por C. difficile requiere de una alteración de la flora intestinal normal, la adquisición y la germinación de las esporas, el crecimiento excesivo de C. difficile y la síntesis de toxinas. Las toxinas se unen a la mucosa intestinal y la dañan, lo que produce hemorragia, inflamación y necrosis. Las toxinas también interfieren con la síntesis de proteínas, atraen células inflamatorias, incrementan la permeabilidad capilar y estimulan la peristalsis intestinal. Por lo regular, la infección se manifiesta por diarrea leve o moderada; en ocasiones se acompaña de dolor cólico intestinal en el hemiabdomen inferior. De manera característica, los síntomas comienzan en el transcurso de 4 a 9 días, tras el inicio del tratamiento antibiótico y en la mayoría de los casos no existen manifestaciones sistémicas y los síntomas ceden una vez que se suspende el tratamiento con antibióticos.
Una variante más grave de colitis, la colitis seudomembranosa, se caracteriza por el desarrollo de una membrana inflamatoria adherente que cubre las regiones que presentan daño mucoso. Se trata de una variante de la enfermedad que pone en riesgo la vida. Las personas que la desarrollan se observan muy enfermas y presentan letargo, fiebre, taquicardia, dolor y distensión abdominales, así como deshidratación. El tono del músculo liso del colon puede perderse, lo que da origen a la dilatación tóxica de esa estructura. Se requiere tratamiento con prontitud a fin de prevenir la perforación intestinal.
El diagnóstico de la diarrea asociada a C. difficile hace necesaria una anamnesis cuidadosa, con énfasis particular en el empleo de antibióticos. Los hallazgos diagnósticos incluyen el antecedente de empleo de antibióticos y pruebas de laboratorio que confirman la presencia de toxinas de C. difficile en las heces. El tratamiento incluye la suspensión inmediata del tratamiento con antibióticos. El tratamiento específico, que se dirige a la erradicación de C. difficile, se administra cuando los síntomas son graves o persistentes. El metronidazol es el fármaco de elección, en tanto la vancomicina se reserva para las personas que no toleran ese medicamento, no responden al mismo o tienen síntomas graves. El metronidazol puede administrarse por vía intravenosa u oral. Cuando se administra por esta última vía se absorbe a partir del tubo GI proximal y puede inducir efectos colaterales, como náuseas. La vancomicina puede administrarse por vía oral o mediante enema. Su absorción sistémica es deficiente y sus acciones se limitan al tubo GI, lo que genera un número menor de efectos colaterales.
Infección por Escherichia coli O157:H7
Escherichia coli O157:H7 se reconoce como una causa importante de colitis epidémica y esporádica. Escherichia coli O157:H7 es una cepa de E. coli que se identifica en las heces y en la leche contaminada del ganado bovino saludable para producción láctea y de carne, aunque también se ha identificado en el puerco, la carne de ave y la carne de cordero contaminadas. La infección suele derivar de la transmisión alimentaria, muchas veces por el consumo de hamburguesas mal cocinadas. El microorganismo también puede trasladarse a productos distintos a la carne, como las frutas y los vegetales. Además, se ha referido su transmisión en personas que nadan en un lago contaminado y en visitantes de granjas y zoológicos que permiten el contacto con los animales, donde los niños entran en contacto directo con éstos. La transmisión directa entre personas es posible, en especial en asilos, guarderías y hospitales. Los individuos muy jóvenes y adultos mayores se encuentran en riesgo particular de desarrollar la infección y sus complicaciones.
La infección puede no generar síntomas o inducir manifestaciones diversas, como diarrea aguda no sanguinolenta, colitis hemorrágica, síndrome urémico hemolítico (SUH) y púrpura trombocitopénica trombótica. Muchas veces la infección se manifiesta por dolor cólico intestinal y diarrea acuosa, que de manera subsecuente puede evolucionar a una diarrea sanguinolenta. La diarrea suele persistir entre 5 y 10 días.
La mayor parte de las cepas de E. coli son inocuas. Sin embargo, E. coli enterohemorrágica es capaz de liberar toxinas similares a las de Shigella, que se adhieren al recubrimiento mucoso del intestino y lo dañan. De manera subsecuente, las toxinas semejantes a las de Shigella ingresan al sistema circulatorio y viajan en el plasma, y sobre la superficie de las plaquetas y los monocitos. Las toxinas similares a las de Shigella se unen a los receptores de gran afinidad que contienen galactosa en las membranas de las células endoteliales glomerulares, cerebrales o microvasculares; de igual forma que las células mesangiales y tubulares del riñón, y los monocitos y las plaquetas. Dos complicaciones de la infección, el SUH y la púrpura trombocitopénica trombótica, derivan de los efectos de las toxinas similares a las de Shigella. El SUH se caracteriza por anemia hemolítica, trombocitopenia e insuficiencia renal. Se presenta de manera predominante en lactantes y niños pequeños, y es la causa más frecuente de insuficiencia renal aguda en niños.
Un estudio reciente encontró que los pacientes con SUH presentan una tasa mortalidad del 4,6%. La púrpura trombocitopénica trombótica se manifiesta por trombocitopenia, insuficiencia renal, fiebre y síntomas neurológicos. Con frecuencia se le considera la complicación grave de la enfermedad, dado que conduce al desarrollo de SUH y a diversos problemas neurológicos.
No se dispone de tratamiento específico para la infección por E. coli O157:H7. Éste es en gran medida sintomático y se dirige al manejo de los efectos de las complicaciones. Se ha demostrado que el consumo de antibióticos o de fármacos que inhiben la motilidad o las evacuaciones en las fases tempranas del cuadro diarreico incrementa el riesgo de SUH, ya que el intestino se expone a una cantidad mayor de toxinas durante un período más prolongado.
Debido a la gravedad de la infección y sus complicaciones, resulta importante la instrucción al público sobre las técnicas para limitar la transmisión primaria de la infección a partir de las fuentes animales. Las carnes mal cocinadas y la leche no pasteurizada son fuentes de transmisión. Quienes manipulan los alimentos y los consumidores deben estar conscientes de las técnicas apropiadas para el manejo de la carne cruda, a fin de prevenir la contaminación cruzada de otros alimentos. Debe prestarse particular atención a la higiene en las guarderías y los asilos, donde la diseminación de la infección a personas muy jóvenes o a adultos mayores puede implicar complicaciones graves.
Infección por protozoarios
La amibiasis (entamoebosis) alude a la infección por Entamoeba histolytica, que afecta el colon y en ocasiones el hígado. Los humanos son el único reservorio conocido de E. histolytica que se reproduce en el colon y se elimina en las heces. Si bien, la infección por E. histolytica tiene lugar en todo el mundo, es más frecuente y grave en las regiones tropicales y subtropicales, donde prevalecen el hacinamiento y condiciones deficientes de saneamiento. La amibiasis intestinal varía desde la infección del todo asintomática hasta la enfermedad disentérica grave.
Entamoeba histolytica tiene 2 fases distintas: la fase de trofozoíto (forma ameboide) y la de quiste. Los trofozoítos se desarrollan en el colon; se alimentan de las bacterias y de las células del humano. Pueden colonizar cualquier porción del intestino grueso, pero el área que se afecta al máximo suele ser el ciego. Las personas con enfermedad sintomática eliminan tanto quistes como trofozoítos en sus heces, pero estos últimos mueren con rapidez al exponerse al aire fuera del cuerpo.
Sólo los quistes son infectantes, porque pueden sobrevivir a la acidez gástrica que destruye a los trofozoítos. Una vez establecidos, los trofozoítos invaden las criptas de las glándulas colónicas y se entierran hasta la submucosa; el microorganismo se despliega entonces para generar una úlcera con forma de botón en ojal, con un cuello estrecho y una base amplia. Los microorganismos que invaden las venas submucosas del colon ingresan a la vena porta y embolizan al hígado para dar origen a abscesos hepáticos solitarios y, con menos frecuencia, a pequeños abscesos hepáticos múltiples.
Algunas personas desarrollan diarrea de inicio agudo incluso 8 días (por lo regular de 2 a 4 semanas) después de la infección. Otras pueden permanecer asintomáticas o mostrar sólo síntomas intestinales leves durante meses o varios años antes de que aparezcan síntomas intestinales o un absceso hepático. Las manifestaciones incluyen malestar abdominal, hipersensibilidad a la palpación abdominal y fiebre, muchas veces acompañados de náuseas, vómito y flatulencias fétidas. Pudieran presentarse evacuaciones frecuentes líquidas que contienen moco y sangre, pero la diarrea no suele durar tanto como para causar deshidratación. La infección a menudo persiste durante meses o años, y desencadena emaciación y anemia. En los casos graves, la destrucción masiva de la mucosa colónica puede generar hemorragia, perforación o peritonitis. Las personas con abscesos hepáticos amibianos muchas veces presentan dolor intenso en el cuadrante superior derecho, febrícula y pérdida ponderal.
Entre las estrategias diagnósticas se encuentran el análisis microscópico de las heces para la identificación de E. histolytica, las pruebas de anticuerpos séricos y la colonoscopia para toma de muestra o biopsia. El tratamiento incluye la administración de los medicamentos antimicrobianos tinidazol y metronidazol, que actúan contra los trofozoítos y diloxanida (que no está disponible en Estados Unidos), que es efectiva contra los quistes.
Enfermedad diverticular
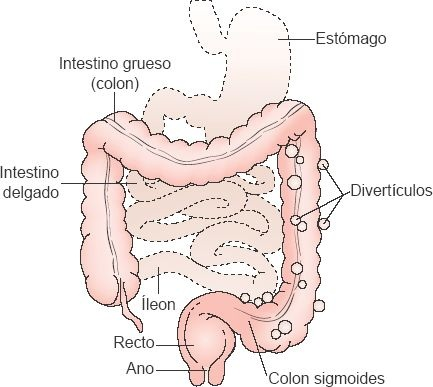
La diverticulosis es una afección que con frecuencia se presenta en la región distal del colon descendente y el colon sigmoides, en la que la capa mucosa del colon se hernia a través de la capa muscular. Por lo regular, existen divertículos múltiples, la mayoría de los cuales se identifica en el colon sigmoides (figura 45-12).
La enfermedad diverticular es frecuente en la sociedad occidental y afecta a cerca del 40% de la población al llegar a los 60 años, y al 60% de la población al llegar a los 80. Si bien, el trastorno tiene gran prevalencia los países desarrollados, es casi inexistente en muchas naciones africanas y en los países en vías de desarrollo. Esto sugiere que factores como la carencia de fibra en la dieta, la disminución de la actividad física y los hábitos intestinales deficientes (ej. hacer caso omiso de la urgencia para defecar), junto con los efectos del envejecimiento, contribuyen al desarrollo del trastorno.
En el colon, el músculo longitudinal no forma una capa continua, como lo hace en el intestino delgado. En vez de esto, existen 3 bandas longitudinales independientes de músculo, denominadas tenias del colon. De manera similar a lo que ocurre en el intestino delgado, las bandas de músculo circular constriñen el intestino grueso. Al tiempo que el músculo circular se contrae en cada uno de estos puntos (casi cada 2,5 cm), el lumen del intestino se estrecha, de tal forma que casi se ocluye. La contracción combinada del músculo circular y la carencia de una capa continua de músculo longitudinal hacen que el intestino protruya hacia afuera en regiones abolsadas denominadas haustras. Los divertículos se desarrollan entre las bandas de músculo longitudinal en las haustras, en la región en que los vasos sanguíneos perforan la capa muscular circular para llevar la sangre a la capa mucosa. Un incremento de la presión intraluminal en las haustras genera la fuerza necesaria para producir estas herniaciones. Se cree que el aumento de la presión se relaciona con el volumen del contenido colónico. A menor contenido, más vigorosas son las contracciones y mayor es la presión en las haustras.
La mayoría de las personas con enfermedad diverticular permanece asintomática. La enfermedad a menudo se identifica cuando se realizan estudios radiológicos con otros propósitos. En los casos en que se desarrollan síntomas, éstos suelen atribuirse al SII o a otras causas. Son comunes el malestar mal definido en hemiabdomen inferior, el cambio de los hábitos intestinales (ej. diarrea y estreñimiento), la distensión y la flatulencia.
La diverticulitis es una complicación de la diverticulosis, en la que existe inflamación y perforación macroscópica o microscópica del divertículo. Uno de los malestares más frecuentes es el dolor en el cuadrante inferior izquierdo, que se acompaña de náuseas y vómito; el dolor a la palpación en el mismo cuadrante, la febrícula y la elevación del conteo leucocitario. Estos síntomas suelen persistir varios días, a menos que se presenten complicaciones, y tienden a derivar de la inflamación localizada de los divertículos, con perforación y desarrollo de abscesos pequeños localizados. Entre las complicaciones, se encuentran la perforación con peritonitis, hemorragia y obstrucción intestinal. Pueden formarse fístulas que afectan la vejiga (ej. fístula vesicosigmoidea), pero en ocasiones afectan la piel, la región perianal, la vagina o el intestino delgado. La neumaturia (es decir, salida de aire junto con la orina) es un signo de fístula vesicosigmoidea.
El diagnóstico de la enfermedad diverticular se basa en la anamnesis y en las manifestaciones clínicas de presentación. El trastorno puede confirmarse mediante TC o estudios ultrasonográficos. La TC es la técnica más segura y costeable. Si bien en el pasado se recurría al enema baritado, ya no se recomienda, debido al riesgo de extravasación del medio de contraste en caso de que exista perforación. Es posible solicitar una placa simple de abdomen para detectar complicaciones relacionadas con la diverticulitis aguda.
El tratamiento usual de la enfermedad diverticular consiste en la prevención de los síntomas y las complicaciones. Esto incluye el incremento del volumen de fibra en la dieta y el reentrenamiento intestinal, de manera que la persona presenta, por lo menos, una evacuación cada día. El incremento de la fibra en la dieta promueve la defecación a intervalos regulares, e incrementa el contenido y el diámetro del colon, con lo que disminuye la presión intraluminal. La diverticulitis aguda se maneja mediante el retiro temporal de los alimentos sólidos y la administración de un antibiótico de amplio espectro. Pudiera requerirse hospitalización en personas que muestran inflamación intensa, no pueden tolerar líquidos por vía oral, se encuentran febriles o cursan con signos y síntomas que sugieren afectación sistémica. Dos fármacos inmunomoduladores, como la mesalamina y los probióticos, son medicamentos que se utilizan cada vez con más frecuencia para el manejo de la enfermedad diverticular. El tratamiento quirúrgico se reserva para las personas que experimentan síntomas persistentes y complicaciones.
Apendicitis
La apendicitis aguda es en extremo común. En Estados Unidos el riesgo de desarrollar apendicitis es del 12% para varones y del 25% para mujeres. El apéndice se inflama, edematiza y gangrena y, por último, se perfora si no recibe tratamiento. La apendicitis se relaciona con la obstrucción intraluminal en el apéndice por un fecalito (es decir, trozo de heces induradas), litos biliares, tumores, parásitos o tejido linfático.
Suele tener inicio abrupto, con dolor referido al epigastrio o la región periumbilical. Este dolor se debe a la distensión del apéndice durante el proceso inflamatorio temprano. Casi al mismo tiempo que el dolor aparece, existen 1 o 2 episodios de náuseas. Al inicio, el dolor es vago, pero en un período de 2 h a 12 h se intensifica de manera gradual y puede volverse de tipo cólico. Cuando el proceso inflamatorio se extiende para afectar la capa serosa del apéndice y el peritoneo, el dolor se localiza en el cuadrante inferior derecho. Puede existir elevación del conteo leucocitario, pero no en todos los casos. La palpación del abdomen suele revelar hipersensibilidad a la palpación profunda en el cuadrante inferior derecho, que se limita a un área pequeña cercana al tamaño de la punta de un dedo. Suele localizarse casi en el mismo sitio que el apéndice inflamado. La persona con apendicitis con frecuencia es capaz de situar su dedo justo por encima del área donde se manifiesta el dolor. Son comunes el dolor de rebote, aquel que se presenta cuando se aplica presión sobre el área y luego se libera, y el espasmo de los músculos abdominales suprayacentes.
El diagnóstico suele tener como base el interrogatorio clínico y los hallazgos de la exploración física. La ecografía o la TC pueden utilizarse para confirmar el diagnóstico en los casos en que se sospechan causas alternativas de dolor abdominal. El tratamiento consiste en la extirpación quirúrgica del apéndice. Entre sus complicaciones se encuentran la peritonitis, la formación de un absceso periapendicular localizado y la septicemia.
Alteraciones de la motilidad intestinal
El desplazamiento del contenido del tubo GI está controlado por neuronas ubicadas en los plexos submucoso y mientérico del intestino. Los axones de los cuerpos celulares en el plexo mientérico inervan las capas de músculo liso circular y longitudinal del intestino. Estas neuronas reciben impulsos de receptores locales de la mucosa y las capas musculares del intestino, así como impulsos extrínsecos provenientes de los sistemas nerviosos parasimpático y simpático. Como regla general, el sistema nervioso parasimpático tiende a incrementar la motilidad del intestino, en tanto que la estimulación simpática tiende a disminuir la velocidad de su actividad.
El colon cuenta con esfínteres en ambos extremos: el esfínter ileocecal, que separa al intestino grueso del delgado y el esfínter anal, que impide el desplazamiento de las heces hacia el exterior del organismo. El colon actúa como reservorio de la materia fecal. Por lo regular, cada día se absorben en el colon alrededor de 400 ml de agua, 55 mEq de sodio, 30 mEq de cloruro y 15 mEq de bicarbonato. Al mismo tiempo, cerca de 5 mEq de potasio se secretan hacia el lumen del colon. La cantidad de agua y electrolitos que permanece en las heces corresponde a la absorción o la secreción que se presentan en el colon. El adulto promedio que ingiere una dieta estadounidense típica evacúa alrededor de 100 g a 200 g de heces cada día.
Diarrea
De manera usual, la diarrea se define como la eliminación con frecuencia excesiva de heces reblandecidas o no formadas. La referencia de diarrea es común y puede relacionarse con distintos factores patológicos y no patológicos. Puede ser aguda o crónica, y derivar de distintos microorganismos infecciosos, intolerancia a los alimentos, fármacos o enfermedad intestinal. Las diarreas agudas que duran menos de 4 días la mayoría de las veces se deben a agentes infecciosos y tienen una evolución autolimitada.
Diarrea aguda
La diarrea con inicio agudo y persiste menos de 2 semanas a menudo se debe a agentes infecciosos (v. el análisis previo sobre la enterocolitis infecciosa). Con base en las características de las heces diarreicas, la diarrea aguda suele dividirse en diarrea no inflamatoria (de gran volumen) e inflamatoria (de bajo volumen). Los microorganismos entéricos generan diarrea por varios mecanismos. Algunos no son invasivos y no causan inflamación, pero secretan toxinas que estimulan la secreción de líquidos. Otros invaden y destruyen las células epiteliales del intestino, con lo que alteran el trasporte de líquidos, de tal forma que la actividad secretoria continúa, en tanto que la actividad de absorción se detiene.
La diarrea no inflamatoria se asocia a heces acuosas y no sanguinolentas de gran volumen, cólico periumbilical, distensión abdominal y náuseas o vómito. Muchas veces se debe a bacterias productoras de toxinas (ej. S. aureus, E. coli enterotoxigénica, Cryptosporidium parvum y Vibrio cholerae) u otros agentes (ej. virus y giardia) que alteran la absorción normal o el proceso secretorio del intestino delgado.
La presencia de vómito prominente sugiere una enteritis viral o una intoxicación alimentaria con S. aureus. Si bien de ordinario leve, la diarrea (que se origina en el intestino delgado) puede tener gran volumen y generar deshidratación con hipopotasemia y acidosis metabólica (ej. cólera).
Dado que no se presenta invasión tisular, no existen leucocitos en las heces.
La diarrea inflamatoria suele caracterizarse por la presencia de fiebre y diarrea sanguinolenta (disentería). Se debe a la invasión de las células intestinales (ej. por Shigella, Salmonella, Yersinia y Campylobacter) o a las toxinas asociadas a la infección antes descrita por C. difficile o E. coli O157:H7. Debido a que las infecciones que se relacionan con estos microorganismos afectan de manera predominante al colon, las evacuaciones son frecuentes y de bajo volumen, y se asocian con dolor cólico en el cuadrante inferior izquierdo, urgencia para la defecación y tenesmo. La disentería infecciosa debe distinguirse de la colitis ulcerosa aguda, que puede presentarse con diarrea sanguinolenta, fiebre y dolor abdominal. La diarrea que persiste durante 14 días no puede atribuirse a patógenos bacterianos (excepto por C. difficile) y la persona debe ser evaluada por un cuadro de diarrea crónica.
Diarrea crónica
La diarrea se considera crónica cuando los síntomas persisten durante 4 semanas o más. La diarrea crónica con frecuencia se relaciona con condiciones como EII, SII, síndrome de malabsorción, trastornos endocrinos (hipertiroidismo y neuropatía diabética autonómica) o colitis por radiación. Existen 4 causas primordiales para diagnosticar diarrea crónica: presencia de contenido luminal hiperosmolar, incremento de los procesos secretorios intestinales, condiciones inflamatorias y procesos infecciosos (recuadro 45-1). La diarrea artificial se debe al consumo indiscriminado de laxantes o a la ingesta excesiva de alimentos con propiedades laxantes.
Recuadro 45-1. Diarrea crónica
- Diarrea hiperosmolar
- Catárticos salinos.
- Insuficiencia de lactasa.
- Diarrea secretora
- Diarrea infecciosa aguda.
- Incapacidad para absorber las sales biliares.
- Malabsorción de grasas.
- Abuso crónico de laxantes.
- Síndrome carcinoide.
- Síndrome de Zollinger-Ellison.
- Impactación fecal.
- Enfermedad intestinal inflamatoria
- Enfermedad de Crohn.
- Colitis ulcerosa.
- Enfermedad infecciosa
- Shigelosis.
- Salmonelosis.
- Colon irritable
En la diarrea osmótica el agua es atraída hacia el interior del intestino por la naturaleza hiperosmolar de su contenido, en una cantidad tal que el colon es incapaz de reabsorber el exceso de líquido. Tiene lugar cuando no se absorben partículas con actividad osmótica. En personas con insuficiencia de lactasa, la lactosa de la leche no puede degradarse y absorberse. Las sales de magnesio, las que contiene la leche de magnesia y muchos antiácidos, se absorben de manera deficiente y generan diarrea cuando se ingieren en cantidades suficientes. Otra causa de diarrea osmótica es la disminución del tiempo de tránsito intestinal, que interfiere con la absorción. La diarrea osmótica suele desaparecer con el ayuno.
La diarrea secretora se presenta cuando se intensifican los procesos secretores del intestino. La diarrea secretora también tiene lugar cuando un exceso de ácidos biliares permanece en el contenido intestinal, al tiempo que éste ingresa al colon. Esta situación se observa con frecuencia en los procesos patológicos del íleon, puesto que las sales biliares se absorben en ese sitio. También puede presentarse con el crecimiento bacteriano excesivo en el intestino delgado, que interfiere con la absorción de la bilis. Algunos tumores, como los que generan el síndrome de Zollinger-Ellison y el síndrome carcinoide, sintetizan hormonas que inducen actividad secretora en el intestino.
La diarrea inflamatoria a menudo se relaciona con una inflamación crónica o aguda, o alguna enfermedad intrínseca del colon, como la colitis ulcerosa o la enfermedad de Crohn. Suele evidenciarse por aumento de la frecuencia y urgencia para la defecación, así como dolor abdominal cólico. Es común que se presente acompañada de tenesmo (es decir, esfuerzo doloroso al defecar), manchado fecal de la ropa y despertares nocturnos por la urgencia para defecar.
Las infecciones parasitarias crónicas pueden inducir diarrea crónica mediante distintos mecanismos. Los patógenos que se relacionan con más frecuencia con diarrea crónica incluyen a los protozoarios Giardia, E. histolytica y Cyclospora. Las personas con inmunocompromiso son en particular susceptibles a la infección por microorganismos que pueden generar diarrea aguda y crónica, entre otros, Cryptosporidium, citomegalovirus (CMV) y el complejo Mycobacterium avium-intracellulare.
Diagnóstico y tratamiento
El diagnóstico de la diarrea se basa en las referencias de evacuaciones frecuentes y el antecedente de factores acompañantes, como enfermedad concurrente, consumo de medicamentos y exposición a patógenos intestinales potenciales. Trastornos como la EII y la enfermedad celíaca deben descartarse. Si el inicio de la diarrea se relaciona con un viaje fuera de Estados Unidos, debe considerarse la posibilidad de que se trate de diarrea del viajero.
Si bien la mayoría de las variantes agudas de diarrea es autolimitada y no requiere tratamiento, la diarrea puede ser en particular grave en lactantes y niños pequeños, personas con otras enfermedades o añosas, e incluso, de ser persistente, en personas antes saludables. Así, la restitución de líquidos y electrolitos se tiene como una meta terapéutica central en el tratamiento de la diarrea.
Los medicamentos que se utilizan para el tratamiento de la diarrea incluyen los opioides difenoxilato y loperamida. Estos medicamentos disminuyen la motilidad GI y estimulan la absorción de agua y electrolitos. Los adsorbentes, como el caolín y la pectina, adsorben irritantes y toxinas a partir del intestino. Estos ingredientes se incluyen en muchas preparaciones antidiarreicas de venta sin receta, debido a que adsorben las toxinas responsables de ciertos tipos de diarrea. El subsalicilato de bismuto puede utilizarse para reducir la frecuencia de las evacuaciones diarreicas e incrementar la consistencia de las heces, en particular en los casos de diarrea del viajero. Se piensa que el fármaco inhibe la secreción intestinal que inducen E. coli enterotoxigénica y las toxinas del cólera. Los medicamentos antidiarreicos no deben administrarse en personas con diarrea sanguinolenta, fiebre elevada o signos de toxicidad, dado el riesgo de agravar la enfermedad. Los antibióticos deben reservarse para individuos con enfermedad por patógenos entéricos identificados.
Enfermedad diarreica aguda en niños
En todo el mundo, cada año se atribuyen 1,5 millones de muertes a la diarrea en niños menores de 5 años de edad. Aunque las enfermedades diarreicas tienen menor prevalencia en Estados Unidos que en otros países, generan una carga sobre el sistema de atención de la salud. La diarrea también es la principal causa de desnutrición en niños y afecta con más frecuencia a los menores de 2 años de edad.
La causa de la diarrea aguda en los niños varía según la ubicación geográfica, la época del año y la población estudiada. Se reconoce cada vez más una serie creciente de patógenos que genera diarrea en niños. Los virus son los patógenos que más a menudo inducen enfermedad diarreica.
Los rotavirus y los norovirus son patógenos que se observan con frecuencia. Otros virus observados en las heces de niños incluyen astrovirus y adenovirus entéricos. Muchos de estos patógenos se transmiten con facilidad por medio de los alimentos y el agua, o de una persona a otra.
La prevención sigue siendo la medida más importante en el manejo de la enfermedad diarreica en niños. Algunas medidas básicas para prevenir la diseminación de los patógenos son las técnicas adecuadas para higiene, procesamiento y preparación de los alimentos, las provisiones sanitarias de agua, la higiene apropiada de las manos; también, evitar que las personas infectadas manipulen alimentos o proporcionen cuidados de salud, y excluir a los individuos con diarrea del contacto con el agua para recreación pública (es decir, albercas, estanques y lagos).
Los objetivos principales del manejo de un niño con diarrea aguda es valorar el grado de deshidratación, prevenir la diseminación de la infección, determinar la naturaleza del agente etiológico y aportar un tratamiento específico, según se requiera. El estado de hidratación de los niños puede valorarse con base en signos y síntomas de observación simple. Las preguntas relativas al consumo oral, la frecuencia y el volumen del gasto de heces, el aspecto general y la actividad del niño, así como la frecuencia miccional aportan información esencial sobre la hidratación. La sed, la presencia de sequedad en las membranas mucosas y la disminución de la turgencia cutánea son síntomas comunes de deshidratación. Deben obtenerse datos sobre la atención en guarderías, el viaje reciente a regiones en que la diarrea es endémica, el consumo de fármacos antimicrobianos y la exposición al agua contaminada, frutas o vegetales no lavados, o carnes mal cocinadas, ya que pudieran revelar la etiología del trastorno. La fiebre sugiere la presencia de un proceso inflamatorio, pero también se manifiesta junto con la deshidratación.
El manejo de la deshidratación sigue siendo la piedra angular del tratamiento de los niños con diarrea. En particular, los lactantes son más susceptibles a la deshidratación debido a su área de superficie mayor, su tasa metabólica más alta y su incapacidad para concentrar la orina de manera efectiva. El tratamiento para rehidratación oral (TRO) suele ser la estrategia de elección para los neonatos y los niños con diarrea no complicada que pueden recibir atención en casa.
Aplicada primero para el tratamiento de la diarrea en los países en desarrollo, la TRO puede considerarse un caso de tecnología inversa, en que los protocolos por lo regular implementados en estos países han modificado los cuidados de la salud también en los países industrializados. Las soluciones completas para TRO contienen carbohidratos, sodio, potasio, cloruro y bases para restituir las pérdidas en las heces diarreicas. No se recomiendan las bebidas de consumo común, como las de cola y los jugos de manzana, que tienen osmolaridad alta por su elevado contenido de carbohidratos y bajo en electrolitos. La efectividad de la TRO depende del transporte acoplado de sodio y glucosa, así como de otras moléculas orgánicas pequeñas que sufren transporte activo (capítulo 44). Se dispone de soluciones de TRO embotelladas, pero son costosas, en especial en los casos en que se requieren grandes volúmenes de líquidos para restitución. El costo puede representar una carga importante para las familias en desventaja socioeconómica. Se dispone de sobres menos costosos, con dosis y recetas predeterminadas para la preparación de soluciones rehidratantes. El consumo de la TRO para el tratamiento de la diarrea en lactantes y niños pequeños suele ser una labor intensiva que hace necesaria la alimentación frecuente, a veces con una cuchara o una sonda para alimentación nasogástrica. Más importante aún es que la diarrea no cesa con rapidez una vez que se inicia la administración de TRO; esto puede resultar frustrante para los padres y los cuidadores, que desean prontos resultados para sus esfuerzos. Los niños con deshidratación intensa y cambios en los signos vitales o en la condición mental requieren reanimación de urgencia con soluciones intravenosas. Después del tratamiento inicial con tales soluciones, estos niños pueden recibir TRO.
La evidencia sugiere que la alimentación debe continuarse durante la enfermedad diarreica, en particular en los niños. Se ha demostrado que las dietas no restringidas no agravan la evolución o los síntomas de la diarrea leve, y pueden disminuir el gasto fecal. Se cree que el almidón y las proteínas simples aportan moléculas para cotransporte con poca actividad osmótica, lo que incrementa la captación de líquidos y electrolitos en las células intestinales. El contenido luminal que se relaciona con la realimentación temprana también es un factor de crecimiento conocido para los enterocitos y ayuda a facilitar su reparación después de la lesión. Se recomienda que los niños que requieran tratamiento para rehidratación por la presencia de diarrea sean alimentados con una dieta apropiada según su edad. Si bien existe poco acuerdo sobre qué alimentos son mejores, es preferible evitar los grasosos y los que son ricos en azúcares simples. Casi todos los lactantes con gastroenteritis aguda pueden tolerar la alimentación con leche materna. Para los lactantes que se alimentan con fórmula, su dilución no ofrece ventaja alguna respecto del consumo de la fórmula con dilución normal.
Estreñimiento
El estreñimiento puede definirse como la evacuación infrecuente, incompleta o difícil de heces. La dificultad en torno a esta definición deriva de las muchas variaciones de la función que resultan normales para las personas. Lo que se estima normal en una persona (ej. 2 o 3 evacuaciones por semana) puede considerarse evidencia de estreñimiento para otra. El estreñimiento puede presentarse como un trastorno primario de la motilidad intestinal, como efecto colateral de los medicamentos, como problema relacionado con otra condición patológica, o como un síntoma de lesiones obstructivas en el tubo GI. Algunas causas frecuentes de estreñimiento son: la incapacidad para responder a la urgencia para defecar, el volumen inadecuado de fibra en la dieta, el consumo inadecuado de líquidos, la debilidad de los músculos abdominales, la inactividad y el reposo en cama, el embarazo y las hemorroides.
La fisiopatología del estreñimiento puede clasificarse en 3 categorías: estreñimiento con tránsito normal, estreñimiento con tránsito lento y trastornos de la evacuación defecatoria o rectal.
El estreñimiento con tránsito normal (o estreñimiento funcional) se caracteriza por una dificultad percibida para defecar y suele responder al incremento en el consumo de líquidos y fibra.
El estreñimiento de tránsito lento, que se caracteriza por evacuaciones poco frecuentes, suele derivar de alteraciones de la función motora del colon. La enfermedad Hirschsprung es una variante extrema de estreñimiento de tránsito lento, en la que no existen células ganglionares en el intestino distal por un defecto adquirido durante el desarrollo embrionario; el intestinos se estrecha en la región que carece de células ganglionares. Si bien la mayoría de las personas con este trastorno lo manifiesta durante la edad neonatal, la lactancia o la niñez temprana, aquellas en quienes el segmento afectado del colon es relativamente corto no presentan síntomas sino hasta una fase posterior de la vida. La mayoría de las veces, los trastornos para la defecación se deben a insuficiencias en la coordinación muscular que afectan al piso pélvico o al esfínter anal.
Las enfermedades asociadas con estreñimiento crónica incluyen trastornos neurológicos como lesión medular, enfermedad de Parkinson y esclerosis múltiple; trastornos endocrinos como hipotiroidismo y lesiones obstructivas en el tubo GI.
Algunos medicamentos, como los narcóticos, los fármacos anticolinérgicos, los bloqueadores de los canales del calcio, los diuréticos, el calcio (antiácidos y complementos), los complementos de hierro y los antiácidos que contienen aluminio tienden a inducir estreñimiento.
Los adultos mayores con estreñimiento de larga evolución y esfuerzo para la defecación pueden desarrollar dilatación del recto, el colon o ambos. Esta condición permite que se acumulen grandes cantidades de heces, sin que se genere alguna sensación o ésta sea leve. En el contexto del cambio de los hábitos intestinales, el estreñimiento puede ser un signo de cáncer colorrectal.
El diagnóstico del estreñimiento suele basarse en el antecedente de evacuaciones infrecuentes, esfuerzo para la defecación, evacuación de heces induradas y escíbalos, o sensación de evacuación incompleta. La exploración rectal se utiliza para determinar si existen impactación fecal, estenosis anal o masas rectales. El estreñimiento como signo de otra condición patológica debe descartarse.
Las pruebas que cuantifican el tiempo de tránsito colónico y la función para la defecación se reservan para los casos resistentes.
El tratamiento del estreñimiento suele dirigirse al alivio de la causa. Debe hacerse un esfuerzo consciente para responder a la necesidad de evacuar. Para tener una evacuación, debe designarse un horario después de alguna comida, cuando es más probable que se presenten los movimientos en masa del colon. La simulación de la posición en cuclillas mientras se permanece sentado en la tasa del baño, al elevar los pies, puede ayudar a promover la evacuación. Debe fomentarse el consumo de un volumen adecuado de líquidos en la dieta. El ejercicio moderado resulta esencial, las personas en cama se benefician con los ejercicios pasivos y activos. Los laxantes y los enemas deben utilizarse de manera juiciosa; no deben utilizarse de manera regular para tratar el estreñimiento simple, puesto que interfieren con el reflejo para la defecación y, de hecho, pueden dañar la mucosa rectal.
Impactación fecal
Es la retención de heces induradas o similares al mastique en el recto y el colon, lo que interfiere con la evacuación normal de éstas. Si no se retiran, pueden inducir una obstrucción intestinal parcial o completa. Puede desarrollarse en cualquier grupo de edad, pero es más frecuente en adultos mayores incapacitados. La impactación fecal puede derivar de una enfermedad anorrectal dolorosa, tumores o enfermedad neurogénica; del consumo de antiácidos que causan estreñimiento o laxantes generadores de volumen; de una dieta baja en residuos; estancamiento colónico inducido por fármacos o del reposo en cama prolongado y la debilidad. En los niños, la impactación puede verse favorecida por un descuido habitual en la necesidad de defecar en la escuela, debido a la limpieza de las instalaciones, vergüenza, o interferencia con el juego.
Las manifestaciones pueden corresponder a las de el estreñimiento grave, pero con frecuencia existe antecedente de diarrea acuosa, manchado e incontinencia fecal. Esto se debe al incremento de la actividad secretora del intestino, que corresponde a un esfuerzo del organismo para romper la masa, de tal manera que pueda evacuarse. El abdomen puede distenderse y pueden encontrarse sangre y moco en las heces. La masa fecal puede comprimir la uretra y dar origen a incontinencia urinaria.
La impactación fecal debe descartarse en adultos mayores o personas inmovilizadas que desarrollan evacuaciones diarreicas con incontinencia fecal o urinaria.
La exploración digital del recto se realiza para valorar la presencia de una masa fecal. A veces es necesario romperla y desalojarla de manera manual, o mediante el empleo de un sigmoidoscopio.
Es frecuente el empleo de enemas oleosos para reblandecer la masa antes de su retiro. La prevención es el mejor tratamiento.
Obstrucción intestinal
La obstrucción intestinal designa una disfunción del movimiento del contenido intestinal en dirección distal. Las causas pueden clasificarse como mecánicas o paralíticas. La estrangulación con necrosis del intestino puede presentarse y generar una perforación, peritonitis y septicemia.
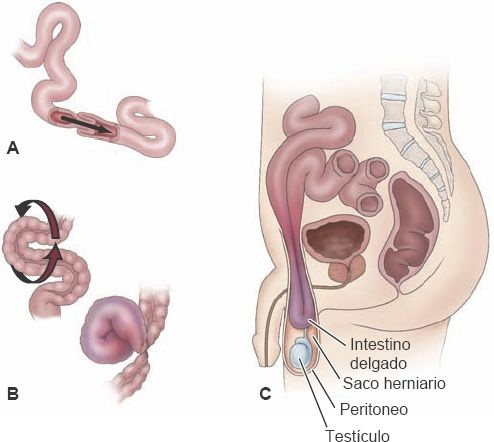
La obstrucción mecánica puede derivar de distintas condiciones, intrínsecas o extrínsecas, que limitan la permeabilidad del lumen intestinal (figura 45-13).
Las etiologías posquirúrgicas, como la hernia externa (ej. inguinal, femoral o umbilical) y las adherencias posoperatorias, son responsables del 75% de los cuadros de obstrucción intestinal. Otras causas menos frecuentes son las estenosis, los tumores, los cuerpos extraños, la intususcepción y el vólvulo.
La intususcepción implica el ingreso de un segmento intestinal en el segmento adyacente (figura 45-14). Es la causa más frecuente de obstrucción intestinal en niños menores de 2 años de edad.
La variante más común es la intususcepción del íleon terminal en el colon derecho, pero pueden encontrarse afectadas otras regiones del intestino. En la mayoría de los casos se desconoce la causa del trastorno. La condición también puede presentarse en adultos, cuando una masa o tumor intraluminal actúa como fuerza de tracción y jala a un segmento, al tiempo que se introduce en el segmento distal. El vólvulo alude a un torcimiento completo del intestino sobre un eje formado por su mesenterio (figura 45-13B). Puede ocurrir en cualquier región del tubo GI, pero casi siempre afecta al colon sigmoides (75%) y enseguida al ciego (22%). La obstrucción mecánica del intestino puede ser una obstrucción simple, en que no existe alteración del flujo sanguíneo, o una obstrucción estrangulada, en que existe compromiso del flujo sanguíneo y necrosis del tejido intestinal.
La obstrucción paralítica, o adinámica, deriva de una disfunción neurógena o muscular de la peristalsis. Por lo regular, el íleo paralítico se observa tras la cirugía abdominal, pero también acompaña a condiciones inflamatorias del abdomen, la isquemia intestinal, las fracturas pélvicas y las lesiones de la espalda. Se presenta en una fase temprana de la peritonitis y puede derivar de la irritación química que generan la bilis, las toxinas bacterianas, los desequilibrios electrolíticos como la hipopotasemia y la insuficiencia vascular.
Los principales efectos de ambos tipos de obstrucción intestinal son la distensión abdominal y la pérdida de líquidos y electrolitos (figura 45-15).
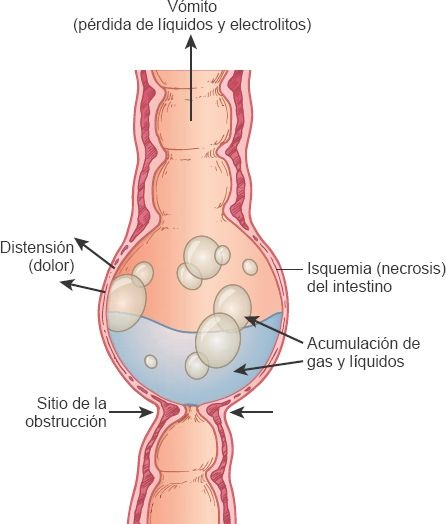
Los gases y los líquidos se acumulan en el área; si no recibe tratamiento, la distensión que deriva de la obstrucción intestinal tiende a perpetuarse y generar atonía entérica y mayor distensión. La distensión se agrava aún más por la acumulación de gases. Al tiempo que el proceso continúa, la distensión se desplaza en sentido proximal (es decir, hacia la boca) y afecta segmentos adicionales del intestino. Con el paso del tiempo, cualquiera de las 2 variantes de obstrucción genera estrangulación (es decir, interrupción del flujo sanguíneo), cambios gangrenosos y, por último, perforación del intestino. El incremento de la presión en el intestino tiende a comprometer el flujo sanguíneo mucoso, lo que ocasiona necrosis y desplazamiento de la sangre hacia los fluidos luminales. Esto favorece un desarrollo rápido de las bacterias en el intestino obstruido, que tienen potencial de desplazarse hacia el sistema linfático y los órganos circundantes. El desplazamiento de las bacterias hacia fuera del tubo digestivo deriva en aumento de la inflamación, lo que puede inducir una mayor isquemia e insuficiencia orgánica.
Las manifestaciones de la obstrucción intestinal dependen del grado de obstrucción y su duración. Con la obstrucción aguda, el inicio suele ser súbito y radical. En condiciones crónicas, el inicio por lo general es más gradual. Los síntomas cardinales de la obstrucción intestinal son dolor, estreñimiento absoluto, distensión abdominal, signos de déficit en el volumen hídrico y vómito. Con la obstrucción mecánica, el dolor es intenso y de tipo cólico, en contraste con el dolor continuo y el abdomen silente del íleo paralítico. También existen borborigmos (es decir, ruidos de retumbo generados por la propulsión de gas en el intestino); peristalsis audible y de tono alto, y rachas peristálticas que tienden a relacionarse con los episodios de dolor abdominal. La peristalsis es visible a lo largo del trayecto del intestino dilatado. El paciente experimenta inquietud extrema y conciencia de los movimientos intestinales, junto con debilidad, sudoración y ansiedad. En caso de que se presente estrangulación del intestino, los síntomas se Modifican. El carácter del dolor cambia del cólico intermitente generado por la peristalsis excesiva del intestino a un dolor intenso y constante. El vómito y los trastornos hidroelectrolíticos se presentan en ambos tipos de obstrucción.
El diagnóstico de la obstrucción intestinal suele basarse en el interrogatorio clínico y la exploración física. La radiografía simple de abdomen puede utilizarse para determinar la presencia de una obstrucción y para diferenciar entre una de tipo parcial y una completa, mediante el análisis de los patrones del gas dentro del intestino. Los estudios de TC y ultrasonido pueden utilizarse también para detectar la presencia de obstrucción mecánica.
El tratamiento depende de la causa y el tipo de obstrucción. Se recomiendan la corrección de los desequilibrios de líquidos y electrolitos hasta alcanzar las concentraciones de base, así como la cuantificación del gasto utilizando una sonda de Foley. La mayoría de los casos de obstrucción adinámica responde a la descompresión del intestino mediante succión nasogástrica. La estrangulación y la obstrucción intestinal completa requieren intervención quirúrgica. Durante el procedimiento, se revisa el intestino para que recupere su coloración y peristalsis normales. En caso de que exista tejido necrótico, se seca y se hace una anastomosis.
Peritonitis
Es una respuesta inflamatoria de la membrana serosa que recubre la cavidad abdominal y los órganos viscerales. Puede deberse a la invasión bacteriana o a una irritación química. La mayoría de las veces, las bacterias entéricas ingresan al peritoneo debido a la presencia de un defecto en la pared de alguno de los órganos abdominales. Entre las causas de la peritonitis se encuentran la úlcera péptica perforada, la ruptura apendicular, la perforación diverticular, la gangrena intestinal, la enfermedad pélvica inflamatoria y la gangrena vesicular. Otras causas ambientales son el traumatismo abdominal, la ingestión de cuerpos extraños y el empleo de catéteres para diálisis peritoneal infectados. La peritonitis generalizada, si bien, ya no es el problema radical que fue en alguna época, sigue siendo una causa importante de muerte tras la cirugía abdominal.
El peritoneo tiene varias características que incrementan su vulnerabilidad a los efectos de la peritonitis o lo protegen de ella. Una debilidad de la cavidad peritoneal es que se trata de un espacio amplio y continuo que facilita la diseminación de los contaminantes. Por la misma razón, tiene un área de superficie grande que permite la absorción rápida de las toxinas bacterianas hacia la sangre.
De manera particular, el peritoneo se encuentra bien adaptado para generar una respuesta inflamatoria, como medio para controlar la infección. Tiende, por ejemplo, a exudar una sustancia fibrinosa espesa y adherente, que se adhiere a otras estructuras, como al mesenterio y el epiplón, y sella la víscera perforada, además de hacer más fácil la localización del proceso. La localización se ve favorecida por la estimulación simpática, que limita la motilidad intestinal. Si bien la peristalsis disminuida o ausente que se presenta tiende a suscitar problemas asociados, inhibe el movimiento de los contaminantes por la cavidad peritoneal.
Una de las manifestaciones más importantes de la peritonitis es la translocación del fluido extracelular hacia la cavidad peritoneal (por medio del exudado o de la formación de líquido seroso a partir del peritoneo inflamado) y hacia el intestino, como consecuencia de la obstrucción intestinal.
Las náuseas y el vómito incrementan en mayor medida las pérdidas hídricas. La pérdida de líquido puede favorecer el desarrollo de la hipovolemia y el shock. El inicio de la peritonitis puede ser agudo, como en el caso de la ruptura apendicular, o mostrar un inicio más gradual, como en el caso de la enfermedad pélvica inflamatoria. El dolor y la hipersensibilidad a la palpación son síntomas comunes. Por lo regular, el dolor es más intenso sobre el área inflamada. En general, la persona con peritonitis se mantiene recostada y quieta, debido a que cualquier movimiento intensifica el dolor. La respiración suele ser superficial para impedir el movimiento de los músculos abdominales. El abdomen puede encontrarse indurado, y a veces se describe como «en tabla», debido a la presencia de defensa muscular refleja. El vómito es frecuente, así como la fiebre, la elevación del conteo leucocitario, la taquicardia y la hipotensión. Puede desarrollarse hipo por irritación del nervio frénico. El íleo paralítico se presenta poco después de la instauración de la peritonitis diseminada y se acompaña de distensión abdominal. La peritonitis que evoluciona y no recibe tratamiento conduce al desarrollo de toxemia y shock.
Tratamiento
Las medidas terapéuticas para la peritonitis se dirigen a prevenir la diseminación de la respuesta inflamatoria, a la corrección por vía intravenosa de los desequilibrios de líquidos y electrolíticos que se presentan, y a minimizar los efectos del íleo paralítico y la distensión abdominal.
La reanimación por vía oral se evita debido a una considerable probabilidad de que se requiera una intervención quirúrgica. Ésta puede ser necesaria para resolver la fuente de la inflamación; por ejemplo, para extirpar un apéndice con inflamación aguda o cerrar el defecto causado por una úlcera péptica perforada.
La succión nasogástrica, que implica la inserción de una sonda a través de la nariz y hasta el estómago o el intestino, se utiliza para descomprimirlo y aliviar la distensión abdominal. La restitución de líquidos y electrolíticos es esencial. Estos líquidos se prescriben con base en determinaciones frecuentes de la química sanguínea. Se administran antibióticos para combatir la infección. A menudo se requieren narcóticos para controlar el dolor.
Alteraciones de la absorción intestinal
La malabsorción es la incapacidad para transportar los constituyentes de la dieta, como las grasas, carbohidratos, proteínas, vitaminas y minerales, desde el lumen del intestino hasta el compartimento de líquido extracelular, para ser transportados a distintas partes del cuerpo. Puede afectar de manera selectiva un solo componente, como la vitamina B12 o la lactosa, o su efecto puede de afectar a todas las sustancias que se absorben en un segmento específico del intestino. Cuando afecta un segmento del intestino, puede compensar otro. Por ejemplo, el íleon puede compensar la malabsorción que tiene lugar en el segmento proximal del intestino delgado, al absorber cantidades sustanciales de grasas, carbohidratos y aminoácidos. De manera similar, el colon, que por lo regular absorbe agua, sodio, cloruro y bicarbonato, puede compensar la malabsorción del intestino delgado, al absorber productos terminales adicionales del metabolismo bacteriano de carbohidratos.
Las condiciones que afectan uno o más de los pasos implicados en la digestión y absorción de los nutrimentos pueden dividirse en 3 categorías amplias: digestión intraluminal inapropiada, trastornos del transporte transepitelial y obstrucción linfática. La digestión intraluminal inapropiada implica un defecto en el procesamiento de los nutrimentos en el lumen del intestino. Las causas más frecuentes son la insuficiencia pancreática, la enfermedad hepatobiliar y el crecimiento bacteriano intraluminal. Los trastornos del transporte transepitelial se deben a lesiones mucosas que alteran la captación y el trasporte de los nutrimentos intraluminales disponibles a través de la superficie mucosa del intestino. Incluyen afecciones como la enfermedad celíaca y la enfermedad de Crohn. La obstrucción linfática interfiere con el trasporte de los productos de la digestión de los lípidos hacia la circulación sistémica una vez que se absorben en la mucosa intestinal. El proceso puede interrumpirse por defectos congénitos, neoplasias, traumatismos y enfermedades infecciosas específicas.
Síndrome de malabsorción
Las personas con malabsorción intestinal suelen tener síntomas que pueden referirse de manera directa al tubo GI, e incluyen diarrea, flatulencia, distensión, dolor abdominal cólico y ascitis. Debilidad, desgaste muscular, pérdida ponderal y distensión abdominal se observan con frecuencia. La pérdida ponderal muchas veces tiene lugar no obstante un consumo calórico normal o excesivo.
Las heces esteatorreicas contienen un exceso de grasa. El contenido graso genera la formación de heces voluminosas, de color amarillo-grisáceo, malolientes. En una persona que consume una dieta que contiene entre 80 g y 100 g de grasa cada día, la excreción de entre 7 g y 9 g de grasa indica esteatorrea.
Junto con la pérdida de grasa en las heces, existe incapacidad para absorber las vitaminas liposolubles. Esto puede generar tendencia a la formación de equímosis y hemorragia (es decir, insuficiencia de vitamina K), dolor óseo y predisposición al desarrollo de fracturas y tetania (es decir, insuficiencia de vitamina D y calcio), anemia macrocítica y glositis (es decir, insuficiencia de ácido fólico). Pueden desarrollarse neuropatía, atrofia cutánea y edema periférico. La tabla 45-2 describe los signos y los síntomas de las anomalías en la absorción de los constituyentes de la dieta.
Enfermedad celíaca
La enfermedad celíaca, también conocida como esprúe celíaco y enteropatía sensible al gluten, es un trastorno de mediación inmunitaria desencadenada por la ingestión de granos que contienen gluten(entre otros trigo, cebada y centeno). Hasta fecha reciente, la enfermedad celíaca se consideraba un síndrome por malabsorción raro que se manifestaba durante la niñez temprana, pero en la actualidad se sabe que es uno de los trastornos genéticos más frecuentes, con una prevalencia promedio del 1% al 6% en la población general.
La enfermedad deriva de una respuesta inmunitaria inapropiada mediada por células T contra la gliadina-α (un componente de la proteína del gluten) en personas con predisposición genética. Casi todos los individuos con el trastorno comparten el alelo HLA-DQ2 o HLA-DQ8 del complejo mayor de histocompatibilidad de clase II. Las personas con el trastorno presentan aumento en las concentraciones de anticuerpos contra distintos antígenos, como transglutaminasa, endomisio y gliadina. La respuesta inmunitaria que resulta genera una reacción inflamatoria intensa que conlleva la pérdida de las vellosidades para absorción en el intestino delgado (figura 45-16).
Cuando las lesiones formadas son extensas pueden alterar la absorción de los macronutrimentos (es decir, proteínas, carbohidratos y lípidos) y micronutrimentos (es decir, vitaminas y minerales). La afectación del intestino delgado es más prominente en la región proximal, donde es mayor la exposición al gluten.
Existen distintas poblaciones con un mayor riesgo de padecer enfermedad celíaca. Incluyen a personas con diabetes mellitus tipo 1, otras endocrinopatías autoinmunitarias, dermatitis herpetiforme, familiares en primero y segundo grados con enfermedad celíaca y pacientes con síndrome de Turner. Distintas afecciones malignas también parecen ser resultado directo de la enfermedad celíaca, en tanto que se ha identificado un aumento en su incidencia en personas con enfermedad celíaca, que recupera la cifra propia de la población general después de varios años de recibir una dieta libre de gluten. Estas afecciones malignas incluyen el carcinoma de células escamosas de cabeza y cuello, el adenocarcinoma del intestino delgado y el linfoma no hodgkiniano.
La variante clásica de la enfermedad celíaca se presenta durante la lactancia y se manifiesta por detención del crecimiento y el desarrollo; diarrea, desgaste muscular, distensión abdominal y, en ocasiones, desnutrición grave. Después de la lactancia, las manifestaciones tienden a ser menos dramáticas. Los niños mayores pueden presentar anemia, complexión pequeña, defectos en el esmalte dental y estreñimiento. En los adultos, se pueden manifestar síntomas GI como diarrea, constipación y otros datos de malabsorción, como distensión, flatulencia o aerofagia.
El diagnóstico de la enfermedad celíaca se basa en sus manifestaciones clínicas, se respalda en las pruebas serológicas y se confirma mediante biopsia intestinal. Con base en su sensibilidad tan alta, las pruebas disponibles más apropiadas son las de inmunoglobulina (Ig) A contra transglutaminasa tisular humana (TGT) y la de inmunofluorescencia de anticuerpos tipo IgA contra el endomisio (EMA, por sus siglas en inglés). Las biopsias de la región proximal del intestino delgado se indican en personas con resultados positivos de anticuerpos para la enfermedad celíaca.
Por lo general, se solicitan pruebas de laboratorio adicionales para determinar si el trastorno generó afectación nutricional, como anemia por insuficiencia de hierro.
El tratamiento primario de la enfermedad celíaca consiste en el retiro del gluten y las proteínas relacionadas en la dieta. El gluten es la proteína principal del trigo, la cebada y el centeno. Los productos de avena, que no son tóxicos, pueden contaminarse con trigo durante su procesamiento. Se dispone de muchos tipos de pan, cereales, galletas y otros productos libres de gluten. Carnes, vegetales, frutas y productos lácteos carecen de gluten en tanto no se contaminen durante su procesamiento. La exclusión completa del gluten de la dieta por lo regular permite una recuperación rápida y completa de la mucosa intestinal.
Neoplasias
Los tumores de células epiteliales de los intestinos son una causa importante de morbilidad y mortalidad en todo el mundo. El colon es el lugar donde más se ubican neoplasias primarias, en comparación con cualquier otro órgano del cuerpo. Si bien el intestino delgado tiene cerca del 75% de la longitud del tubo GI, es un sitio poco común para los tumores benignos o malignos.
Pólipos adenomatosos
Por mucho, los tipos más frecuentes de neoplasia en el intestino son los pólipos adenomatosos. Un pólipo GI puede describirse como una masa que protruye hacia el lumen del intestino. Los pólipos puede subdividirse con base en la forma de su unión con la pared del intestino (sésiles [nódulos mucosos elevados] o pedunculados [unidos por medio de un tallo]), su aspecto histopatológico (hiperplásicos o adenomatosos) y su potencial neoplásico (benignos o malignos).
Los pólipos adenomatosos (adenomas) son neoplasias benignas que derivan del epitelio mucoso del intestino. Están compuestos por células neoplásicas que proliferaron en exceso, en comparación con las que se requieren para restituir las células que de manera normal se eliminan a partir de la superficie mucosa (figura 45-17).
La patogénesis de la formación del adenoma implica una alteración neoplásica de la multiplicación de las células del epitelio de las criptas. Puede observarse disminución de la apoptosis, persistencia de la multiplicación celular e incapacidad para la maduración y la diferenciación de las células que migran hacia la superficie de las criptas. En condiciones normales, la síntesis de ADN cesa al tiempo que las células alcanzan los 2 tercios superiores de las criptas, después de lo cual maduran, migran hacia la superficie y se vuelven senescentes. Luego desarrollan apoptosis y se exfolian a partir de la superficie. Los adenomas derivan de una anomalía de esta secuencia, de tal manera que las células epiteliales retienen su capacidad de proliferación en toda la extensión de la cripta. Las alteraciones en la diferenciación celular pueden conducir a la displasia y evolucionar hasta el desarrollo de un carcinoma invasivo.
Más de la mitad de todos los pólipos adenomatosos se ubica en el recto sigmoides y puede detectarse mediante tacto rectal o sigmoidoscopia. El resto presenta una distribución uniforme en las otras partes del colon. Los adenomas pueden variar en tamaño, desde un nódulo apenas visible, hasta una masa sésil grande. Pueden clasificarse como adenomas tubulares, vellosos o tubulovellosos.
Los adenomas tubulares, que constituyen alrededor del 65% de los adenomas benignos del intestino grueso, se caracterizan por ser esferas de superficie lisa, por lo general, con menos de 2 cm de diámetro, que se encuentran adheridos a la superficie mucosa mediante un tallo. Si bien, la mayoría de los adenomas tubulares muestra displasia epitelial escasa, alrededor del 20% tiene cambios displásicos variados, desde los cambios nucleares leves hasta el carcinoma invasivo franco.
Los adenomas vellosos constituyen un 10% de los adenomas del colon. Se encuentran en forma predominante en el recto sigmoides. De manera característica, son lesiones elevadas con base ancha, con una superficie irregular similar a la de una coliflor. En contraste con los adenomas tubulares, tienen más probabilidad de contener células malignas. Cuando se desarrolla un carcinoma invasivo, carecen de un tallo para aislar al tumor, y la invasión tiene lugar de manera directa hacia la pared del colon.
Los adenomas tubulovellosos muestran una arquitectura tanto tubular como vellosa. Son una variante intermedia de los adenomas tubulares y los vellosos en términos del riesgo de desarrollar carcinoma invasivo.
La mayoría de los casos de cáncer colorrectal inicia como un pólipo colónico adenomatoso benigno. La frecuencia de poliposis se incrementa a la par de la edad y la prevalencia de pólipos adenomatosos aumenta en grado significativo después de los 60 años de edad. Los varones y las mujeres se afectan por igual. La incidencia máxima de poliposis adenomatosa precede algunos años a la edad pico correspondiente al cáncer colorrectal. Los programas que dan seguimiento detallado para las personas con pólipos adenomatosos y el retiro de las lesiones sospechosas han reducido en grado sustancial la incidencia del cáncer colorrectal.
Cáncer colorrectal
Es el tercer cáncer en frecuencia en varones y mujeres, y la tercera causa de muerte por cáncer en Estados Unidos, donde la incidencia anual de cáncer de colon y recto se aproxima a 141.210 casos, con 49.380 muertes. La tasa de muerte por cáncer colorrectal ha mostrado descenso constante desde los primeros años de la década de los 80. Esto pudiera deberse a una disminución del número de casos, un diagnóstico más temprano y a mejores tratamientos.
La causa del cáncer del colon y recto se desconoce en gran medida. Su incidencia se incrementa con la edad, según lo evidencia el hecho de que cerca del 90% de las personas que desarrollan esta variante de cáncer es mayor de 50 años de edad. Es más frecuente en individuos con antecedente familiar de cáncer, personas con enfermedad de Crohn y colitis ulcerosa, y aquéllas con poliposis adenomatosa familiar del colon. Las personas con riesgo familiar—aquéllas con 2 o más familiares en primer o segundo grado (o ambos) con cáncer colorrectal—constituyen alrededor del 20% de toda la población con cáncer colorrectal.
La poliposis adenomatosa familiar se hereda como un rasgo autosómico dominante vinculado con una mutación en el brazo largo del cromosoma 5. Quienes presentan este trastorno desarrollan pólipos adenomatosos múltiples en el colon a edad temprana. El carcinoma del colon es inevitable, con frecuencia antes de los 40 años de edad, a menos que se realice una colectomía total.
También se sospecha que la dieta desempeña algún papel. Se ha concentrado la atención en el consumo dietético de grasas, azúcar refinada, fibra y la ingestión adecuada de micronutrimentos protectores, como las vitaminas A, C y E en la dieta. Existe la hipótesis de que una concentración elevada de grasas en la dieta aumenta la síntesis de ácidos biliares en el hígado; éstos, pueden convertirse en carcinógenos potenciales por la acción de la flora bacteriana en el colon. En particular, se sospecha que los microorganismos bacterianos convierten los ácidos biliares en carcinógenos. Su proliferación se favorece con un consumo elevado de azúcares refinados. Se piensa que en la dieta la fibra aumenta el volumen de las heces, con lo que diluye y retira los carcinógenos potenciales. Las dietas refinadas muchas veces contienen cantidades menores de vitaminas A, C y E, que pueden capturar los radicales libres de oxígeno.
Existen informes que indican que el ácido acetilsalicílico pudiera proteger contra el cáncer colorrectal. Si bien el mecanismo de acción del ácido acetilsalicílico se desconoce, pudiera guardar relación con su efecto sobre la síntesis de prostaglandinas, una o más de las cuales pudieran estar involucradas en los sistemas internos que influyen en la proliferación celular o el crecimiento tumoral. El ácido acetilsalicílico inhibe la ciclooxigenasa, la enzima que cataliza la conversión del ácido araquidónico de las membranas celulares en prostaglandinas. Una variante de la ciclooxigenasa, la COX-2, promueve la inflamación y la proliferación celular; los cánceres colorrectales a menudo expresan en exceso esta enzima. La administración a intervalos regulares de ácido acetilsalicílico parece reducir el riesgo de cánceres colorrectales que muestran expresión excesiva de COX-2, pero no el riesgo de aquellos con expresión débil o ausente de la COX-2.
También se proponen como fármacos quimioprotectores potenciales los complementos de folato y calcio, ciertas vitaminas y el tratamiento para restitución hormonal (estrógenos) tras la menopausia. Todos estos medicamentos requieren un estudio más amplio antes que puedan recomendarse para la quimioprevención a largo plazo del cáncer colorrectal.
Por lo general, el cáncer del colon y recto se encuentra presente durante un período prolongado antes de generar síntomas. La hemorragia es un síntoma temprano muy significativo y suele ser el que lleva a la persona a buscar atención médica. Otros síntomas son la modificación de los hábitos intestinales, la diarrea o estreñimiento, y a veces una sensación de urgencia o vaciamiento incompleto del intestino. El dolor suele ser una manifestación tardía.
El pronóstico para las personas con cáncer colorrectal depende en gran medida de la extensión de la afectación del intestino y de la presencia de metástasis en el momento del diagnóstico. El cáncer colorrectal se clasifica a menudo en varias fases, TGM (tumor, ganglios y metástasis). En este sistema, el tumor en estadio I se encuentra limitado a las capas mucosa y submucosa del colon y se relaciona con una tasa de sobrevivencia a 5 años del 90% al 100%. Un tumor en estadio II (sin ganglios linfáticos) infiltra la muscular propia pero no la atraviesa, y tiene una tasa de sobrevivencia a 5 años del 80%. En el tumor en estadio III (con ganglios linfáticos positivos), en que existe invasión de la capa serosa y afectación de los ganglios linfáticos regionales, la tasa de sobrevivencia a 5 años es del 30% al 50%. Los tumores en estadio IV (metastásicos) penetran la serosa o los órganos adyacentes, y tienen un pronóstico mucho menos esperanzador.
Detección, diagnóstico y tratamiento
El indicador pronóstico aislado más importante del cáncer colorrectal es la extensión (estadio) del tumor en el momento del diagnóstico. Por ende, el reto es descubrir los tumores en sus fases más tempranas. Entre las técnicas utilizadas para la detección de los cánceres colorrectales se encuentran el tacto rectal y la prueba de sangre oculta en heces, que por lo general se realizan durante las exploraciones físicas de rutina; las radiografías con bario (ej. enema baritado), y la sigmoidoscopia y la colonoscopia flexibles. El tacto rectal es más útil para detectar las neoplasias en el recto. La exploración rectal debe considerarse parte rutinaria de una exploración física adecuada. La American Cancer Society recomienda que todos los varones y mujeres asintomáticos mayores de 40 años se practiquen un tacto rectal cada año como parte de su exploración física. A partir de los 50 años de edad, tanto varones como mujeres deben seguir una de estas 4 opciones para detección:
- prueba de sangre oculta en heces cada año;
- exploración con sigmoidoscopia flexible cada 5 años;
- enema baritado con doble contraste cada 5 años;
- colonoscopia cada 10 años.
Quienes presenten mayor riesgo de cáncer colorrectal deben practicarse exámenes de detección a edad más temprana y con mayor frecuencia. La colonoscopia se recomienda siempre que una prueba de detección es positiva.
Casi todos los cánceres del colon y el recto sangran de manera intermitente; no obstante, la cantidad de sangre es pequeña y suele no ser visible sobre las heces. Así, es factible realizar detecciones para cáncer colorrectal mediante el empleo de pruebas preparadas de tipo comercial para la detección de sangre oculta en las heces. Deben prepararse 2 frotis obtenidos de 3 evacuaciones consecutivas. Para reducir la posibilidad de resultados falsos negativos, se recomienda a las personas evitar el consumo de AINE, como el ibuprofén y ácido acetilsalicílico, durante 7 días antes de la prueba; evitar el consumo de vitamina C en dosis superior a los 150 mg, ya sea mediante complementos o jugos cítricos durante 3 días previos a la prueba, y evitar el consumo de carnes rojas durante 3 días antes de la detección. Las pruebas que se utilizan más a menudo son las de guaiaco para sangre oculta en heces, que son simples y pueden procesarse en el consultorio del proveedor de atención de la salud. También existen pruebas inmunoquímicas que pueden procesarse en un laboratorio o en un consultorio, pero a éstas se recurre con menos frecuencia. Las personas con una prueba positiva de sangre oculta en heces deben ser referidas con su médico para estudios adicionales. Por lo general, se llevan a cabo una exploración física, un tacto rectal y una sigmoidoscopia o colonoscopia flexibles.
La sigmoidoscopia flexible implica la exploración del recto y el colon sigmoides con un tubo hueco iluminado que se inserta a través del recto. El procedimiento se realiza sin sedación y es bien tolerado. Alrededor del 40% de los cánceres y los pólipos se encuentra fuera del alcance del sigmoidoscopio, lo que subraya la necesidad de realizar pruebas de sangre oculta en heces. Durante el procedimiento, los pólipos pueden retirarse, o puede obtenerse tejido para biopsia.
La colonoscopia aporta un medio para visualizar en forma directa el recto y el colon. El colonoscopio está conformado por un haz de fibra de vidrio flexible, con diámetro de 4 cm, que contiene alrededor de 250.000 fibras ópticas y una lente en cada extremo para enfocar y magnificar la imagen. La luz de una fuente externa se transmite por medio del haz de visualización de fibra óptica. Se dispone de instrumentos para permitir la exploración directa del colon sigmoides o de todo el colon. Esta técnica se utiliza para la detección en personas con riesgo elevado de desarrollar cáncer del colon (ej. personas con colitis ulcerosa) y en aquéllas sintomáticas.
La colonoscopia también es útil para obtener una biopsia y extirpar los pólipos. Si bien esta técnica es una de las más precisas para la detección de los cánceres colorrectales tempranos, no resulta apropiada para la detección masiva debido a que es costosa, implica tiempo, y debe realizarse por una persona con entrenamiento intensivo en el empleo del instrumento.
El único tratamiento reconocido para el cáncer del colon y el recto es la extirpación quirúrgica de éstos. Puede utilizarse radioterapia preoperatoria, que en algunos casos ha demostrado incrementar las tasas de sobrevivencia a 5 años, o quimioterapia adyuvante postoperatoria. La radioterapia y la quimioterapia se utilizan como tratamientos paliativos.