Revisiones sistemáticas
Introducción a las revisiones sistemáticas
La revisión sistemática es una forma de investigación que tiene como objetivo agrupar y resumir, de acuerdo a unos criterios explícitos y reproducibles, el máximo número de estudios disponibles que tratan de responder una misma cuestión. Cuando la revisión utiliza técnicas estadísticas de síntesis cuantitativa, se habla de meta-análisis. Siguiendo una metodología científica que busca minimizar los sesgos, la revisión sistemática trata de llevar a cabo una búsqueda exhaustiva de todos (o del mayor número posible) los estudios relacionados con un tema concreto de interés, realiza una valoración crítica de los mismos y una síntesis e interpretación, si es posible de manera conjunta o combinada (meta-análisis), de los resultados de los distintos estudios. El objetivo último de las revisiones sistemáticas es apoyar la toma de decisiones sobre el cuidado de los pacientes con el propósito de contribuir a la mejora de la atención sanitaria.
Este tipo de trabajos se consideran herramientas de valor añadido para el personal asistencial, investigadores, gestores y consumidores, ya que ofrecen una síntesis rigurosa y amplia de la evidencia científica acumulada, lo que les permite hacer frente al problema que supone la sobreabundancia de información. Las revisiones sistemáticas no reemplazan a ningún diseño de investigación y, tal como sucede con éstos, su pertinencia se relaciona con la naturaleza de la pregunta planteada y con el conocimiento previo disponible.
Las revisiones de la literatura (o artículo de revisión) han venido siendo tradicionalmente revisiones narrativas, desarrolladas utilizando una metodología poco sistemática, basadas fundamentalmente en la opinión del autor. Así, el autor generalmente selecciona los estudios a incluir en la revisión mediante unos criterios sumamente arbitrarios (a menudo los que ya conoce y/o avalan su misma opinión), conduciendo a un análisis parcial, cuando no abiertamente sesgado, de la información publicada. Por tanto, se puede decir que, en la actualidad, las revisiones convencionales de la literatura no suelen constituir un mecanismo suficientemente aceptable, desde el punto de vista de la evidencia científica, para transmitir adecuadamente los conocimientos médicos. Pueden resultar un vehículo interesante para comunicar opiniones, pero distan mucho de ser la vía de transmisión objetiva e independiente necesaria para la práctica clínica.
Por qué llevar a cabo una revisión sistemática
Las razones para llevar a cabo una revisión sistemática son varias: las revistas biomédicas ofrecen los datos más detallados y actuales acerca de la investigación, pero esta información es extremadamente voluminosa y no está bien organizada para su aplicación directa en el cuidado de los pacientes. Por ello, una de las principales razones para leer o realizar una revisión sistemática es poder obtener una visión global a partir de la enorme cantidad de información disponible, a veces incluso contradictoria, que generalmente existe sobre un determinado tema o pregunta clínica.
A pesar de tener acceso a múltiples fuentes de información y a una producción de artículos científicos abrumadora, sólo el 1% de los artículos resultan sólidos desde un punto de vista científico. Incluso los trabajos publicados en las revistas de mayor prestigio pueden estar afectados por una gran variedad de deficiencias metodológicas. Otro problema importante es el que se conoce como sesgo de publicación: se publican con mayor frecuencia aquellos estudios que llegan a conclusiones positivas, mientras que los estudios que no demuestran diferencias significativas o aportan resultados negativos encuentran mayores dificultades para ser admitidos. Es muy importante tener consciencia de este fenómeno, tanto desde el punto de vista del investigador como del lector, ya que sin lugar a dudas influirá de algún modo en la toma de decisiones.
Son muchas las intervenciones y temas clínicos que serían susceptibles de una revisión sistemática, ya sea debido a la dispersión de la información disponible y la necesidad de resumirla o bien a la escasa evidencia conocida sobre las mismas.
Para todo aquel que esté interesado en llevar a cabo una revisión sistemática, el Manual para Revisores de la Colaboración Cochrane y el manual elaborado por el NHS Centre for Review and Dissemination Report son, sin duda, dos herramientas que le serán de gran utilidad.
Ventajas de las revisiones sistemáticas
- Explicitar los métodos para la búsqueda y los criterios para la selección limita los sesgos de selección que pueden introducirse en la identificación y selección de determinados estudios para la revisión, lo que conlleva conclusiones más fiables y precisas.
- Los profesionales de la salud, investigadores y gestores sanitarios pueden asimilar rápidamente grandes cantidades de información.
- Pueden ayudar a reducir el retraso entre la publicación de los resultados y la implementación en la práctica clínica.
- Los resultados de los diferentes estudios individuales pueden compararse formalmente entre sí para establecer la validez externa de los hallazgos (grado en que éstos pueden ser extrapolados) y la homogeneidad (consistencia en los resultados) de la investigación realizada hasta el momento.
- Es posible identificar los motivos de las aparentes diferencias (heterogeneidad) observadas entre los estudios.
- La técnica estadística del meta-análisis aumenta la precisión del resultado global o combinado al aumentar la potencia del análisis.
A pesar de que las revisiones sistemáticas cuantitativas (elaboradas a partir de investigación cuantitativa, fundamentalmente ensayos clínicos) son las más desarrolladas hasta la fecha, existe cada vez mayor interés en poder llevar a cabo también revisiones sistemáticas a partir de estudios cualitativos. El proceso para integrar la investigación de este tipo se ha venido a denominar meta-etnografía. Los métodos utilizados para este tipo de revisiones obviamente diferirán completamente de los utilizados en las revisiones sistemáticas a partir de estudios cuantitativos. La metodología para este tipo de revisiones está mucho menos desarrollada, existiendo menor grado de consenso sobre la misma. No obstante, diversos grupos, entre ellos la Colaboración Cochrane, están trabajando en esta dirección a fin de generar metodología validada.
Dónde encontrar revisiones sistemáticas
Las fuentes de información donde pueden encontrarse revisiones sistemáticas son afortunadamente cada vez más numerosas.
Una de las principales fuentes de revisiones sistemáticas de la evidencia científica es la revista electrónica The Cochrane Library. Se trata de una revista en formato electrónico y accesible a través de Internet (actualmente con acceso libre en España en su versión en español [Cochrane Library Plus]), que se actualiza de forma trimestral. Esta revista electrónica pública contiene las revisiones sistemáticas elaboradas a través de los Grupos Cochrane de Revisión, englobados dentro de la Colaboración Cochrane Internacional. Adicionalmente, la Cochrane Library contiene otras bases de datos con resúmenes de revisiones como la DARE, la [Health Technology Assessment Database]( https://database.inahta.org/) y la NHS Economic evaluation database.
Existen otras entidades, como organismos oficiales centros o grupos cooperativos que también realizan y publican revisiones sistemáticas de la evidencia científica, algunos de ellos específicos del área de interés de la enfermería. Uno de ellos es el Joanna Briggs Institute ( www.joannabriggs.edu.au).
Otra fuente de información de interés son las numerosas bases de guías de práctica clínica actualmente existentes. Una de las más relevantes es, sin duda, la National Guideline Clearinghouse.
Aunque hasta hace poco, las revisiones sistemáticas se han venido publicando casi de forma exclusiva en revistas específicas de revisiones, actualmente numerosas revistas biomédicas han mostrado un interés creciente por este tipo de investigación. Así, múltiples revistas médicas de gran difusión y factor de impacto se están sumando a esta iniciativa de manera formal.
Finalmente, cabe mencionar aquí otros recursos disponibles que pueden facilitar la identificación de revisiones. Se trata de motores de búsqueda en Internet específicamente diseñados para este propósito. Uno de los más populares es TRIP Database, actualmente de pago.
Lectura crítica de una revisión sistemática
Al igual que con cualquier artículo que nos llegue a las manos, con las revisiones sistemáticas también debemos hacer una lectura crítica de sus resultados. Hay revisiones sistemáticas buenas y malas; por el simple hecho de ser exhibidas como tales (incluso cuando realizan un meta-análisis) no debemos confiar ciegamente en sus conclusiones hasta no haber realizado una lectura crítica detenida y sistematizada.
Pero, ¿en qué elementos deberemos fijarnos detalladamente al leer una revisión? Los apartados que se describen a continuación nos ofrecen una guía rápida y sencilla de los aspectos necesarios para evaluar la validez y la calidad de una revisión. Esta valoración crítica que presentamos no otorga una puntuación a cada apartado específico, sino que nos ayuda a valorar la revisión en su conjunto.
Hay tres aspectos generales a tener en cuenta al leer de forma crítica una revisión:
- ¿Son válidos los resultados?
- ¿Cuáles han sido los resultados?
- ¿Me resultarán útiles los resultados en el cuidado de mis pacientes?
¿Son válidos los resultados?
Para establecer la validez de los resultados expuestos en la revisión deberemos prestar atención a una serie de aspectos metodológicos.
El primer aspecto a tener en cuenta es el de la definición de los objetivos de la revisión: el tema de la revisión y los objetivos deben estar claramente definidos; esto significa que deben ser concretos, bien delimitados y con una exposición acotada del tema. Si los autores de la revisión no han clarificado suficientemente este punto (fundamentalmente, ¿de qué pacientes se trata? ¿qué intervenciones se comparan? ¿qué medidas de resultado se analizan?), es difícil que posteriormente hayan podido interpretar de forma adecuada y consistente los resultados que han encontrado. Cuando este apartado resulta confuso, quizás no merece la pena seguir leyendo el resto de la revisión.
Si la definición y objetivos de la revisión se exponen claramente, seguiremos adelante con la lectura y nos centraremos en considerar si los criterios utilizados para seleccionar los artículos incluidos en la revisión fueron adecuados. Para ello, examinaremos qué tipo de estudios, según su diseño, se incluyeron en la revisión: ensayos clínicos, estudios observacionales, series de casos, etc. Verificaremos que el tipo de diseño sea el adecuado en relación con los objetivos de la revisión. Por ejemplo, en el caso de una revisión que aborde la eficacia de una intervención sanitaria, el tipo de estudios que deberían incluirse son, sin duda, los ensayos clínicos aleatorios (randomized controlled trials). Adicionalmente, los estudios que resultan más adecuados son aquellos que abordan la misma cuestión de la revisión.
También deberá considerarse cuáles son los resultados de interés, es decir, las variables de resultado que se han seleccionado para juzgar la utilidad del tratamiento o intervención. Éstas pueden ser variables intermedias (ej. tiempo de cicatrización, reducción de la zona lesionada) o bien variables finales (ej. curación total de la herida), pero en cualquier caso deben priorizarse aquellas variables que resultan más relevantes y que ayudan a comprender mejor las consecuencias prácticas de la aplicación de la intervención. No resulta de utilidad seleccionar estudios que, con independencia de su diseño y/o calidad, poco o nada aportan para una mejor comprensión de su posible impacto en términos de beneficio o riesgos.
Otro aspecto muy importante para valorar la validez de los resultados de una revisión consiste en las estrategias utilizadas para la identificación de los estudios. Como ya hemos comentado anteriormente, una de las características de las revisiones sistemáticas es que realizan amplias búsquedas de toda la información disponible, con el objetivo de llegar a una conclusión a partir de todos los estudios identificados y considerados válidos. Por ello, a fin de evitar sesgos en la identificación de los estudios y facilitar la reproducibilidad de la revisión es importante que los autores describan claramente qué fuentes consultaron: bases de datos electrónicas, revistas en formato papel, resúmenes de congresos, contacto con investigadores expertos en el área, búsqueda en los listados de referencias (pearling) u otras (Tabla 3).
Tabla 3. Estrategias de búsqueda utilizadas en las revisiones sistemáticas
- Búsquedas manuales:
- En revistas
- Abstracts de Congresos
- Listados de Referencias
- Búsquedas electrónicas:
- Revistas electrónicas: The Cochrane Library.
- Bases de datos electrónicas: Medline, Embase, Cinahl, Psyclit, PEDro.
- Registros de Ensayos Especializados de Grupos Cochrane de Revisión.
- Búsquedas mediante buscadores generales en Internet.
- Otras estrategias:
- Contacto con investigadores.
- Contacto con compañías farmacéuticas.
- Registros de ensayos de organismos reguladores o instituciones.
Es también importante que los autores de la revisión incorporen en la publicación de ésta los términos y estrategia de búsqueda utilizada para la identificación de los estudios. Una búsqueda de estudios sesgada o no representativa nos aportará una visión parcial del conjunto de las evidencias. También resulta de interés valorar si los autores de la revisión llevaron a cabo esfuerzos adicionales para identificar estudios no publicados, limitándose de este modo el denominado sesgo de publicación (la tendencia a publicar resultados positivos y a no publicar los estudios con resultados negativos). En resumen, una revisión de calidad debe incluir una estrategia de búsqueda amplia, que combine búsquedas electrónicas con búsquedas manuales en múltiples fuentes de información y, a poder ser, que identifique estudios no publicados.
Una vez hemos valorado qué estrategias se utilizaron para la identificación de los estudios, el siguiente aspecto a tener en cuenta es: ¿cómo se determinó la validez de los estudios incluidos en la revisión? Los autores de la revisión deben exponer claramente cómo evaluaron su calidad. Por ejemplo, ¿utilizaron una de las numerosas escalas existentes para evaluar la calidad de cada estudio incluido? En ese caso, ¿qué criterios o dimensiones tiene en cuenta esa escala y cómo se evalúan? ¿Establecieron los autores unos criterios propios o por el contrario, quizás no se tuvo en cuenta este aspecto porque se asumió (erróneamente) que todos los estudios que cumplían criterios de inclusión para la revisión son de la misma calidad?. Además de los criterios utilizados, debe valorarse cómo se aplicaron: ¿la validez de los estudios fue determinada por una única persona o por más? ¿se hizo de forma independiente? ¿hubo una adecuada concordancia entre estas valoraciones por pares? Las revisiones sistemáticas se basan en numerosos estudios independientes. Si la validez de estos estudios es deficiente, el producto final (la revisión) también verá comprometida su calidad.
Otro aspecto metodológico a evaluar siempre es el de la homogeneidad o consistencia de los resultados observados en los estudios incluidos en la revisión. Aunque se hayan realizado numerosos estudios sobre una misma intervención, los resultados entre ellos pueden ser discordantes e incluso contradictorios. A veces, esta discrepancia puede explicarse debido, por ejemplo, a que los pacientes estudiados son distintos de un estudio a otro (ej. por su gravedad, edad promedio, tiempo de evolución de la enfermedad, etc), o bien porque las variables de resultado no se hayan establecido o medido de la misma forma o, incluso, a causa de que la intervención se esté aplicando de forma distinta (ej. su dosis, duración del tratamiento, etc).
Sin embargo, en otras ocasiones las diferencias no pueden explicarse y se originan debido a errores sistemáticos o bien al azar. Los autores de una revisión deberían tener siempre en cuenta este aspecto al realizar su análisis e interpretación. Existen determinadas pruebas estadísticas para establecer la homogeneidad entre los resultados de un conjunto de estudios, que ayudan a decidir en qué situaciones es posible realizar un meta-análisis combinando sus resultados para obtener una medida de efecto global o, por el contrario, la heterogeneidad es tal que no tiene sentido mezclar cosas muy distintas (coloquialmente lo expresamos diciendo “mezclar peras con manzanas”).
Homogeneidad significa que los resultados de cada estudio individual son matemáticamente compatibles con los resultados de los otros estudios primarios.
Cuanto más homogénea es una prueba (un valor de la p más alto), más probable es que las posibles diferencias sean fruto de la casualidad. En cambio, cuando existe heterogeneidad estadísticamente significativa (p < 10), hay una probabilidad muy elevada de que existan diferencias relevantes entre los estudios (además de sus resultados) y deja de tener sentido integrar los resultados.
¿Cuáles son los resultados?
Los resultados de la revisión deben presentarse de forma clara y detallada. Al igual que en cualquier otro tipo de trabajo de investigación, los resultados deben estar en relación con los objetivos de la revisión y deben responder a las variables propuestas como medidas de resultado. Los resultados de una revisión se suelen presentar de forma narrativa y extensa. En algunos casos, cuando las características de los estudios individuales lo permiten, se utilizan técnicas estadísticas de síntesis cuantitativa o meta-análisis.
En caso de utilizarse esta técnica, se deberá explicitar qué estimadores de efecto se utilizan, el modelo de análisis utilizado y la utilización o no de análisis de sensibilidad. Para aquéllos que están poco familiarizados con los conceptos de la epidemiología clínica, y especialmente con el meta-análisis, éste puede ser el apartado más difícil de valorar.
En la siguiente figura 1 puede verse la representación gráfica de un meta-análisis, con la estimación del efecto (en este caso se utiliza el riesgo relativo [RR]) específica para cada uno de los 13 ensayos clínicos incluidos en el análisis. Este meta-análisis corresponde a una revisión sistemática Cochrane que pretende evaluar la efectividad de la atención hospitalaria del Accidente Cerebrovascular (ACV) según varios modelos de organización de los cuidados para esta patología. En el margen izquierdo de la parte superior se describe la comparación entre intervenciones alternativas (en este caso, modelos de atención del ACV: 01 Unidad de accidentes cerebrovasculares para agudos versus Unidad de medicina general). Debajo, aparecen los estudios incluidos en el análisis, identificados cada uno por su nombre. Los resultados individuales de cada uno de los estudios vienen representados gráficamente en la figura mediante una línea horizontal con un cuadrado (en posición central) sobre la línea. El cuadrado ilustra la estimación puntual del efecto que se obtiene en dicho estudio sobre la variable que se analiza (en este caso la muerte al final del seguimiento). En otras palabras, representa el valor del RR obtenido en cada estudio, que nos cuantifica la magnitud relativa del efecto (en qué medida el riesgo de un grupo se reduce o aumenta en relación con el otro). La línea horizontal representa el Intervalo de Confianza (IC) de esa estimación, es decir, la precisión del resultado. En otras palabras, el IC nos informa del rango de valores dentro del cual se estima que podría hallarse el “verdadero” valor, con un determinado grado de certeza (habitualmente el 95%). A mayor amplitud del IC, menor precisión tienen los resultados y viceversa. Puesto que el IC representa la probabilidad de cometer errores aleatorios, cuanto menor sea la precisión menor seguridad tendremos acerca de la verdadera magnitud del efecto.
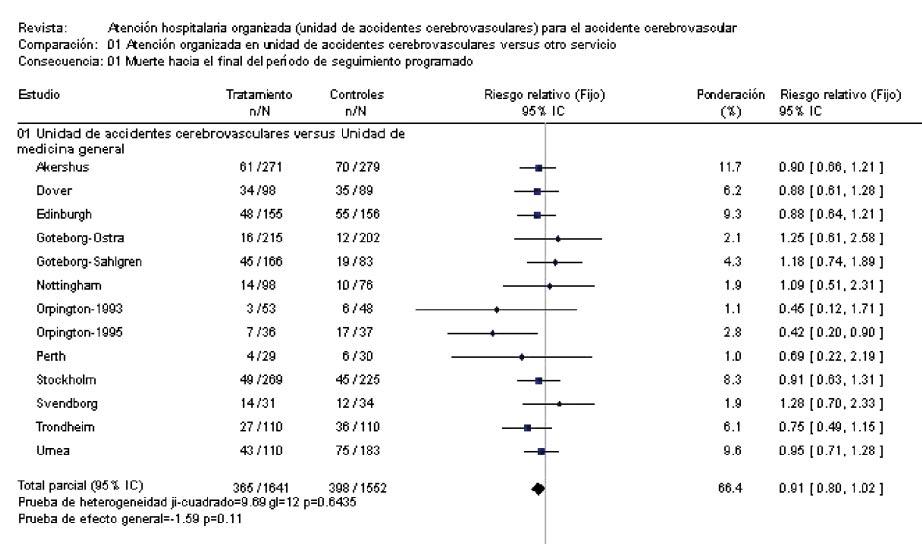
La línea vertical que aparece en el centro de la figura es la llamada línea de efecto nulo, pues corresponde al valor 1, como puede verse en la parte inferior. Un RR igual a 1 significa que existe exactamente el mismo riesgo en ambos grupos que se está comparando. Cuando la línea horizontal que corresponde al IC de la estimación cruza esa línea vertical (es decir, incluye el valor 1 dentro del rango de valores posibles), decimos que no se ha detectado un efecto significativo. En otras palabras, la diferencia observada no es estadísticamente significativa y, por tanto, no podemos excluir la posibilidad de que cualquier diferencia observada se deba al azar. Por el contrario, cuando el IC no incluye ese valor, decimos que existe un efecto favorable a la intervención experimental o control, según de qué lado de la línea vertical cae el IC (en la figura, los resultados a la izquierda de la línea son favorables a las Unidades especializadas de ACV).
Otro elemento importante de la figura es el rombo horizontal que aparece en la parte inferior. Este rombo representa la medida global o combinada del efecto a través de los estudios (RR global), que resulta de la combinación ponderada de los RR de cada estudio individual.
En el meta-análisis de la figura 1, el rombo a la izquierda de la línea vertical (o línea de efecto nulo) muestra un efecto favorable sobre la variable que se analiza (mortalidad al final del seguimiento) para las Unidades especializadas de ACV con respecto al manejo de esta patología en Unidades de medicina general convencionales. Así, el RR global de 0,91 muestra una discreta reducción de la mortalidad (aproximadamente de un 9%) en esta modalidad de cuidados. No obstante, el IC asociado a este valor de RR abarca desde un valor mínimo de 0,80 hasta un valor máximo de 1,02, lo que no permite descartar completamente la posibilidad de que el efecto positivo se deba al azar.
Otro asunto muy distinto, pero igualmente importante, es la interpretación clínica de los resultados numéricos. ¿Qué relevancia tiene disminuir un 9% la mortalidad en este contexto? La respuesta dependerá, en cada caso, de la relevancia que le demos a la variable estudiada, los riesgos, el coste, las preferencias del paciente, etc.
¿Me resultarán útiles los resultados en el cuidado de mis pacientes?
Una vez hemos entendido bien cuáles son los resultados de la revisión, deberemos plantearnos si éstos pueden ser útiles para el cuidado de nuestros pacientes.
Responder a esta pregunta no siempre es fácil. Para ello, resulta necesario considerar diversos aspectos que nos pueden ayudar a decidir si son de utilidad para el cuidado de los pacientes que tenemos a nuestro cargo, en nuestro centro o unidad.
Como ya ha sido mencionado, la primera cuestión a plantearse es la relevancia clínica de los resultados. ¿Qué importancia tienen los resultados obtenidos en la revisión? La significación estadística (un argumento numérico) puede ayudarnos reforzando pero no substituyendo el juicio clínico. Cualquier resultado numérico, por más preciso y “estadísticamente significativo” que sea, debe situarse en el contexto de la pregunta a la que la revisión ha ido dirigida.
Otro aspecto que deberemos valorar es el grado en que los resultados pueden ser extrapolables a nuestros pacientes (conocido como validez externa). ¿Cuál es la probabilidad de que los resultados de la revisión puedan obtenerse también cuando apliquemos la intervención en nuestro propio medio de trabajo? ¿Son éstos generalizables? Para ello, debemos valorar las características de los pacientes incluidos en el estudio y considerar hasta qué punto son muy diferentes de nuestros pacientes (ej. edad, gravedad, tiempo de evolución, otras patologías asociadas o cualquier otro aspecto relevante que pudiera producir una diferencia). Otro aspecto que también puede afectar la validez externa son las condiciones de trabajo donde se aplica la intervención estudiada. Incluso siendo los pacientes iguales, unas condiciones muy distintas a aquéllas en las que se realizaron los estudios en cuanto a medios y recursos disponibles, exploraciones realizadas, experiencia de los investigadores, tiempo disponible, etc, pueden determinar unos resultados muy dispares.
Por tanto, consideraremos, si los resultados de la revisión son clínicamente relevantes, en cuánto se diferencian los pacientes incluidos en la revisión de nuestros pacientes y hasta qué punto difiere nuestro entorno de trabajo con las condiciones bajo las cuales se realizaron los estudios.
Cuando hayamos contestado estas preguntas deberemos pasar a cuestionarnos otros aspectos. Para ello, valoraremos los beneficios esperados de la aplicación de la intervención descrita en la revisión y los posibles riesgos o molestias que puede originar su aplicación en nuestros pacientes. De las intervenciones sanitarias no sólo se espera que sean eficaces sino también seguras; sus riesgos deben ser cuantificables y predecibles.
Estos aspectos son esenciales a la hora de valorar la posible aplicación de una intervención, debiéndose considerar como un binomio inseparable las dimensiones de riesgo/beneficio. Esto va a permitir, además, ofrecer una mejor información al paciente, pues aunque éste se beneficiará de la eficacia también se verá afectado por los posibles riesgos o molestias ocasionadas por la intervención.
Tampoco puede obviarse el asunto de los costes, sobre todo en un contexto de recursos limitados como el nuestro: ¿a qué precio vamos a lograr ciertos beneficios? Teniendo en cuenta que los recursos son limitados y su utilización debe priorizarse, plantearnos el coste de la intervención resulta una pregunta necesaria cuando estemos considerando incorporarla a nuestra práctica, obviamente siempre que la intervención haya demostrado que funciona y que tiene un riesgo aceptable para el paciente. Además, siempre habrá quien nos lo reclamará (el jefe de servicio, de farmacia, de compras, el gerente, etc).
Conflictos de interés: ¿quién realiza y quién financia la revisión?
Aunque los conflictos de interés no suelen ser objeto de atención por las guías tradicionales para la lectura crítica de una revisión sistemática, este aspecto resulta importante en la medida que pueda condicionar la dirección de los resultados de una revisión.
Existen numerosas evidencias empíricas que demuestran que determinados intereses de los investigadores influyen en los resultados de sus estudios, incluso en las revisiones sistemáticas. Los conflictos de interés son todas aquellas situaciones en las que el juicio del científico concerniente a su interés primario, la integridad de una investigación, tiende a estar indebidamente influenciado por un interés secundario, ya sea de tipo económico o personal.
Afortunadamente, éste es un tema que cada vez está adquiriendo más peso dentro de la comunidad investigadora que toma conciencia de su importancia e intenta dar soluciones o recomendaciones al respecto.
Tan sólo hay una medida que parece universal para la prevención del problema y es su declaración pública y explícita.
Por tanto, las revisiones sistemáticas deberían incluir también una sección específica a manera de “una nota” en la que se diga si existieron conflictos de interés de parte de sus autores y, en caso de haberlos, declarar de qué tipo son. Corresponderá a los lectores de la revisión juzgar qué grado de influencia podría haber tenido el conflicto de interés declarado sobre los resultados de la revisión. El Manual para Revisores de la Colaboración Cochrane ofrece una buena guía al respecto.
Todos y cada uno de los aspectos mencionados en el capítulo sólo pueden ser valorados adecuadamente en la medida que la publicación de la revisión aporta la información de forma suficientemente clara. Por ello, resulta esencial consensuar el formato de los artículos de revisión publicados en revistas médica, a fin de facilitar su lectura y eventual utilización por parte de los lectores. El acuerdo QUOROM (QUOROM statement) por parte de los editores de algunas de las más importantes revistas biomédicas contribuirá, sin duda, a una mayor calidad de las revisiones publicadas. Adicionalmente, proporcionan una excelente guía para valorar críticamente este tipo de trabajos.