Niños con problemas médicos
Introducción
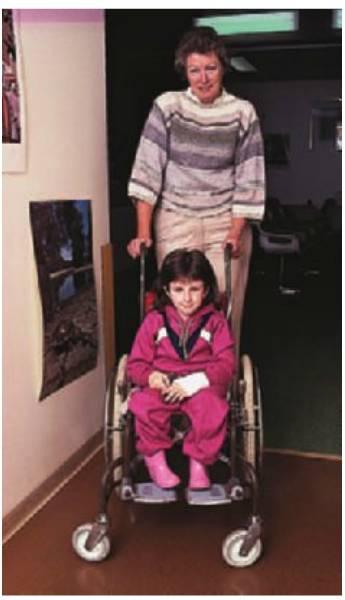
La asistencia clínica global de un niño con problemas médicos requiere la consideración de la afección sistémica subyacente y la coordinación de su tratamiento dental con su médico. Aunque las alteraciones dentales son frecuentes en este grupo de pacientes, su salud es pasada por alto con frecuencia por los profesionales clínicos. El término que se solía emplear para identificar a este conjunto, «niños con problemas médicos», ha sido recientemente sustituido por el de «niños con necesidades especiales». Sin embargo, el primero de estos términos aún mantiene su vigencia, ya que recuerda al dentista que estos niños con frecuencia padecen alteraciones médicas que pueden afectar a su tratamiento dental o que pueden presentarse con manifestaciones orales específicas de una enfermedad sistémica. El presente capítulo analiza las enfermedades pediátricas habituales que han de tenerse en cuenta en el marco de un tratamiento dental óptimo. La prevención de las enfermedades de la boca es importante en niños con problemas médicos crónicos (fig. 10.1), ya que las complicaciones orales pueden comprometer gravemente el abordaje terapéutico médico y el pronóstico general de un niño.
Cardiología
Cardiopatía congénita
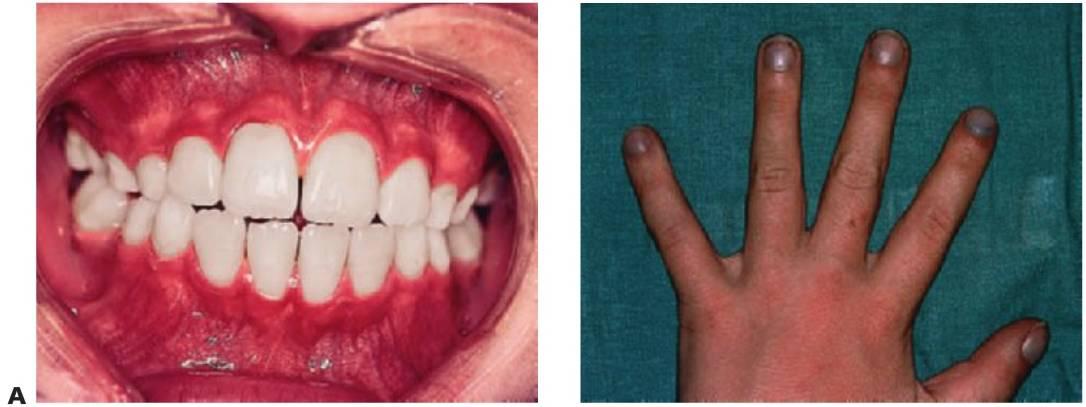
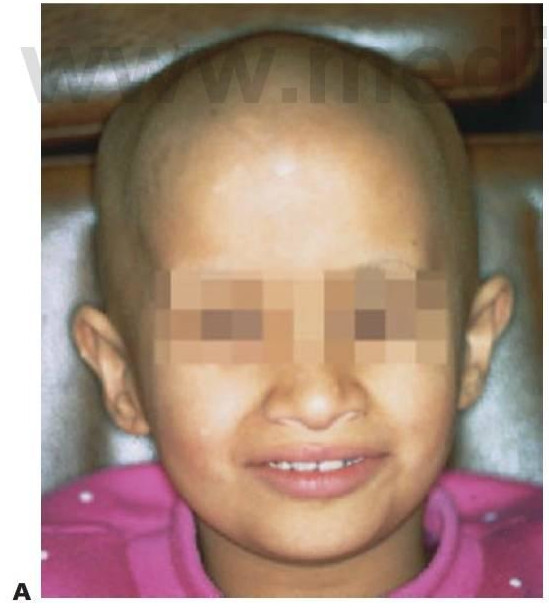
La cardiopatía congénita (CC) presenta una incidencia de 8-10 casos por 1.000 nacidos vivos y constituye el mayor grupo en enfermedades cardiovasculares pediátricas. Aunque la mayor parte de las lesiones se dan a nivel individual, varias constituyen componentes de síndromes o trastornos cromosómicos, como el síndrome de Down (trisomía 21) (fig. 10. 2A) y el síndrome de Turner (cromosoma XO), en el que más del 40% de los niños que los padecen se ven afectados por CC. Sin embargo, en la mayoría de los casos, no puede determinarse una causa concreta y se asume una etiología multifactorial. Entre los factores de riesgo conocidos asociados a CC se cuentan rubéola materna, diabetes, alcoholismo, irradiación y fármacos como talidomida, fenitoína sódica y warfarina sódica.
El flujo sanguíneo turbulento es producido por anomalías estructurales de la anatomía cardíaca y, clínicamente, se presenta en forma de soplo cardíaco. El nivel de morbilidad es determinado por la hemodinámica de la lesión. En fundón de la presentación clínica, las cardiopatías congénitas pueden ser lesiones acianóticas (por derivación o estenosis) o cianóticas. Ocho enfermedades frecuentes son responsables del 85% de los casos.
Afecciones acianóticas
El grupo de trastornos acianóticos se caracteriza por una conexión entre las circulaciones sistémica y pulmonar o por una estenosis (estrechamiento) de ambas. Con frecuencia, los lactantes presentan dificultades de nutrición, disnea y retraso del desarrollo. Las derivaciones son de izquierda a derecha. Las anomalías más frecuentes y sus localizaciones específicas son las siguientes:
- Defecto septal auricular (DSA), generalmente localizado en el agujero oval.
- Defecto septal ventricular (DSV), en el tabique membranoso de la pared ventricular.
- Conducto arterioso permeable (CAP), causado por falta de cierre del conducto que conecta la arteria pulmonar con la aorta (normalmente se cierra poco después del nacimiento). Si se desarrolla una insuficiencia cardíaca, el paciente es tratado con digitálicos y, si es necesario, con diuréticos. También pueden requerirse hospitalización, oxígeno, alimentación por sonda nasogástrica y antibioterapia contra la infección torácica. Si la lesión no se cierra de forma espontánea, está indicada la cirugía destinada a reducir el flujo pulmonar torrencial o reparar el defecto.
Entre los cuadros acianóticos obstructivos se incluyen:
- Coartación o constricción localizada de la aorta, generalmente en el área relacionada con la inserción del conducto.
- Estenosis aórtica o estrechamiento del orificio central de la aorta, por la fusión de las cúspides de las válvulas aórticas.
- Estenosis pulmonar, debida a estrechamiento de la válvula pulmonar y que puede afectar también a las arterias pulmonares.
Afecciones cianóticas
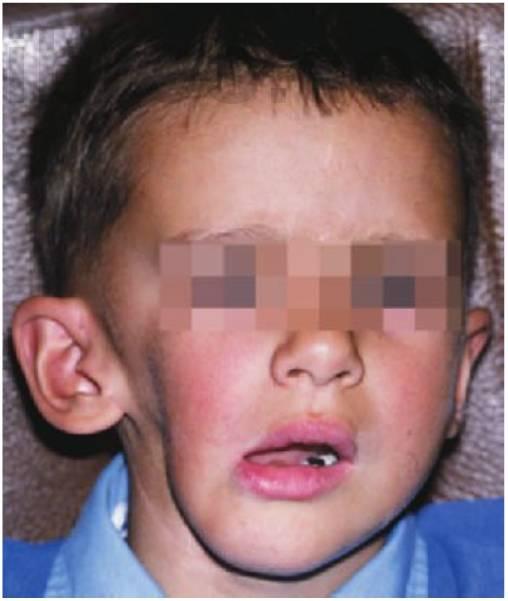
Todos los trastornos cianóticos presentan derivación de derecha a izquierda de sangre desaturada. Los defectos cianóticos se hacen clínicamente evidentes cuando 50 g/l de hemoglobina desaturada están presentes en la sangre arterial periférica. Los lactantes con cianosis leve pueden mantener una coloración rosada en reposo, pero adquieren una tonalidad azul intensa al llorar o hacer ejercicio. Los niños con defectos cianóticos presentan un importante riesgo de desaturación durante la anestesia general, por lo que la consulta con el cardiólogo y el anestesista pediátricos resulta esencial (fig. 10.2).
Las principales lesiones cianóticas son:
- Tetralogía de Fallot, que incluye DSV, estenosis pulmonar a nivel valvular o subvalvular, aorta cabalgante e hipertrofia ventricular izquierda.
- Transposición de grandes vasos, que se produce cuando la aorta sale del corazón desde el lado derecho y la arteria pulmonar lo hace desde el izquierdo. Aunque la anatomía del corazón interno es normal, la circulación sanguínea sistémica no puede restaurarse con oxígeno y es necesario el tratamiento inmediato de la transposición, abriendo el conducto arterioso y procediendo a corrección quirúrgica.
- Síndrome de Eisenmenger, que se manifiesta con cianosis por derivación de derecha a izquierda causada por aumento de la resistencia pulmonar por DSV o DSA.
- Atresia tricuspídea, debida a ausencia de la válvula tricúspide y que puede presentarse con ventrículos derecho y válvula pulmonar ausentes. La circulación pulmonar se mantiene a través de un CAP en neonatos.
- Atresia pulmonar, similar a la tricuspídea, excepto por el hecho de que la válvula tricúspide es permeable.
Otras enfermedades cardiovasculares
Otros trastornos cardiovasculares pediátricos frecuentes son miocardiopatías, como el infarto de miocardio y la pericardiopatía, la arritmia cardíaca, la endocarditis infecciosa y la cardiopatía reumática (CR). Tanto la CC como la CR predisponen el revestimiento interno del corazón a infecciones bacterianas o fúngicas (endocarditis infecciosa) y dan lugar a la formación de vegetaciones friables de células sanguíneas y organismos. En ocasiones, las vegetaciones se embolizan, causando infartos renales, pulmonares o miocárdicos, o accidentes cerebrovasculares. Streptococcus virídans, un comensal habitual de la cavidad oral, es el responsable mayoritario de la endocarditis infecciosa crónica, mientras que Staphylococcus aureus se ve a menudo implicado en la forma fulminante de la endocarditis infecciosa.
Tratamiento odontológico
En el tratamiento odontológico de niños con trastornos cardíacos se han de seguir una serie de principios esenciales. Tras la realización de técnicas dentales invasivas se registra en ocasiones una bacteriemia transitoria, potencialmente causante de endocarditis infecciosa en pacientes susceptibles. Así pues, todos los niños con CC o CR previa requieren profilaxis antibiótica para reducir el riesgo de endocarditis infecciosa (v. Apéndice E). Los niños trata dos previamente con antibióticos a largo plazo han de recibir un fármaco alternativo en función del protocolo, a fin de evitar el desarrollo de organismos orales resistentes. Además, se recomienda el uso de colutorios antisépticos, como el de gluconato de clorhexidina al 0,2%, para disminuir los recuentos bacterianos orales.
Los niños con CC presentan mayor prevalencia de alteraciones del esmalte en la dentición primaria y riesgo concomitante de caries temprana. Algunos fármacos de uso cardíaco contienen hasta un 30% de sacarosa y, por otra parte, la prescripción de suplementos dietéticos de alto contenido calórico incrementa igualmente el riesgo de caries. Para reducir dicho riesgo en niños susceptibles se recomienda una meticulosa higiene oral, con medidas preventivas, como el sellado de fisuras y el uso tópico de fluoruro.
Las enfermedades dentales en niños con trastornos cardíacos pueden complicar significativamente su tratamiento médico. Hasta que el cuadro se estabilice, los niños con enfermedad cardiovascular avanzada han de recibir un tratamiento dental solamente paliativo. Se recomienda el tratamiento agresivo de los dientes primarios con afectación pulpar. La pulpotomía o la pulpectomía están contraindicadas en estos niños, ante la posibilidad de bacteriemia crónica subsiguiente. Aunque el tratamiento de rutina en la clínica dental es viable, a menudo es preferible tratar a los pacientes pediátricos de este tipo con múltiples caries en un entorno hospitalario y bajo anestesia general. Así se puede completar el tratamiento en una sola intervención invasiva y se evita el riesgo de endocarditis infecciosa, incrementado en las intervenciones sucesivas. Si están previstas varias visitas, han de prescribirse antibióticos alternativos o dejar pasar un mes entre cita y cita para reducir la posibilidad de resistencia bacteriana.
Una completa valoración preoperatoria de la medicación habitual del niño (incluyendo anticoagulantes, antiarrítmicos y antihipertensivos) es esencial para evitar posibles interacciones farmacológicas. No hay contraindicaciones para el uso de vasoconstrictores en las soluciones anestésicas locales. Si se procede a sedación consciente, los signos vitales y la saturación de oxígeno durante la técnica han de monitorizarse con atención. Ante posibles interferencias, en pacientes pediátricos con marcapasos se debe evitar el uso de electrocirugía, vitalómetros electrónicos y dispositivos de limpieza por ultrasonidos.
Hematología
Trastornos de la hemostasia
La hemostasia primaria se inicia tras la lesión de un vaso sanguíneo, con formación de un tapón primario de plaquetas. Este proceso es mediado por interacciones entre las plaquetas y los factores de coagulación en el plasma y en la pared del vaso. La hemostasia secundaria, o coagulación, también es desencadenada por la lesión inicial y alcanza su máxima intensidad tras la formación del tapón plaquetario. El depósito de fibrina conforma la red a partir de la cual se forma un coágulo estable.
La hemorragia prolongada se produce cuando cualquier fase de la hemostasia se ve alterada. Las manifestaciones clínicas de dichas alteraciones varían según la fase afectada. Los defectos de la hemostasia primaria generalmente originan hemorragia en superficies cutáneas o mucosas, con desarrollo de petequias y púrpura (equimosis). Entre estos trastornos se cuentan la enfermedad de von Willebrand y diversos defectos de la función plaquetaha. En cambio, las alteraciones de la hemostasia secundaria, como la hemofilia, inducen una hemorragia que tiende a asentarse más en músculos y articulaciones. En ambos casos, se registran a veces hemorragias orales incontroladas y prolongadas, causadas por episodios intrascendentes como la mordedura de la lengua o el interior de la mejilla.
Los niños con trastornos hemostáticos pueden ser identificados a través de una completa historia médica, con exploración y pruebas de laboratorio. Las preguntas han de centrar se en episodios de hemorragia espontánea o al cepillarse los dientes, la existencia de casos de hemorragia prolongada en otros miembros de la familia y la prescripción de fármacos anticoagulantes. Se ha de proceder a exploración física de la piel, las articulaciones y la mucosa oral, para detectar petequias, equimosis y hematomas. Si se sospecha de un trastorno hemostático, se recomienda la derivación a un hematólogo para que proceda a la evaluación y realización de pruebas diagnósticas.
Pruebas de laboratorio
El PFA 100 (siglas inglesas de analizador de la función plaquetaria) se utiliza como prueba de detección selectiva de la enfermedad de von Willebrand y las disfunciones de las plaquetas. Si estas alteraciones son prolongadas, a veces se requieren pruebas específicas.
El hemograma completo (HC) se obtiene para determinar los niveles plaquetarios (rango normal 150-400 x109/l), siendo necesarias pruebas de función plaquetaria en casos concretos. La hemostasia apropiada se suele mantener con no menos de 40x109 plaquetas/l.
Las pruebas de coagulación incluyen tiempo de protrombina (TP), que analiza la vía de coagulación extrínseca (rango normal 11-17 seg), y el tiempo de tromboplastina parcial activada (UPA), que evalúa la vía de coagulación intrínseca (rango normal 24-38 seg). Los tiempos que superen en 2 segundos los valores de control se consideran anómalos.
Clasificación
Trastornos vasculares
Los trastornos vasculares se caracterizan por aumento de la fragilidad capilar, e incluyen púrpuras, telangiectasia hemorrágica hereditaria, hemangiomas, carencia de vitamina C y enfermedades del tejido conjuntivo, como el síndrome de Ehlers-Danlos.
Trastornos plaquetarios
Pueden corresponder a déficit (trombocitopenia) o disfunción.
Trombocitopenia
La trombocitopenia es el recuento plaquetario <150x109/l. Los signos y síntomas asociados a esta disminución son los siguientes:
<75 x 109/l Posible hemorragia postoperatoria <25 x 109/l Hemorragia espontánea, fácil formación de equimosis <15 x 109/l Petequias cutáneas < 5 x 109/l Petequias orales, hemorragias submucosas y mucosas
La trombocitopenia puede darse como entidad aislada de causa desconocida (púrpura trombocitopénica idiopática [PTI]), como consecuencia de supresión de la médula ósea por acción de fármacos, o por causa de otras enfermedades hematológicas, como la anemia aplásica. La sustitución de médula por células neoplásicas en neoplasias malignas hematológicas también es motivo de trombocitopenia. Los niños sometidos a quimioterapia presentan recuentos plaquetarios disminuidos.
Trombocitosis
La trombocitosis es el aumento del número de plaquetas (>500x109/l) y se asocia a hemorragia prolongada por función plaquetaria anómala. Puede generar trastornos mieloproliferativos.
Trastornos de la función plaquetaria
Son congénitos o adquiridos. La causa más común de trastornos adquiridos de este tipo es el uso de antiinflamatorios no esteroideos (ej. ácido acetilsalicílico). La administración de inhibidores de la ciclooxigenasa bloquea la producción de tromboxano A2 durante el tiempo de vida de la plaqueta (7-9 días). Ello determina una disminución de la agregación plaquetaria. Algunos cuadros metabólicos, como la enfermedad de Gaucher, también se manifiestan con defectos de la función plaquetaria.
La reducción del número o la disfunción de las plaquetas producen falta de formación de coágulo inicial. Los niños afectados de trombocitopenia sangran inmediatamente después del traumatismo o la intervención quirúrgica, a diferencia de los hemofílicos, que lo hacen unas 4 horas después. Las manifestaciones orales más frecuentes son petequias y equimosis. También puede haber hemorragia gingival espontánea y episodios hemorrágicos prolongados tras un traumatismo menor o después de cepillarse los dientes.
Trastornos de la coagulación hereditarios
Los trastornos de la coagulación se deben a una disminución de la cantidad de determinados factores plasmáticos en la cascada de coagulación. Los más habituales son la hemofilia A y la enfermedad de von Willebrand, ambas causadas por reducción de los niveles de factor VIII. Dicho factor es producido por células endoteliales y consta de dos porciones. La parte mayor de la molécula es el factor de von Willebrand, responsable de la agregación plaquetaria inicial. La parte del factor VIII del complejo y el factor IX son responsables de la activación del factor X en la vía intrínseca de la cascada de coagulación. Otros trastornos de la coagulación son la carencia de vitamina K, la hepatopatía y la coagulación intravascular diseminada, generalmente por infección fulminante (por gramnegativos).
Las alteraciones de la coagulación se clasifican en función del factor plasmático deficitario. Los trastornos más habituales son las carencias de factor VIII (hemofilia A) y de factor IX (hemofilia B o enfermedad de Christmas). La enfermedad de von Willebrand ocupa una singular posición, en la que las actividades plaquetaria y del factor VIII están disminuidas, por lo que el TP y el TTPA están prolongados.
Hemofilia A
Se trata de un trastorno hereditario recesivo ligado al cromosoma X, con déficit de factor VIII, y se produce en 1 de cada 10.000 nacidos vivos. En el 30% de los casos hay mutación espontánea. La enfermedad se clasifica como:
- Grave (< 1 % de factor VIII), con hemorragia espontánea en articulaciones y músculos.
- Moderada (<2-5% de factor VIII), con hemorragia menor, generalmente después de un traumatismo leve.
- Leve (5-25% de factor VIII), que puede no manifestarse hasta la mediana edad, tras un traumatismo significativo o una intervención quirúrgica.
La prueba del factor VIII suele realizarse después de diagnosticar una coagulopatía. Los niños afectados y sus familias necesitan un considerable apoyo médico, y es posible que haya que implantar una línea central permanente para la infusión continuada de factor VIII.
Hemofilia B o enfermedad de Christmas
Enfermedad que presenta rasgos clínicos similares al déficit de factor VIII. También es hereditaria, recesiva y ligada al cromosoma X, y da lugar a prolongación del TPPA. Se diagnostica mediante una prueba específica de factor IX.
Enfermedad de von Willebrand
La enfermedad de von Willebrand se hereda como rasgo autosómico dominante (locus genético 12p13). Sus manifestaciones clínicas más frecuentes son epistaxis y hemorragia nasal y gingival. El factor de von Willebrand se encuentra en plasma, plaquetas, megacariocitos y células endoteliales, y circula como componente principal del complejo de la molécula de factor VIII. La enfermedad presenta varios subtipos, en función de la estructura multimérica plaquetaria y plasmática del factor de von Willebrand.
Tratamiento odontológico
El tratamiento dental de niños con sospecha de trastornos de la hemostasia ha de iniciarse con pruebas de detección selectiva de laboratorio. Si los resultados de las mismas son anómalos, se requiere consulta hematológica para establecer un diagnóstico definitivo. Las técnicas odontológicas invasivas sólo pueden abordarse después de determinar el alcance de la afectación. Nunca se debe proceder a una extracción sin haber consultado a un hematólogo. Antes de la extracción son preferibles niveles plaquetarios superiores a 80x109/l. Las técnicas de endodoncia son preferibles a las extracciones para evitar la transfusión de plaquetas.
Técnicas odontológicas
- Se deben usar técnicas atraumáticas. En caso de que sea necesaria cirugía oral, es imprescindible emplear una técnica que minimice el nivel de traumatismo y adoptar medidas de control de la hemorragia, como una cuidadosa sutura atraumática o la colocación de apósitos en los alveolos.
- La anestesia de infiltración maxilar suele administrarse lentamente sin tratamiento previo de reposición de plaquetas o factores. No obstante, si la inyección de infiltración se realiza en tejido conjuntivo laxo o en un área muy vascularizada, es aconsejable la reposición de factor hasta alcanzar niveles de actividad del 40%.
- Conviene evitar las inyecciones de bloqueo mandibular, ya que pueden verse complicadas por hematomas disecantes y obstrucciones de las vías respiratorias. Si no se dispone de medios de reposición de factores, pueden emplearse inyecciones intraperiodontales, aunque con extrema precaución. La solución anestésica se implanta bajo presión moderada en las cuatro superficies axiales del diente, insertando la aguja en el surco gingival y el espacio del ligamento periodontal.
- La sedación con óxido nitroso es eficaz para técnicas restauradoras que requieran anestesia local. Sin embargo, se ha de tener cuidado al colocar las bandas de matriz.
- Debe emplearse dique de goma para proteger los tejidos blandos.
- El tratamiento endodóncico puede aplicarse sin cobertura de factores.
- El tratamiento periodontal con curetaje radicular o subgingival requiere reposición de factores.
- Para las extracciones múltiples, el paciente ha de ser hospitalizado y sometido a examen hematológico, en coordinación con el equipo de hematología.
Tratamiento médico
Hemofilia A
- Todos los pacientes pediátricos y la mayoría de los adultos son tratados con factor VIII recombinante. Un pequeño número de adultos se somete a tratamiento con factor VIII derivado de plasma recombinante o purificado.
- La hemorragia grave se trata con una reposición del 100%, mientras que otras menores se controlan con niveles de reposición parcial del 30 al 50%.
- Los traumatismos menores pueden llegar a amenazar la vida del paciente, en especial en caso de hemorragia intracerebral.
- Algunos pacientes forman anticuerpos (inhibidores) contra el factor VIII, complicando sustancialmente el tratamiento médico.
- Una única unidad de concentrado de factor VIII por kg incrementa los niveles de sangre en aproximadamente un 2% y tiene una semivida de 10-12 horas.
Hemofilia B
- El mismo tratamiento que el de la hemofilia A, pero infundiendo factor IX recombinante (monoclonal) o derivado de plasma altamente purificado.
Enfermedad de von Willebrand
- La de tipo I puede tratarse con 1-desamino (8-D-arginina) vasopresina (DDAVP).
- Los tipos II y III requieren ser tratados con concentrado de factor VIII derivado de plasma purificado (que contiene tanto factor VIII como factor de von Willebrand).
- Si es posible, deben evitarse las transfusiones plaquetarias, debido al desarrollo de anticuerpos antiplaquetarios y al riesgo de transmisión de enfermedades víricas, como las hepatitis B y C.
Otros sustitutos de factores
- Factor VIII activado recombinante para la hemofilia A con inhibidores y déficit de factor VII.
Antifibrinolíticos
- Ácido tranexámico.
DDAVP
- Puede emplearse en personas con hemofilia o enfermedad de von Willebrand.
- En ocasiones genera duplicación de la liberación de factor VIII por parte de las células endoteliales, en caso de que los niveles de factor VIII sean > 10% y el paciente responda al DDAVP.
La administración postoperatoria de antifibrinolíticos, como el ácido tranexámico, en dosis de carga de 25 mg/kg y 15-20 mg/kg tres veces al día durante 5-7 días sirve para prevenir la lisis de coágulos. Durante el tiempo de administración de estos agentes, se debe indicar a los padres y al niño que no utilice pajitas, utensilios de metal, chupetes o tetinas de goma.
La hemorragia por hemofilia se suele retrasar 12-24 horas, ya que la hemostasia primaria no se ve deteriorada, y la presión local tiene un escaso efecto. Conviene destacar que la hemofilia leve queda a veces sin ser diagnosticada. El U PA no es sensible para detectar déficits leves de FVIIIc, y niveles de dicho factor de 25-30 Ul/dl pueden asociarse a un UPA normal. Además, los valores de FVIIIc en la hemofilia leve están temporalmente elevados (como sucede en las personas sanas) en caso de estrés, ejercicio y hemorragia. Si hay antecedentes atendibles de tendencia a la hemorragia, se ha de realizar una prueba de factores específicos, incluso aunque las pruebas de detección iniciales sean normales.
El régimen normal para el DDVAP es 0,3 p.g/kg en infusión i.v. durante 1 hora antes de la cirugía, seguidos de 15-20 mg de ácido tranexámico cada 8 horas durante 7 días. Si los niveles de FVIIIc aún están bajos (50-60%), a las 9-12 horas puede repetirse la dosis original de DDVAP. Cuando se prevean o se requieran dosis repetidas, es importante limitar la ingesta líquida del paciente y controlar los electrólitos. Las dosis repetidas de DDVAP causan retención de líquidos e hiponatremia. Esta pauta es útil para la enfermedad de von Willebrand y los niños en diálisis renal.
Tratamiento anticoagulante
El tratamiento anticoagulante en niños requiere una consideración especial. Los anticoagulantes se suelen prescribir para niños con cardiopatía valvular y prótesis valvulares, con el fin de reducir el riesgo de removilización. Si son necesarias extracciones o abordajes quirúrgicos, deben reducirse los tiempos de formación de coágulo para facilitar la coagulación, aunque no llegando a generar riesgo de formación de émbolos o coágulos en torno a las válvulas. El tra tamiento odontológico de estos niños también puede complicarse por sus defectos cardíacos congénitos, siendo necesarios antibióticos como profilaxis contra la endocarditis infecciosa.
Fármacos empleados como tratamiento
Warfarina sódica oral:
- Antagonista de la vitamina K que induce depleción de factores II, VII, IX y X.
- Se suelen requerir 3-4 días para una completa anticoagulación, cuya eficacia se evalúa en función del TP (niveles de factor VII).
Heparina sódica:
- Acción más breve, de inicio inmediato (inhibe los factores IX, X y XII).
- Puede administrarse por vía subcutánea, en forma de derivado de bajo peso molecular, o por vía intravenosa, siempre bajo supervisión de un hematólogo pediátrico.
Enoxaparina sódica:
- Heparina de bajo peso molecular que inhibe el factor Xa y la trombina.
- Se suele administrar por vía subcutánea.
Los niños sometidos a tratamiento anticoagulante deben dejar de tomar warfarina 3-5 días antes de la cirugía. En los que presenten riesgo significativo de trombosis con niveles subterapéuticos de warfarina, es a veces necesaria la anticoagulación parenteral. Ésta se consigue con enoxaparina sódica, en dosis de 1,5 mg/kg s.c. una vez al día (en la mañana) mediante Insuflon. El fármaco deja de administrarse la mañana de la intervención. De este modo, el niño puede ser hospitalizado el mismo día de la cirugía dental. La administración de dosis normales de warfarina se reanuda la tarde del mismo día de la intervención. Si se necesita mayor grado de profilaxis con exoparina sódica, ésta se administra la mañana siguiente a la cirugía, y se mantiene hasta que el TP y el índice normalizado internacional (INR, por sus siglas inglesas) sean terapéuticos. La monitorización de enoxaparina sódica no suele ser necesaria. En situaciones de urgencia, con hemorragia prolongada por heridas orales postoperatorias, además de reanudar la administración de warfarina, es también útil el uso de plasma fresco congelado (PFC).
Medidas hemostáticas locales
- Aplicación de trombina tópica.
- Empaquetamiento del alveolo con hemostático de colágeno microfibrilar o celulosa regenerada oxidada.
- Sutura de las encías adheridas para mantener la presión.
- Férulas y apósitos estomoadhesivos también son útiles.
- Se han publicado informes recientes sobre la eficacia del «adhesivo de fibrina» en el tratamiento de coagulopatías, aunque su empleo en la superficie húmeda de la mucosa presenta limitaciones.
Tratamiento de la hemorragia oral
La hemorragia imprevista en la cavidad oral puede darse en cualquier momento. Se presenta como lenta supuración que se prolonga durante días, o bien como pérdida de sangre oral súbita y rápida. La hemorragia se presenta a veces sin previo aviso y puede asociarse a cualquier trabajo previo de exploración o quirúrgico. También se registra tras técnicas de rutina, como biopsias, restauraciones o extracciones.
El tratamiento inicial de estos casos implica la identificación del sitio exacto de la hemorragia, el control de la misma y la prevención de recidivas. En caso de hemorragias orales no asociadas a procedimiento dental, debe registrarse una detallada historia de las hemorragias, su duración, el volumen de sangre perdido y todos los potenciales agentes causales. Es posible que se registren hemorragias durante la erupción dental, en una localización de exfoliación dental, o bien que el proceso se relacione con malos tratos físicos o sexuales, o con alteraciones vasculares congénitas, como malformaciones arteriovenosas. También existe la posibilidad de neoplasia maligna infantil.
En casos de hemorragia oral subsiguiente a técnicas odontológicas, han de seguirse los siguientes pasos (es importante prevenir o minimizar la hemorragia en primer lugar):
- Limitación sustancial del traumatismo quirúrgico.
- Compresión digital del alveolo tras una extracción dental.
- Llenado de la cavidad con gel reabsorbible.
- Sutura adecuada de los sitios de extracción para reducir las complicaciones postoperatorias.
- Aplicación de presión en el sitio quirúrgico con apósitos de gasa.
- La construcción de una férula extraíble es recomendable tras una cirugía más extensa.
- Instrucciones postoperatorias por escrito sobre reposo, no tomar alimentos fuertes y cepillado de dientes.
- La prescripción de medicación sin ácido acetilsalicílico es necesaria para evitar cualquier posible confusión de los padres.
En casos de hemorragia grave no controlable tras una extracción dental, que puede deberse a malformaciones arteriovenosas, es necesario recordar que el mejor método de control hemorrágico es recolocar el diente extraído en la cavidad y suturarlo bien.
Trastornos eritrocitarios
Anemia
Se considera que existe anemia cuando los niveles de hemoglobina son inferiores a 100 g/l. La causa de la anemia en niños puede deberse a pérdida de sangre, carencias de hierro, folato y vitamina B12, insuficiencia de médula ósea, hemolisis eritrocitaria o trastornos crónicos. Suele detectarse accidentalmente en el tratamiento odontológico pediátrico de rutina. Un hemograma completo (HC) se solicita cuando el niño se presenta con palidez, letargo, fiebre, equimosis, trastornos sistémicos u orales sin diagnosticar, secuelas de un traumatismo serio asociado a pérdida de sangre significativa, o en las pruebas diagnósticas previas a cirugía por otras lesiones. Cuando se detecta una anemia de forma inesperada, el pediatra debe proceder a su seguimiento.
Anemia hemolítica
La enfermedad hemolítica aguda del recién nacido, o eritroblastosis fetal, es causada por incompatibilidad de grupos sanguíneos e isoinmunización Rhesus (Rh). Produce de coloración de los dientes que se están calcificando en el momento del nacimiento. Las puntas de las cúspides de los primeros molares permanentes también se ven afectadas. Es frecuente la coloración amarillenta o verdosa, por los altos niveles de bilirrubina no conjugada.
Glucosa-6-fosfatasa-deshidrogenasa (G6PF)
La carencia de G6PG también induce una anemia hemolítica aguda cuando el niño es expuesto a diferentes fármacos (sulfonamidas, cloranfenicol, ácido acetilsalicílico, antipalúdicos) o a infección (hepatitis).
Anemia aplásica
La anemia aplásica es la disminución o ausencia de hemopoyesis en la médula ósea, no causada por afectación medular o por un proceso patológico reconocido. El HC y el aspirado de médula ósea confirman el diagnóstico. El trasplante de médula ósea es el tratamiento de elección en los casos moderados o graves.
Hemoglobinopatías
Talasemia
Las hemoglobinopatías son un grupo de trastornos genéticos que afectan a las cadenas de globina del complejo hemoglobina (Hb). Estas enfermedades comprenden dos grupos principales: las hemoglobinopatías estructurales, que producen una estructura anómala de la globina (HbE, HbS), y las talasemias, en las que la mutación genética determina una reducción de la producción de cadena de globina.
La sangre del adulto contiene hemoglobina A, compuesta por dos cadenas de globina (HbA) y una pequeña cantidad de hemoglobina A2 (HbA2). Los niños producen también una parte de hemoglobina fetal (HbF). La a-talasemia homocigótica es incompatible con la vida, mientras que el fenotipo heterocigótico presenta pocos síntomas clínicos. Dado que son muchos los genes implicados, la combinación más probable es de homocigotos de un mismo gen o de heterocigotos dobles de genes distintos.
Más significativa es la (3-talasemia homocigótica o mayor (anemia de Cooley). Causada por ausencia de cadena (3, induce una producción compensatoria de HbA2 y HbF. La eritropoyesis es inadecuada, la médula ósea es reactiva y se registra una hemopoyesis intermedu lar compensatoria en el maxilar superior y el diploe del cráneo. En ocasiones se dan casos de anemia hemolítica grave con hepatoesplenomegalia intensa y desarrollo insuficiente. Los niños con (3-talasemia drepanocítica muestran signos de trombosis vascular e isquemia en ciertos órganos, en especial los huesos.
El sobrecrecimiento maxilar y cigomático induce a veces maloclusión grave de clase II, división 1, con separación de dientes y ensanchamiento del espacio del ligamento periodontal. Las radiografías craneales laterales ponen de manifiesto un aspecto de «cabello erizado». A los niños afectados se les suministran hipertransfusiones de concentrado de hematíes hasta que el nivel de hemoglobina asciende a 140-150 g/l y la desferroxamina, un quelante del hierro, aumenta la excreción de este elemento. Cuando una hemosiderosis excesiva en el bazo se añade de manera significativa a la tasa de hemolisis, se procede a la esplenectomía.
Drepanocitosis
Esta enfermedad se distingue de las otras hemoglobinopatías por el hecho de que los eritrocitos son más susceptibles a la hemolisis y tienen dificultad para atravesar los vasos sanguíneos pequeños, produciendo infartos e isquemia en órganos y hueso. Son necesarias medidas como transfusiones sanguíneas, analgésicos y antimicrobianos, e hidratación adecuada u otros recursos de apoyo.
Tratamiento odontológico
La consulta previa con el hematólogo del niño es esencial para establecer la preparación hematológica y las posibles transfusiones. Es importante que el tratamiento odontológico se programe poco después de las transfusiones, con la correspondiente profilaxis antibiótica, sobre todo si el niño ha sido esplenectomizado. El tratamiento no urgente debe evitarse cuando la hemoglobina sea inferior a 100 g/l. Se ha de minimizar el estrés que impida la adecuada oxigenación de los tejidos del paciente, evitando el uso de depresores respiratorios y proporcionando oxigenación adicional durante la sedación consciente. La anestesia local no está contraindicada, aunque no se aconseja usar prilocaína, por la potencial formación de metahemoglobina. Los vasoconstrictores en dosis estándar no están contraindicados. Se pueden abordar tratamientos de ortodoncia, aunque es conveniente acelerar los desplazamientos de los dientes a través de los huesos y en ocasiones se registran recidivas.
Inmunodeficiencia
La inmunodeficiencia puede deberse a déficits cuantitativos o cualitativos de neutrófilos, a inmunodeficiencias primarias (con implicación del complemento, células T o células B), inmu- nodeficiencias combinadas y a inmunodeficiencias secundarias o trastornos adquiridos.
Trastornos neutrofílicos cualitativos
Trastornos quimiotácticos
- Síndrome de Chediak-Higashi.
- Síndrome del leucocito perezoso.
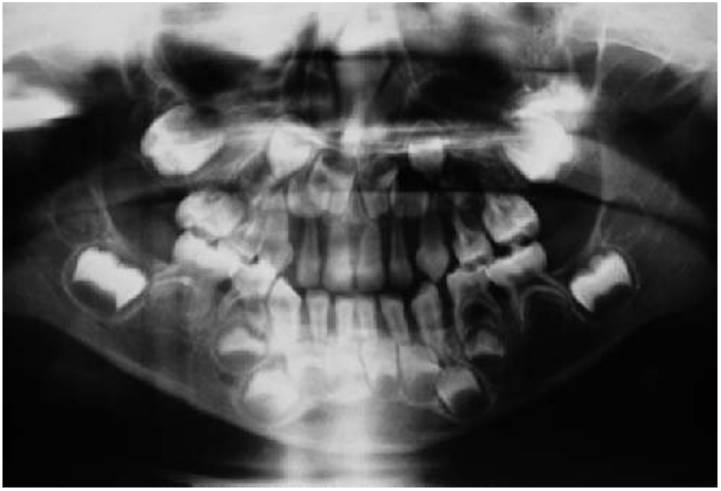
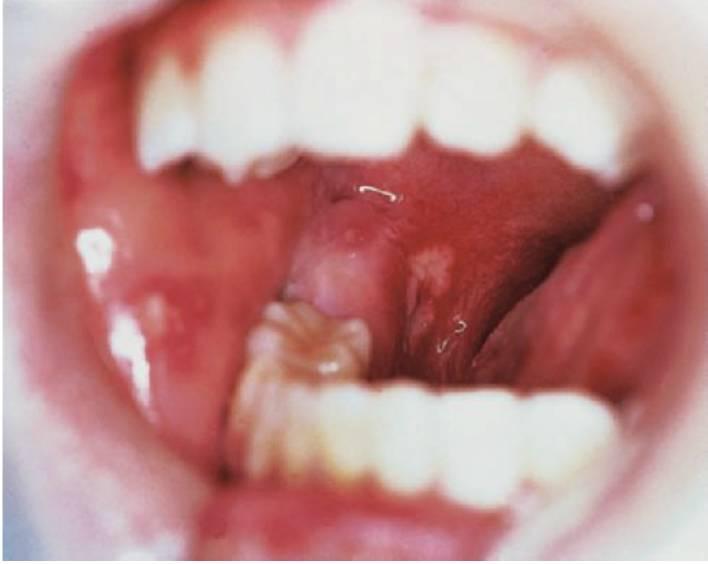
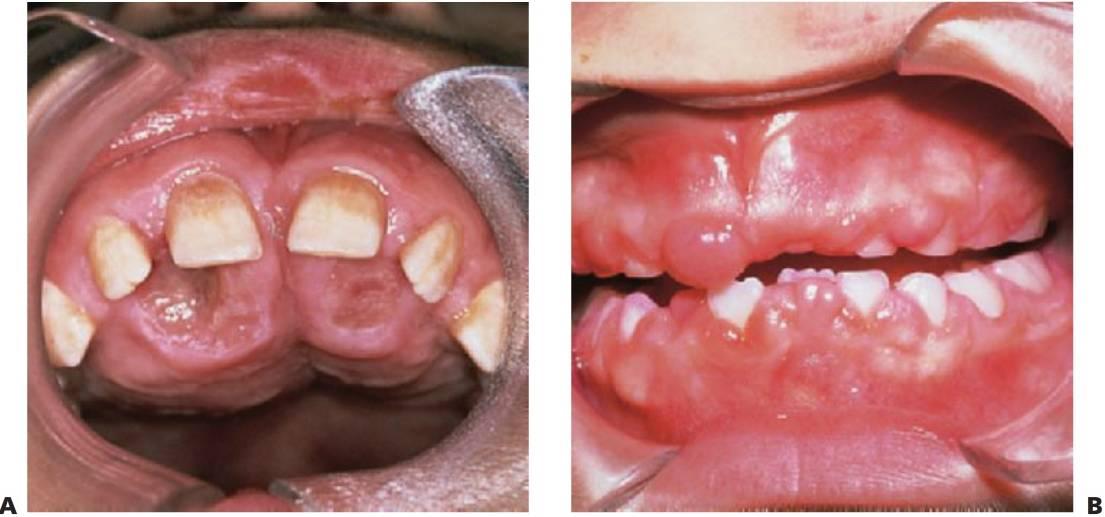
- Deficiencias de adhesión leucocitaria (fig. 10.4).
Trastornos fagocitarios
- Agammaglobulinemia.
- Enfermedad granulomatosa crónica.
Trastornos neutrofílicos cuantitativos
Neutropenia
Se define como < 1 ,8 x1 09 células/l. La sepsis que amenaza la vida del paciente se asocia a un nivel de neutrófilos de < 0 ,5 x1 09 células/l. La neutropenia se presenta en las siguientes situaciones:
- Infiltración de médula ósea por células neoplásicas.
- Tras administración de fármacos citotóxicos para el tratamiento de neoplasias malignas pediátricas.
- Neutropenia cíclica (ciclos de 21-28 días).
- Agranulocitosis.
- Anemia aplásica.
- Neutropenia inducida por fármacos.
Inmunodeficiencias primarias
Alteraciones de las células B
- Deficiencia selectiva de IgA.
- Agammaglobulinemia.
Alteraciones de las células T
- Síndrome de Di George con aplasia tímica.
- Candidiasis mucocutánea crónica.
Inmunodeficiencias secundarias o adquiridas
Incluyen trastornos adquiridos en la infancia, como:
- Infección por el virus de la inmunodeficiencia humana (VIH).
- Inmunodeficiencia inducida por fármacos (citotóxicos, corticoides, ciclosporina A, tacrolimus).
También se registran en niños sometidos a trasplante de médula ósea y radioterapia (inmunodeficiencia inducida por radioterapia).
Inmunodeficiencias combinadas
- Inmunodeficiencia combinada grave.
- Síndrome de Wiscott-Aldrich.
- Ataxia-telangiectasia.
Implicaciones odontológicas
Las inmunodeficiencias mediadas por neutrófilos o células T predisponen al niño a infección por compromiso de su sistema de defensa. Los organismos oportunistas que no suelen causar enfermedad en niños sanos proliferan en ocasiones en la cavidad oral de un huésped inmunodeprimido. Manifestaciones orales habituales son:
- Candidiasis seudomembranosa aguda (fig. 10.5B).
- Gingivitis grave.
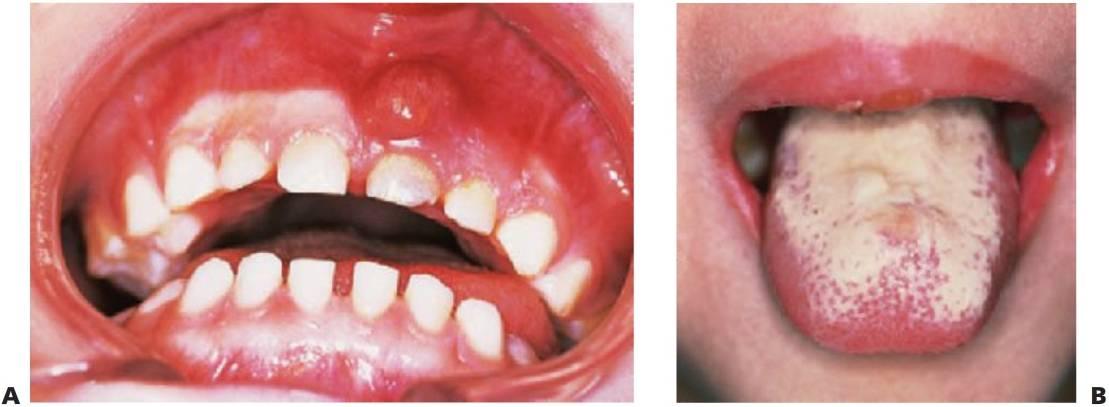
- Periodontitis prepuberal generalizada (fig. 10.4).
- Gingivoestomatitis.
- Ulceración aftosa recurrente.
- Infección recurrente por herpes simple (VHS).
- Exfoliación prematura de dientes primarios.
Generalmente, las deficiencias de células B presentan menos complicaciones orales, aunque a menudo se asocian a infecciones bacterianas crónicas, como neumonía, otitis media y lesiones cutáneas.
Tratamiento odontológico
La revisión regular de la dentición en desarrollo, las encías y las mucosas, y la instauración de un programa preventivo son esenciales para el mantenimiento de unos tejidos duros y blandos sanos. La eliminación de todo potencial foco de infección durante el tratamiento médico es el objetivo a alcanzar.
La deficiencia subyacente ha de ser evaluada a fondo, al igual que la probabilidad de complicaciones orales que amenacen el estado clínico del niño. Se ha de realizar una valoración de riesgos y beneficios individualizada en el marco del plan de tratamiento global. La decisión de extraer o no un diente cariado o de proceder a la exfoliación del diente primario ha de basarse en la valoración de la peor de las situaciones posibles durante el período de inmunodeficiencia. Si no es posible estabilizar una caries mediante una restauración provisional, la extracción es la opción preferida. En caso de que el paciente se esté preparando para un trasplante de médula ósea, todos los dientes primarios móviles deben extraerse al menos 2 semanas antes de la fase de acondicionamiento.
El uso profiláctico de antimicrobianos para organismos orales comensales determinados por pruebas de cultivo y sensibilidad está indicado durante el tratamiento médico. Las muestras de biopsia ayudan a establecer el diagnóstico. El protocolo antimicrobiano puede incluir antibióticos (trihidrato de amoxicilina y ampicilina), aciclovir sódico en pacientes VHS-positivos, ganciclovir en citomegalovirus-positivos, antifúngicos (nistatina tópica y anfotericina B) y enjuagues con gluconato de clorhexidina al 0,2% dos veces al día durante la fase activa del tratamiento.
Para evitar la sepsis y las caries inducidas por radioterapia, antes de iniciar el tratamiento radioterápico de cabeza y cuello, también son convenientes el raspado dental y la profilaxis, así como la provisión de bandejas personalizadas para la administración de la medicación (antisépticos y fluoruro).
Síndrome de inmunodeficiencia adquirida (SIDA/VIH)
La infección por VIH se ha detectado en un número creciente de pacientes, en niños con deficiencia inmunitaria no explicada por otros motivos y con infecciones oportunistas del tipo de las registradas en adultos son SIDA. A efectos de vigilancia epidemiológica, los Centers for Disease Control (CDC) tipifican los casos de infección pediátrica por VIH como enfermedades diagnosticadas de forma fiable a niños que sean indicativas de una inmunodeficiencia celular subyacente al menos moderada, y para las que no se determinen otras causas subyacentes conocidas de inmunodeficiencia celular o de disminución de la resistencia.
Transmisión
Los principales medios de transmisión son fluidos corporales, como sangre o semen. La saliva contiene niveles bajos de VIH y es poco probable que se constituya en vector significativo de transmisión. En consecuencia, las dos principales vías de transmisión en niños son la vertical (a partir de una madre infectada) y la mediada por productos de la sangre, siendo los niños hemofílicos los expuestos a mayor riesgo. Las tasas de transmisión vertical son del orden del 39%, registrándose la misma antes, durante o después del nacimiento. La infección por lactancia materna se sitúa en torno al 29%.
Factores de riesgo
- Los factores de riesgo de infección pediátrica por VIH varían en función de los grupos de edad.
- La mayoría de los niños con SIDA tienen menos de 5 años de edad.
- Los principales factores de riesgo son perinatales.
- Los lactantes nacidos de madres consumidoras de drogas intravenosas o con parejas bisexuales forman el grupo más extenso.
- En torno a un tercio de los lactantes tienen un peso al nacer inferior a 2.500 g y son pequeños para su edad gestacional. De ellos, el 25-30% desarrollan SIDA en el primer año de vida.
- El patrón de presentación de la encefalopatía varía con la edad, y un importante déficit de desarrollo se registra en la primera infancia.
Serodiagnóstico y función inmunitaria
La prueba de detección selectiva de ELISA para anticuerpos del VIH puede dar lugar a falsos negativos, y los positivos han de ser confirmados mediante western blot. Los ensayos de antígenos son más fiables, aunque el hecho de no detectar virus o antígenos en un niño joven con anticuerpos no descarta la infección. La prueba positiva para virus o antígenos indica una probable infección. Dado el largo período de incubación y las limitaciones de la historia médica y el serodiagnóstico, debe presuponerse que todos los derivados sanguíneos pueden ser infecciosos.
El VIH se fija a la variante CD4 de los linfocitos T4 colaboradores y permanece en las células infectadas a lo largo de todo su ciclo vital, transmitiéndose a otras células por contacto con ellas. Entre las demás células afectadas en potencia se cuentan macrófagos y, posiblemente, células endoteliales, neurogliales, epiteliales y dendríticas. El principal efecto de la infección por VIH sobre el sistema inmunitario es la depleción de linfocitos CD4 (cola boradores), que determina una caída del recuento total de CD4 y la inversión de la relación CD4/CD8. Éstas constituyen una indicación de progresión de la enfermedad.
Manifestaciones orales
Las lesiones orales son a menudo indicios precoces de infección por VIH. Trastornos habituales pueden manifestarse de distintos modos en presencia del virus (fig. 10.6). En niños, las lesiones más habituales son las que se enumeran a continuación.
Candidiasis
La lesión oral más común en la infección por VIH es la candidiasis seudomembranosa aguda. Se trata de una lesión precoz que indica la presencia de otras infecciones oportunistas. La gravedad de la infección por Candida se vincula con la relación T4/T8 y con recuentos de CD4 inferiores a 300/ml. La candidiasis esofágica se produce cuando el recuento de CD4 cae por debajo de 100/ml. Las infecciones fúngicas se relacionan con reducción del flujo de saliva e IgA-S. Responden bien al tratamiento con antifúngicos sistémicos y mejora de la higiene oral.
Ulceración
Las infecciones recurrentes por herpes simple son frecuentes en localización intraoral o circumoral, aunque otras partes del cuerpo también se ven afectadas. Las úlceras, de tipo aftoso, son persistentes y muy frecuentes en niños. El tratamiento es paliativo, con hidratación y analgesia apropiadas.
Gingivitis atípica
La gingivitis relacionada con el VIH se manifiesta mediante eritema rojo de los tejidos gingivales y puede extenderse al borde gingival libre. Con frecuencia se registran hemorragias espontáneas en las encías y petequias en el margen gingival, localizadas o generalizadas. Ha de valorarse el componente fúngico. El tratamiento se basa en la mejora del cepillado y el uso del hilo dental y la aplicación diaria de colutorios y geles de gluconato de clorhexidina al 0,2%.
Hipertrofia de las glándulas salivales
La parotiditis afecta tanto a niños como a adultos y es similar a la presentación de las paperas. Puede ser uni o bilateral y produce xerostomia y dolor. La reducción del flujo salival es causa en ocasiones de candidiasis seudomembranosa y caries.
Leucoplasia pilosa
Se trata de una enfermedad infrecuente en niños, en los que sólo se han publicado unos pocos casos. Se manifiesta predominantemente en el borde lateral de la lengua y, a veces, en la mucosa oral y el paladar blando.
Periodontitis relacionada con VIH
La periodontitis relacionada con VIH se presenta con dolor profundo y hemorragia espontánea, necrosis y craterización interproximales y eritema intenso, más grave que el de la gingivitis ulcerativa necrosante aguda (GUNA). La periodontitis por VIH se da más frecuentemente en pacientes infectados con índices T4/T8 reducidos e infección oportunista sintomática. Organismos como Bacteroides pigmentados de negro y bacilos grampositivos, similares a los de la periodontitis del adulto, se han detectado en la relacionada con VIH.
Sarcoma de Kaposi
Infrecuente en niños y adolescentes. La lesión afecta sobre todo al paladar y también a encías y lengua. El tratamiento se basa en quimioterapia, radioterapia o escisión por láser.
Resultados
Es más frecuente la colonización primaria por comensales que la reactivación de infecciones oportunistas (las de citomegalovirus, la retinitis y la toxoplasmosis son raras). Las infecciones bacterianas son asimismo infrecuentes, aunque Streptococcus pneumoniae y Haemophilus influenzae pueden ser complicaciones respiratorias más comunes. Raro es también el sarcoma de Kaposi, mientras que se dan casos de linfoma (sobre todo con afectación del sistema nervioso central [SNC]). La progresión de la enfermedad es variable y, en muchos casos, no se presentan síntomas orales o físicos durante años después de que se produzca la infección. La neumonitis intersticial linfocítica es causa frecuente de muerte en niños con SIDA, aunque a menudo resulta asintomática. Se han registrado importantes avances en el tratamiento antirretroviral del SIDAA/IH, por lo que muchos niños infectados desarrollan en la actualidad una vida normal.
Oncología
El cáncer infantil supone en torno a un 1% de los casos totales de cáncer en la población. En Australia, la incidencia anual de tumores malignos en niños de menos de 15 años es de 11 por cada 100.00 niños. De 600 a 700 niños, desde el nacimiento a los 15 años, desarrollan cáncer cada año. Mientras que la mayoría de los tumores de adultos son carcinomas con fuertes asociaciones etiológicas, los infantiles conforman un amplio espectro de tipos histológicos distintos, con menor correlación etiológica.
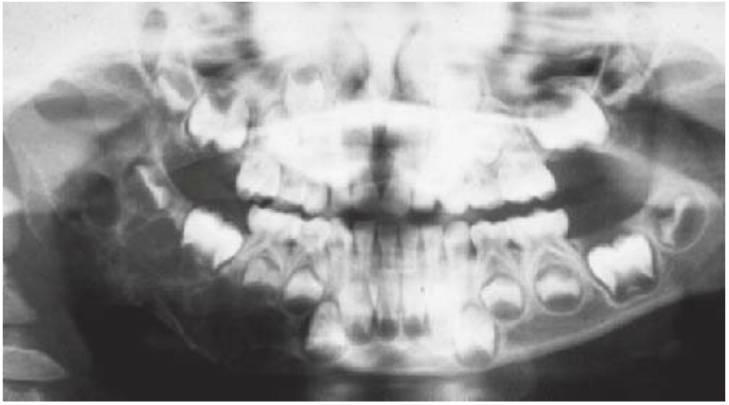
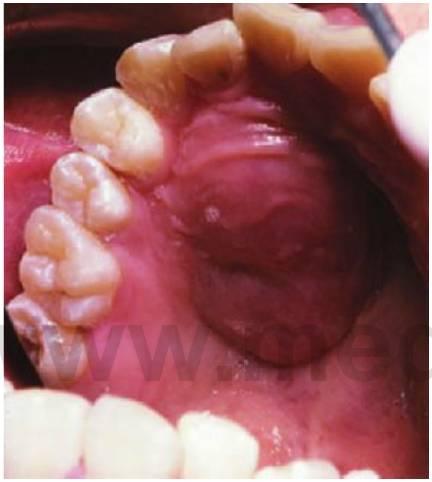
La incidencia, tanto del cáncer infantil en conjunto como de los diversos tipos, varía poco de un país a otro y ningún grupo racial se ve exento de la enfermedad. Entre más de 50 tipos de cáncer infantil, los más comunes son leucemias, linfomas, tumores del SNC, sarcomas primarios de hueso (fig. 10.7A) y tejidos blandos, tumores de Wilms, neuroblastomas y retinoblastomas. Las leucemias agudas y los tumores del SNC son responsables de en torno a la mitad de las neoplasias malignas infantiles. Los tratamientos multimodales (quimioterapia, radioterapia y cirugía) han dado lugar a una supervivencia a 5 años en casos de cáncer infantil del orden del 70%.
Leucemia
La leucemia comprende un grupo heterogéneo de neoplasias malignas hematológicas causadas por proliferación clonal de leucocitos primitivos.
Leucemia linfoblástica aguda (LLA)
- Responsable del 80-85% de las leucemias agudas infantiles.
- Definida por la presencia de más de un 25% de linfoblastos en médula ósea.
- El tratamiento se ajusta al riesgo de recidiva en función de los marcadores citogenéticos, e incluye una combinación de quimioterapia de inducción, profilaxis del SNC y quimioterapia de mantenimiento durante unos 2 años.
- El tratamiento intratecal (generalmente con metotrexato) se ha empleado en sus titución de la irradiación craneal.
- Las tasas de curación de la LLA de riesgo estándar son del 90-92% según los protocolos actuales. Cuando se dan recidivas, el 40-50% de los casos curan con quimioterapia y/o trasplante de células madre hematopoyéticas.
- El pronóstico depende de la edad de presentación, el recuento leucocitario inicial, las alteraciones citogenéticas y otras variables.
- El trasplante de médula ósea se reserva para casos de alto riesgo o recidiva.
Leucemia mieloide aguda (LMA)
- Responsable del 15-20% de las leucemias infantiles agudas.
- En esta enfermedad, la médula ósea está infiltrada con células mieloides primitivas, clasificadas en función de su morfología (subtipos FAB M1-M7). Los signos clínicos de LMA son similares a los de otras leucemias.
- La LMA con morfología monocítica (M4/M5) puede presentar infiltración gingival, mientras que la morfología promielocítica (M3) se asocia a coagulación intravascular diseminada.
- El tratamiento con quimioterapia de inducción va seguido con frecuencia de trasplante alogénico de médula ósea en pacientes de alto riesgo.
- Con los tratamientos actuales, la tasa de curación es de aproximadamente el 60%.
Leucemia mieloide crónica (LMC)
- Infrecuente en niños y responsable de menos del 5% de los casos de leucemia.
- Dos tipos; uno idéntico a la LMC de adultos y caracterizado por la presencia del cromosoma Philadelphia (Ph) en células malignas; el segundo, o forma juvenil (LMCJ), se produce en una fase más temprana de la infancia, con evolución más rápida, infección, hemorragia y bajas tasas de supervivencia.
- El aspirado de médula ósea pone de manifiesto proliferación granulocítica sin exceso de linfoblastos.
- Actualmente, la fase crónica de la enfermedad se trata de forma eficaz con inhibidores específicos de la brc-abl tirosina cinasa (imatinib o dasatinib), que pueden generar una remisión que se prolonga durante años.
- El trasplante alogénico de médula ósea continúa siendo el único tratamiento curativo definitivo, aunque se suele reservar para pacientes con recidiva tratados con tirosina cinasa, o para niños con un hermano HLA idéntico.
Características clínicas de la leucemia infantil
- Fatiga y pérdida de peso.
- Anemia.
- Púrpura.
- Infecciones y episodios febriles sin explicación.
- Hepatoesplenomegalia y linfadenopatía significativas.
Investigaciones
- El HC muestra anemia, neutropenia, trombocitopenia y leucocitosis con linfoblastos circulantes.
- Se requiere aspirado de médula ósea para confirmar el diagnóstico.
- La punción lumbar permite descartar la afectación del SNC.
Problemas del tratamiento médico
Los principales problemas del tratamiento médico son la supresión de médula ósea en la fase diagnóstica inicial por infiltración maligna, y después, por la quimioterapia, anemia, infección y ulceración y hemorragia en las mucosas. La infección en niños inmunocomprometidos supone un riesgo para la vida del paciente, y puede ser causada por bacterias, virus, hongos o parásitos. Suele ser necesario un tratamiento triple, con antibióticos de amplio espectro. Las recidivas se dan en médula, SNC y otras localizaciones (testículos).
Tumores sólidos en la infancia
Tumores cerebrales
- Son los tumores sólidos infantiles más habituales.
- Aproximadamente un 70% son gliomas, sobre todo astrocitomas de grado bajo o meduloblastomas.
- Más del 50% de los tumores intracraneales se registran en la región de la fosa craneal posterior. El enfoque estándar del tratamiento es la escisión quirúrgica combinada, si es posible, con quimioterapia y radioterapia.
- La quimioterapia puede utilizarse para retrasar la radioterapia craneal en lactantes.
- La tasa de supervivencia total a 10 años es del 60%.
Linfoma no Hodgkin
- Se desarrolla a partir de linfocitos B o T neoplásicos en ganglios linfáticos y tejido linforreticular (fig. 10.7B).
- El tumor primario puede localizarse en el abdomen (células B) o el mediastino (células T).
- La dispersión del tumor es local, o bien a la médula ósea y el SNC.
- La principal modalidad de tratamiento es la quimioterapia.
- La tasa de curación de tumores localizados es del 90%.
Tumor de Wilms
- Se desarrolla en el riñón a los 3-4 años de edad.
- Suele presentarse como una masa abdominal asintomática.
- A menudo asociado a aniridia y otras anomalías congénitas.
- El tumor responde bien a la terapia combinada: quimioterapia, con o sin radioterapia, para reducir la masa tumoral y escisión quirúrgica, dependiendo de la fase de la enfermedad. Suelen generarse metástasis renales, hepáticas y esqueléticas.
Neuroblastoma
- Se desarrolla a partir de células de la cresta neural en cualquier punto de la cadena simpática.
- La localización más frecuente es la abdominal, en glándulas suprarrenales o ganglios paraespinales. Otras localizaciones son el tórax, el cuello o la pelvis.
- El tumor se extiende a ganglios linfáticos, médula ósea, hígado y tejidos subcutáneos.
- El diagnóstico se confirma por niveles elevados de catecolaminas urinarias y biopsia tisular.
- El pronóstico depende de la edad del paciente en el momento del diagnóstico, el estadio del tumor y sus características biológicas, en especial la presencia de amplificación del gen n-myc. Los niños con enfermedad de alto riesgo (en torno al 50% de los casos) presentan tasas de supervivencia del 25%, incluso con quimioterapia agresiva, cirugía, irradiación y trasplante autólogo de médula ósea.
Rabdomiosarcoma
- Se desarrolla a partir de tejido mesenquimático embrionario con potencial de diferenciación para formar el músculo esquelético (estriado).
- Los niños a menudo se presentan con una masa subcutánea de expansión rápida, no dolorosa y que puede localizarse prácticamente en cualquier parte del cuerpo.
- Localizaciones habituales son cabeza y cuello, tracto genitourinario y extremidades.
- Las lesiones grandes de cabeza y cuello invaden el hueso y las lesiones mandibulares son comunes en casos avanzados.
- El tratamiento incluye cirugía con quimioterapia y radioterapia adyuvantes.
- El pronóstico se ve influido por la localización y el subtipo del rabdomiosarcoma, así como por su estadio en el momento del diagnóstico.
Enfermedad de Hodgkin
- Neoplasia maligna linfoide caracterizada por la presencia de células de Reed- Sternberg en el tumor.
- Suele afectar a adolescentes y adultos jóvenes.
- La presentación más frecuente es la hipertrofia indolora de los ganglios linfáticos cervicales inferiores o mediastínicos, con fiebre y pérdida de peso de origen desconocido.
- Excelente respuesta a la quimioterapia (tasas de curación del 90% en fases tempranas de la enfermedad).
- A menudo se necesita radioterapia para los casos de enfermedad avanzada.
Retinoblastoma
- Tumor de los retinoblastos en niños de menos de 5 años de edad.
- Fuerte componente hereditario.
- El diagnóstico se establece por la existencia de un reflejo pupilar blanco o amarillo (normalmente rojo).
- El tratamiento requiere con frecuencia la enucleación del globo ocular y radioterapia postoperatoria. Ocasionalmente es necesaria quimioterapia complementaria.
Osteosarcoma
- Tumor poco frecuente de hueso, generalmente en la región metafisaria de los huesos largos, siendo el fémur distal la localización más común.
- Los adolescentes son el grupo de edad más afectado.
- Frecuentemente metastatiza en pulmón, lo que requiere una amplia resección del tumor primario complementada con quimioterapia multiagente.
Sarcoma de Ewing
- Tumor maligno de hueso propio de los adolescentes, que suele afectar a la diáfisis media de los huesos largos, aunque cualquier hueso puede verse afectado.
- Más habitual en fémur proximal o pelvis y caracterizado por la presencia de pequeñas células redondeadas densamente concentradas.
- El tratamiento se basa en cirugía, quimioterapia e irradiación local.
- El pronóstico empeora en la enfermedad primaria pélvica y en la metastatizada.
Histiocitosis de células de Langerhans
- Neoplasia infrecuente similar a la LLA, que a menudo se presenta con exantema eczematoso y purpúreo en manos, cuero cabelludo y tronco.
- Pueden producirse lesiones osteolíticas en cráneo y mandíbula y se han referido casos de exfoliación prematura de los dientes primarios.
- El pronóstico depende de la extensión de la enfermedad en el momento del diagnóstico y la progresión de las lesiones.
Tratamiento odontológico
La estrecha colaboración entre el oncólogo y el odontólogo del niño es esencial en la planificación de una asistencia dental apropiada. En el momento del diagnóstico y durante las fases iniciales de la quimioterapia, la asistencia odontológica debe prestarse en el hospi tal. Una vez que el niño ha experimentado una remisión de la enfermedad, o cuando ha concluido con éxito la quimioterapia, el tratamiento odontológico se puede aplicar en la consulta del dentista.
Es fundamental que, en cooperación con el equipo oncológico, se establezca si el tratamiento odontológico es necesario antes de la quimioterapia o durante la misma. Si han de realizarse extracciones, debe obtenerse un HC con diferencial leucocitario y plaquetario. Si el recuento de plaquetas es inferior a 30x109/l, está indicada la infusión de plaquetas y agentes antifibrinolíticos (en dosis similares a las usadas para los trastornos hemostáticos). Como en niños inmunocomprometidos, cuando el recuento de neutrófilos es inferior a 1 ,8 x 1 0 9/I, ha de administrarse profilaxis antibacteriana específica. Dado que numerosos niños han sido tratados con corticoides sistémicos, la posibilidad de supresión suprarrenal puede considerase como medio de cobertura esteroidea adicional, según las necesidades.
El tratamiento dental no urgente debe retrasarse hasta que el niño esté en fase de remisión o de quimioterapia de mantenimiento. Los casos en los que la remisión sea completa pueden recibir un tratamiento odontológico normal, aunque es prudente obtener un HC si se prevé aplicar técnicas invasivas. El tratamiento pulpar de dientes primarios durante las fases de inducción y consolidación de la quimioterapia está contraindicado. Si es necesario proceder a tratamiento pulpar de dientes permanentes, el riesgo de bacteriemia y posible septicemia ha de ser sopesado frente a los potenciales beneficios.
Higiene y prevención orales
Es importante mantener una meticulosa higiene oral con un cepillo dental blando durante la quimioterapia. Los enjuagues con colutorio o gel de gluconato de clorhexidina al 0,2% cuatro veces al día ayudan a disminuir los síntomas de mucositis, y los agentes antifúngicos (nistatina o fluconazol) sirven para prevenir la candidiasis durante la inmunosupresión. El clorhidrato de lidocaína tópico, aplicado antes de comer (si es posible) o de beber, resulta de utilidad en los episodios agudos de mucositis. Cuando estén indicados, los antibióticos parenterales profilácticos y los fármacos antivirales se administran durante los episodios febriles y en los períodos de neutropenia grave, a fin de prevenir otras complicaciones médicas.
Efectos orodentales inmediatos de la neoplasia infantil y su tratamiento
Los espectaculares avances registrados en la terapéutica del cáncer infantil en las últimas tres décadas han hecho que el 70% de los casos diagnosticados se curen a largo plazo. Uno de cada 600 niños desarrolla cáncer antes de los 15 años de edad y 1 de cada 1.000 adultos jóvenes es superviviente a largo plazo de un cáncer infantil.
A medida que aumenta el número de supervivientes en diversos tipos de cánceres pediátricos, las secuelas orodentales de los tratamientos médicos eficaces en estos pacientes van saliendo a la luz. Tales efectos son singulares, debido al deterioro del crecimiento activo y el desarrollo durante el tratamiento oncológico. Las secuelas adversas inducidas por el tratamiento anticanceroso pueden ser postoperatorias o posteriores a la radioterapia o la quimioterapia, o bien combinadas.
Secuelas postoperatorias
La extirpación quirúrgica de un tumor sólido en la cavidad oral puede causar:
- Desfiguración (temporal o permanente) (fig. 10.8A).
- Pérdida de dientes y su función.
- Estenosis y parestesia.
Secuelas subsiguientes a radioterapia
La radioterapia produce una inflamación inicial de la mucosa, a menudo seguida de necrosis y ulceración (mucositis). El alcance de la inflamación depende de la extensión y la localización de la radioterapia y de si se emplea dosificación fraccionada o completa. Los síntomas más frecuentes de la irradiación craneal son dolor oral y dificultad para comer y beber, más intensos durante los 10-14 primeros días de radioterapia. La mucositis suele remitir a las 2-3 semanas de irradiación.
Cuando la radioterapia afecta a las glándulas salivales mayores, es frecuente que en pocos días se desarrolle xerostomia, con producción de saliva viscosa y ácida. También se registran pérdida o alteración del sabor, lo que a veces hace que el paciente pase a una dieta más blanda, y más cariogénica, para evitar la sensibilidad dolorosa y la sequedad en la cavidad oral. Ello es probablemente el principal factor etiológico del rápido desarrollo de caries que se ha comunicado en estos pacientes cuando no son sometidos a la pertinente higiene preventiva. La caries inducida por irradiación presenta un patrón cervical generalizado diferenciado y, en ocasiones, la dentición completa es destruida en un plazo relativamente breve (fig. 10.8B).
La endarteritis progresiva es una complicación que se presenta en el hueso irradiado y que deriva a veces a osteorradionecrosis. La mandíbula es particularmente propensa a desarrollar esta complicación y, cuando esta área de hueso muerto se infecta después de una extracción dental, puede desarrollarse a continuación una osteomielitis refractaria. La endarteritis también causa fibrosis de los músculos masticatorios y trismo.
Quimioterapia
Los fármacos citotóxicos aplicados en quimioterapia causan daño en diversos órganos:
- Hígado.
- Riñón.
- Intestino.
- Células germinales de testículos y ovarios.
- Pulmón.
- Corazón.
- Cerebro.
La estomatotoxicidad directa es producida por la acción citotóxica de los agentes quimioterápicos sobre las células de la mucosa oral, dando lugar a inflamación, adelgazamiento y ulceración de la mucosa (mucositis). La función salival puede también verse reducida, aun que esta reacción no se ha comunicado con frecuencia en niños. Este tipo de problemas son frecuentes en las fases de inducción y consolidación de la quimioterapia, cuando se emplean dosis relativamente altas de terapia multiagente. Recientes informes indican que la incidencia y gravedad de la estomatotoxicidad se reduce con administración concomitante de factor estimulante de colonias granulocíticas (FECD) durante la quimioterapia.
Los efectos de quimio y radioterapia parecen ser sinérgicos. Dado que el desarrollo craneofacial y dental no se completa hasta la adolescencia, no es sorprendente que se registren efectos dentales tardíos en personas que sobreviven a un cáncer infantil. Los problemas de los tejidos afectados dan lugar a deterioro del crecimiento y el desarrollo de tejidos duros y blandos, lo que en ocasiones es causa de asimetría orofacial, xerostomia, caries, trismo y diversas anomalías dentales. En general, la naturaleza y grado de estas complicaciones varía ampliamente y depende de distintos factores, como el tipo y localización de la neoplasia, la edad del paciente, la dosis y momento de la aplicación de la quimioterapia, el estado dental previo y el nivel de cuidados dentales antes, durante y después de la quimioterapia.
Efectos orodentales tardíos de la neoplasia infantil y su tratamiento
La mayoría de los niños en los que el tratamiento oncológico induce una remisión estable tiene perspectivas de desarrollar una vida saludable. Es posible la recidiva, aunque la probabilidad de que ésta se presente es cada vez más remota a medida que pasa el tiempo. En consecuencia, a los pacientes oncológicos pediátricos tratados con éxito nunca se les da el alta, ya que se les controla regularmente a lo largo de su vida.
A excepción de aquellos niños tratados con radioterapia en la región orofacial, la mayoría no presenta mayor propensión a las enfermedades dentales y periodontales que los niños sanos, y con frecuencia mantienen una salud oral excelente. No obstante, los efectos oroden tales a largo plazo de la radioterapia influyen a veces en el tratamiento odontológico (fig. 10.9).
Trastornos del crecimiento
Tras la aplicación de radioterapia de cabeza y cuello, el crecimiento facial puede deteriorarse, con las consiguientes alteraciones dentales. Los niños de menos de 5 años de edad se ven más afectados que los de más edad. Un patrón de crecimiento craneofacial alterado, con disminución del crecimiento mandibular, a veces se asocia a un campo de irradiación que incluye una porción del ramo ascendente y todo el cóndilo de la mandíbula. Entre los efectos dentales se cuentan:
- Calcificación incompleta.
- Hipoplasia del esmalte.
- Desarrollo de las raíces interrumpido o alterado y cierre prematuro de los ápices de las raíces, lo que puede complicar el desarrollo de los dientes permanentes.
- Microdontia y agenesia dental, también frecuentes.
La naturaleza y extensión de la lesión dependen de la fase de desarrollo dental y del momento y dosis de la irradiación. La falta de especificidad de los agentes citotóxicos en términos de diferenciación de células neoplásicas de las células normales metabólicamente activas, como ameloblastos u odontoblastos, puede generar anomalías del desarrollo dental. Microdontia, cámaras pulpares agrandadas, acortamiento, adelgazamiento o despuntamiento del ápice radicular y retraso en la erupción dental se han comunicado con frecuencia en niños tratados con quimioterapia. Varios estudios han referido, asimismo, opacidades en el esmalte, hipocalcificación y tasas elevadas de caries, aunque no se sabe con certeza si estos hallazgos se deben a alteración directa de la formación y maduración del esmalte o a modificaciones en el medio oral (saliva y flora), a la dieta y los cuidados dentales domésticos de los pacientes jóvenes, o a la propia quimioterapia.
Xerostomia
La irradiación craneal puede dañar irreversiblemente las células acinares de las glándulas salivales mayores, con el consiguiente desarrollo de xerostomia en niños. Si la dosis de radiación es baja, esta alteración es a menudo transitoria, dada la elevada capacidad regenerativa de las células exocrinas de los niños. En general, la incidencia de la caries dental inducida por radiación es mayor en adultos que en niños. El enjuague diario con fluoruro es necesario para evitar la desmineralización del esmalte durante este crítico período.
Otros efectos menos frecuentes
Entre los cambios epidérmicos y mucosos se cuentan hiperpigmentación y telangiectasias cutáneas, atrofia del tejido subcutáneo y debilitamiento o pérdida del pelo. Tras irradiación craneal se han comunicado también casos de trastornos en el desarrollo intelectual, endocrino y de células germinales. En cambio, la edad media de maduración dental en niños sometidos a irradiación craneal se mantiene en niveles normales.
Dado que la mayor parte de los tumores craneofaciales se tratan con quimioterapia y radioterapia de cabeza y cuello combinadas, es difícil saber cuáles son los efectos de cada tratamiento. En general, los efectos orodentales tardíos son más graves en pacientes que reciben dosis altas de quimio o radioterapia. Las aberraciones dentales son más graves y extensas en pacientes menores de 6 años, debido al desarrollo inmaduro de los dientes permanentes. La irradiación de todo el cuerpo en trasplantes de médula ósea parece aumentar el riesgo de trastornos del desarrollo dental.
Complicaciones asociadas al trasplante de médula ósea
Casi todos los niños sometidos a trasplante de médula ósea desarrollan cambios característicos de la mucosa oral, con ulceración, queratinización y eritema. Todos ellos tienden a ser máximos a los 4-14 días del trasplante. También la atrofia de la mucosa se asocia con frecuencia a ulceración, de 1 a 3 semanas después del trasplante. En este período, el dolor oral es a veces intenso, por lo que numerosos pacientes requieren analgesia con narcóticos. Se ha demostrado que el uso de factor de crecimiento de queratinocitos (palifermina) reduce esta complicación en adultos sometidos a trasplante autólogo, y se están realizando estudios pediátricos sobre este prometedor tratamiento.
Como se indicó anteriormente, las infecciones orales por Candida albicans, herpes simple, citomegalovirus y varicela zóster son las más frecuentes en niños sometidos a trasplante de médula ósea cuando no se aplica una profilaxis adecuada. Si no son tratadas agresivamente en el momento del diagnóstico, estas afecciones ponen en peligro la vida del paciente.
Las manifestaciones orales de una hemostasia deficiente son habituales, aunque rara vez son graves, y entre ellas se cuentan hemorragia de las mucosas, costras en los labios y exudado gingival.
Enfermedad injerto contra huésped (EICH)
Este cuadro se presenta cuando las células T trasplantadas reconocen como extraños los tejidos del huésped. La EICH es un problema importante en el trasplante de médula ósea y da lugar a manifestaciones clínicas hasta en la mitad de los pacientes trasplantados. La forma aguda de EICH tiende a aparecer unas semanas después del trasplante, con fiebre, exantema, diarrea y disfunción hepática que causa ictericia. La EICH crónica se suele presentar unos meses más tarde y se caracteriza por cambios cutáneos liquenoides o similares a la esclerodermia, queratogingivitis, disfunción hepática, insuficiencia pulmonar y problemas intestinales. Las manifestaciones orales de la EICH varían según la gravedad del proceso y a menudo incluyen:
- Eritema leve de la mucosa oral.
- Gingivitis descamativa dolorosa.
- Queilitis angular.
- Pérdida de papilas linguales.
- Parches liquenoides en la mucosa oral.
- Estrías en la mucosa oral.
- Xerostomia.
El tratamiento de la EICH crónica requiere un enfoque multidisciplinar. A menudo es necesaria inmunosupresión sistémica a largo plazo con prednisona. Tratamientos tópicos, como los enjuagues con dexametasona, son a veces eficaces. Para que los resultados terapéuticos sean los esperados se ha de proceder a una cuidadosa atención a la salud oral manteniendo una estrecha comunicación con el equipo médico.
Nefrología
Trastornos renales
Las enfermedades renales se diferencian en agudas, crónicas, adquiridas o congénitas.
Insuficiencia renal aguda
- Da lugar a la aparición súbita de deterioro de la función y la perfusión renales.
- Puede ser subsiguiente a septicemia, deshidratación, quemaduras graves y pérdida de sangre, glomerulonefritis, pielonefritis, lisis tumoral y obstrucción ureteral.
Enfermedad renal crónica
Las afecciones crónicas de los riñones más comunes son:
- Reflujo ureteral causante de nefropatía por reflujo e hipoplasia.
- Uropatía obstructiva.
- Glomerulosclerosis.
- Enfermedad quística medular.
- Lupus eritematoso sistémico.
- Cistinosis.
Insuficiencia renal terminal
- Da lugar a una caída progresiva de la tasa de filtración glomerular causante de hipertensión, retención de líquidos y acumulación de metabolitos no excretados con normalidad.
- El tratamiento médico se orienta a la prevención de los desequilibrios líquidos y electrolíticos, la restricción de la proteinuria, la corrección de la hipoalbuminemia, la hipocalcemia y la hiperfosfatemia y el control de la anemia y la hipertensión.
- En niños con insuficiencia renal grave, el tratamiento farmacológico es a menudo inadecuado, por lo que se hace necesaria la filtración artificial por diálisis peritoneal o hemodiálisis.
Afecciones adquiridas
- Infecciones del tracto urinario, generalmente por bacterias coliformes procedentes del intestino, y cistitis (infección de la vejiga).
- La glomerulonefritis aguda suele acompañar a las infecciones estreptocócicas (3-hemolíticas y remite con antibioterapia en la mayoría de los niños. No obstante, un 3-4% de los casos desarrollan insuficiencia renal crónica postinfección y suelen requerir diálisis.
Las complicaciones médicas se evitan con un trasplante renal, que es el tratamiento de elección en niños con insuficiencia renal terminal. A pesar de la limitada disponibilidad de órganos de donantes, el trasplante renal alcanza una elevada tasa de éxito. Las compli caciones asociadas a la inmunosupresión con ciclosporina y prednisona para prevenir el rechazo del órgano deben ser tenidas en cuenta en el tratamiento odontológico. Las manifestaciones orales más habituales después de un trasplante renal son la hiperplasia gingival (fig. 10.10B) y la infección oportunista por flora comensal.
Consecuencias odontológicas
El deterioro de la función renal da lugar a varias manifestaciones orales, tales como:
- Estomatitis urémica.
- Ulceración oral.
- Tinción dental intrínseca y extrínseca.
- Cálculo supragingival excesivo.
- Hipoplasia e hipocalcificación del esmalte.
- Retraso del desarrollo dental.
La estomatitis urémica puede desarrollarse cuando el nivel sérico de urea es superior a 300mg/ml. Presenta formas ulcerosas y no ulcerosas, que afectan predominantemente a la lengua y la mucosa oral. Ambas aumentan la tendencia a la hemorragia y son susceptibles de infección secundaria por organismos comensales.
Osteodistrofia renal
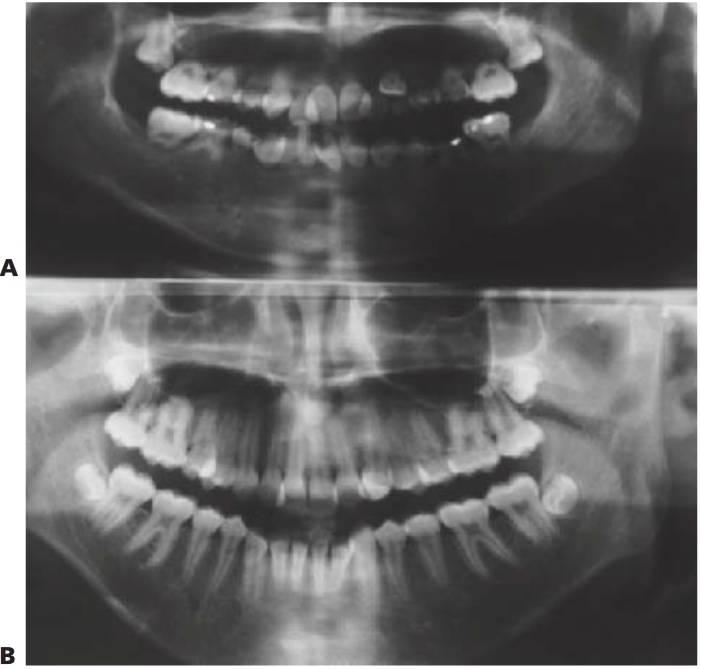
Las lesiones líticas de la mandíbula o el maxilar superior, conocidas como tumores de Brown, se dan a veces en casos de insuficiencia renal causada por hiperparatiroidismo secundario. Histológicamente, estas lesiones son similares a los tumores de células gigantes y suelen remitir tras la corrección de la hipocalcemia y la hiperfosfatemia con metabolitos de la vitamina D. La hipocalcemia es debida a un aumento en la retención de fosfato y reducción de la absorción de caldo. La absorción activa de calcio en el intestino depende de la presencia del metabolito activo 25-hidroxi-colecalciferol (vitamina D3). Sin embargo, el metabolismo de la vitamina D se ve deteriorado por la insuficiente hidroxilación del 25-hidroxi-colecalciferol a 1,25-dihidroxi-colecalciferol en el riñón enfermo. Al intentar elevar el calcio sérico se origina un hiperparatiroidismo secundario y el calcio es obtenido de las reservas óseas, dando lugar al característico patrón radiológico de osteodistrofia renal (fig. 10.9A).
Tratamiento odontológico
Los cambios observados en los dientes dependen del momento de aparición de la enfermedad renal. Los dientes calcificados en el curso de la insuficiencia renal presentan hipoplasia o hipomineralización del esmalte y la dentina. Los dientes en desarrollo aparecen con frecuencia teñidos de verde o marrón, debido a la incorporación de productos de la sangre, como bilirrubina no conjugada o hemosiderina, respectivamente. En estos niños las caries son a menudo mínimas, probablemente por la presencia de metabolitos de la urea en la saliva, en tanto que la formación de cálculo supragingival está en cambio incrementada, incluso cuando la higiene oral es adecuada.
- La consulta con un nefrólogo se hace a menudo necesaria antes de la aplicación del tratamiento odontológico a estos niños.
- En niños con trastornos renales agudos, el tratamiento odontológico no urgente debe posponerse hasta el restablecimiento de la función renal.
- La asistencia odontológica de urgencia o paliativa sólo está indicada después de una valoración selectiva previa al tratamiento de la elevación del tiempo de hemorragia o el UPA.
- La extracción de dientes primarios con afectación pulpar es la opción terapéutica preferida, debido al riesgo de bacteriemia tras pulpotomía o pulpectomía.
- Los pacientes sintomáticos con proteinuria o sometidos a tratamiento con esteroides a largo plazo se manejan mejor en un entorno hospitalario, donde la presión arterial y el equi libro líquido pueden ser monitorizados antes del tratamiento. En estos niños, los líquidos y electrólitos son ajustados por el nefrólogo, y se pueden administrar suplementos de este roides antes de la anestesia general o de una intervención odontológica de alcance.
Diálisis
Los niños sometidos a diálisis se presentan a menudo con retraso del crecimiento somático, palidez y anemia. También tienen tendencia a la hemorragia, debido al aumento de la fragilidad capilar y la trombocitopenia. Además, los niños en hemodiálisis reciben anticoagulación con heparina intravenosa y pueden experimentar otras complicaciones, como infección del sitio de inserción de la vía y riesgo aumentado de hepatitis. En niños sometidos a diálisis peritoneal, pueden producirse complicaciones causadas por la implantación del catéter, como peritonitis o infecciones en el sitio de salida. Sin embargo, la diálisis peritoneal es más fácil de manejar en niños, requiere menos tiempo para el intercambio de líquidos y menos limitaciones en la ingesta de alimentos sólidos y líquidos, y causa menos problemas hemodinámicos que la hemodiálisis.
- Los niños en hemodiálisis y tratamiento anticoagulante reciben DDAVP antes del tratamiento con profilaxis antibiótica para prevenir la infección a través del dispositivo de acceso.
- Cualquier tratamiento odontológico, en especial las extracciones, ha de realizarse un día después de la diálisis, cuando la heparina ya no está activa (su semivida es de 4 horas, aunque presenta efectos residuales durante 24).
- Los alveolos han de taponarse con un agente hemostático y suturarse bien. Si es posible, conviene evitar la transfusión de plaquetas.
- Los niños en diálisis peritoneal ambulatoria continua pueden tratarse de forma más consen/adora.
Interacciones farmacológicas
Las interacciones farmacológicas afectan a los niños con insuficiencia renal terminal que son tratados con antihipertensivos y esteroides. Los fármacos que se metabolizan en el riñón o son nefrotóxicos han de evitarse en niños con insuficiencia renal. Entre ellos se cuentan:
- Cefalotina.
- Paracetamol.
- Anti inflamatorios no esteroideos.
- Tetracidinas.
Los dentistas han de ser conscientes, por otra parte, de que la excreción renal de los fármacos también está deteriorada y que su semivida puede prolongarse más de lo habitual. No obstante, cuando los niños están adecuadamente hemodializados, es posible que sea necesario aumentar la dosis de los fármacos para obtener el efecto deseado. El ajuste de la dosis y el momento de la toma del fármaco han de establecerse de acuerdo con el nefrólogo del niño.
Trasplante renal
La valoración odontológica previa al trasplante es esencial para reducir el riesgo de complicaciones orales tras el trasplante y la inmunosupresión. La presencia de caries e infecciones orales hace que el trasplante deba retrasarse hasta que se hayan eliminado los potenciales focos de infección. Un tratamiento odontológico integral y el establecimiento de un riguroso programa de prevención son siempre recomendables antes de proceder al trasplante, de modo que se reduzca el riesgo de enfermedad oral subsiguiente. La profilaxis antibiótica conforme al protocolo de prevención de endocarditis infecciosa es esencial antes de practicar técnicas quirúrgicas invasivas.
Gastroenterología
Trastornos hepáticos y biliares
Atresia biliar
Esta afección causa una obstrucción o hipoplasia de las vías biliares, que inducen cirrosis biliar e hipertensión portal. Los casos graves se tratan mediante trasplante.
Déficit de α1-antitripsina
- Déficit de secreción hepática de α1-globulina.
- Produce hepatomegalia y cirrosis progresivas.
- Se trata mediante trasplante hepático.
Pruebas de función hepática
- Se han de obtener de forma sistemática hemograma completo y perfil de coagulación.
- Alanina aminotransferasa (ALT): 7-47 U/l.
- Fosfatasa alcalina: 60-391 U/l.
- γ-glutamil transpeptidasa: 5-43 U/l.
- Bilirrubina total.
- Albúmina (su disminución indica deterioro de la síntesis proteica).
Consecuencias odontológicas
Los problemas de coagulación han de vigilarse estrechamente, dada la disminución en la producción de factores de coagulación dependientes de la vitamina K (II, VII, IX, X).
Los pacientes están inmunocomprometidos. Los niños suelen presentar anemia leve debida a la destrucción de eritrocitos. Los productos de degradación eritrocitaria circulantes pueden incorporarse al esmalte en desarrollo. Los niveles altos de bilirrubina no conjugada inducen tinción verdosa de ese esmalte en formación.
Tratamiento odontológico
- Se debe consultar con los especialistas en gastroenterología y hematología que tratan al niño.
- Tratamiento agresivo de las caries con extracción de dientes sospechosos, en especial antes de un trasplante.
- Las coagulopatías suelen tratarse con plasma fresco congelado para reponer los facto res de coagulación deficitarios.
- Es necesaria antibioterapia profiláctica.
Hepatitis A (hepatitis infecciosa)
El período de transmisión es muy corto (3 semanas). El punto más importante a considerar es que no hay estado portador. En pacientes con hepatitis A positivos en tratamiento ha de retrasarse al menos 4 semanas.
Hepatitis B (hepatitis sérica)
Interpretación de los resultados de las pruebas de la hepatitis B
- Si la prueba de HBsAg es positiva, la sangre es automáticamente analizada para detectar el antígeno «e». Si es negativa, el paciente es un portador crónico sano.
- Cuando el antígeno «e» es positivo, el paciente es portador crónico activo.
Portador crónico sano (HBsAg + ve, e -ve)
- El grado de infectividad de estos pacientes, aunque significativo, se cree que es menor que el de los portadores crónicos activos. Sus pruebas de función hepática deben ser normales.
Portador crónico activo (HBsAg + ve, e +ve)
- El portador crónico activo manifiesta replicación vírica activa y es muy infeccioso. Padece enfermedad hepática activa y su función hepática suele ser anómala.
- Es importante ponerse en contacto directamente con el médico del paciente para planificar el tratamiento odontológico, y que este contacto sea periódico cuando el paciente reciba asistencia en la unidad odontológica.
Pruebas de función hepática
Son útiles en portadores crónicos activos. Las pruebas de función hepática han de ser tomadas en consideración también en portadores crónicos sanos (HBsAg -i-ve, e -ve) cuando han sido diagnosticados hace poco tiempo o cuando se han convertido en HBsAg negativos recientemente, o bien en caso de que se hayan recuperado hace poco de una hepatitis A.
Hepatitis C (no A no B)
El virus de la hepatitis C (VHC) es el causante de lo que antes se denominaba hepatitis no A no B. Los pacientes con anticuerpos contra el VHC son portadores crónicos potencialmente infecciosos. Suelen ser asintomáticos, aunque sus enzimas hepáticas presentan inter mitentemente valores anómalos. El virus se transmite a través de la sangre o de productos sanguíneos. No obstante, la reacción en cadena de la polimerasa (PCR) permite detectarlos en la saliva de los portadores.
Trasplante de hígado
Los niños con enfermedad hepática terminal y diagnóstico dudoso son buenos candidatos al trasplante de hígado. Por desgracia, el número de órganos de donantes es muy escaso y son muchos los niños que no sobreviven a la enfermedad, al no hallar un donante a tiempo. Una completa evaluación oral y radiográfica es esencial antes de proceder al trasplante. Cualquier potencial foco de infección oral, incluyendo la exfoliación de dientes primarios, ha de ser eliminado antes de la intervención. Los dientes con lesiones cariosas extensas deben extraerse, aunque no exista afectación pulpar.
La transfusión de concentrado de eritrocitos o la transfusión de intercambio parcial con factores de coagulación son a menudo necesarias. También debe instaurarse antibioterapia profiláctica antes de las técnicas quirúrgicas. El principal problema en niños sometidos a trasplante es la inmunodeficiencia.
El tratamiento inmunosupresor incluye diversos corticoides y ciclosporina. Ésta es tanto citotóxica como nefrotóxica, y puede producir hipertensión. Sin embargo, la mayoría de los niños son tratados más fácilmente después del trasplante, debido a la curación de la enfermedad original. Ello se cumple especialmente en niños con insuficiencia hepática terminal.
Trastornos esofágicos
En algunos niños, el control neuromuscular del esfínter esofágico inferior es inadecuado y da lugar a enfermedad por reflujo gastroesofágico (ERGE). La fisiopatología exacta de la ERGE no se conoce, aunque en ciertos casos se han observado anomalías motoras gástricas caracterizadas por retraso del vaciado gástrico. La regurgitación no siempre es clínicamente evidente o sintomática y, en ocasiones, es necesario proceder a monitorización del pH esofágico durante 24 horas para detectar una ERGE significativa. Los niños sintomáticos son tratados con clorhidrato de metoclopramida para prevenir el reflujo, mientras que, en los casos que presentan esofagitis concurrente, suele emplearse un antagonista de los receptores H2 de la histamina, como cimetidina. Si el tratamiento médico fracasa, ha de recurrirse a la cirugía.
Cada vez en mayor medida, son los odontólogos los primeros profesionales sanitarios en observar los efectos crónicos de una ERGE no diagnosticada sobre la dentición primaria. Tales efectos se centran en la erosión dental grave de caninos y molares. Si se sospecha de una posible ERGE, se recomienda la inmediata derivación a gastroenterología a fin de que el paciente se someta a una endoscopia y monitorización del pH. Para reparar la pérdida de la dimensión vertical, suele requerirse un tratamiento odontológico integral con coronas de acero inoxidable.
Enfermedad intestinal inflamatoria (v. cap. 8)
El término «enfermedad intestinal inflamatoria» hace generalmente referencia a la colitis ulcerosa y la enfermedad de Crohn, dos manifestaciones diferentes de una reacción tisular ante un agente común. Determinar cuál es el agente etiológico de este proceso resulta difícil. Ambos cuadros presentan un patrón inflamatorio crónico del tracto gastrointestinal con exacerbaciones agudas. Particular interés para el odontólogo presenta la asociación a granulomatosis orofacial que, en ocasiones, antecede al desarrollo de colitis ulcerosa en 1-2 años.
Los cambios orales referidos en algunos casos pediátricos incluyen ulceración o figuración lineal de la mucosa oral y labial, tumefacción difusa de los labios, queilitis angular e inflamación eritematosa difusa de las encías. Estas lesiones pueden mejorar con sulfasalazina, aunque suelen reaparecer periódicamente.
Endocrinología
Diabetes mellitus
La diabetes de tipo 1, o insulinodependiente, es la forma más común de diabetes en niños. Aproximadamente 2 de cada 1.000 niños de edades comprendidas entre los 5 y los 18 años padecen la enfermedad. El desarrollo de la diabetes de tipo 1 es debido a agresiones víricas o tóxicas de los islotes pancreáticos en niños genéticamente predispuestos.
También se ha mencionado la implicación de un mecanismo autoinmune en la destrucción de células (3 productoras de insulina. El objetivo del tratamiento es controlar la glucosa sanguínea para mantenerla en niveles normales y, a continuación, reducir la incidencia de la hipercalcemia y la cetoacidosis como potenciales complicaciones. Ello se lleva a cabo administrando insulina de acción intermedia. Actualmente, el trasplante pancreático es un potencial recurso de curación de la diabetes juvenil que está siendo objeto de estudio. Los parientes de enfermos de diabetes presentan 2,5 veces más probabilidades de desarrollar la enfermedad que la población general. Los síntomas de presentación incluyen:
- Polidipsia.
- Poliuria.
- Pérdida de peso con polifagia.
- Enuresis.
- Infecciones y candidiasis recurrentes.
- La glucosuria puede también estar presente.
- La cetoacidosis y el coma se dan en casos mal controlados o no diagnosticados.
Un diagnóstico de diabetes se establece cuando los niveles de glucosa sanguínea en ayunas son superiores a 18mmol/l, con resultado anómalo en la prueba de tolerancia a la glucosa oral y glucosuria, con o sin cetonuria.
Consecuencias odontológicas
- La enfermedad periodontal es el hallazgo más común en niños con diabetes mal controlada. Estos niños presentan aumento de la reabsorción ósea alveolar y alteraciones gingivales inflamatorias. Las manifestaciones clínicas son similares a las de la periodontitis juvenil generalizada.
- La xerostomia y los abscesos intraorales recurrentes son también propios de los casos graves.
- La hipocalcificación y la hipoplasia del esmalte, junto con la disminución del flujo de saliva, pueden predisponer a estos pacientes a un incremento del riesgo de caries infantil.
- Las alteraciones de la flora oral se centran en un aumento de las infecciones por Candida albicans, estafilococos y estreptococos hemolíticos.
Tratamiento odontológico
- Los niños con diabetes bien controlada reciben tratamiento odontológico normal, excepto cuando se requiere anestesia general. Para las citas de rutina en la consulta odontológica, el niño debe tomar una alimentación normal antes del tratamiento, aunque siempre ha de disponerse de una fuente de glucosa para tratar una hipoglucemia repentina.
- El ayuno previo a la anestesia general requiere una cuidadosa monitorización, con ajuste de los niveles sanguíneos de glucosa durante él, ya que la hipoglucemia relacionada con anestesia general puede tener consecuencias fatales.
- La cicatrización postoperatoria se retrasa en ocasiones, en especial en casos mal controlados, y la sepsis oral constituye un riesgo adicional en el delicado control del niño diabético.
- Todos los niños tratados bajo anestesia general han de ser ingresados en un hospital pediátrico y su asistencia ha de ser supervisada por el equipo endocrinología) pediátrico. En la práctica estándar, se comienza con infusión de dextrosa e insulina, a fin de evitar complicaciones durante el período de ayuno y para facilitar el ajuste de los niveles de glucosa sanguínea.
- Antes de los abordajes quirúrgicos se recomienda antibioterapia profiláctica.
Trastornos hipofisarios
Hipopituitarismo
El enanismo por hipopituitarismo, debido a una insuficiencia hipofisaria previa, puede ser idiopático o secundario a enfermedad hipofisaria o hipotalámica (craneofaringioma, infecciones, enfermedad granulomatosa o traumatismos). Aunque otras hormonas hipofisarias pueden ser deficitarias, generalmente sólo se registra carencia de la hormona del crecimiento (GH). El tratamiento se basa en suplementos de GH, que estimulan la diferenciación de células precursoras de placas de crecimiento epifisario e inducen expansión clonal de células cartilaginosas. El hipopituitarismo tiene efectos sobre la actividad de las glándulas suprarrenales, lo que puede dar lugar a hipotiroidismo y aumento del riesgo de coma hipopituitario. El proceso se ve en ocasiones precipitado por episodios estresantes como traumatismos, cirugía, anestesia general o infección.
La detección precoz y el abordaje terapéutico son esenciales para reducir al mínimo el trastorno del crecimiento. Aunque el tratamiento previene la pérdida de estatura en relación a la edad, no actúa sobre cualquier posible deficiencia detectada en el momento del diagnóstico.
Consecuencias odontológicas
El hipopituitarismo puede hacer que disminuyan las mediciones faciales lineales (particularmente las de la altura facial posterior) y las mediciones basocraneales lineales.
Los niños a menudo se presentan con mordida abierta acompañada de la típica fades inmadura propia del hipopituitarismo.
El desarrollo esquelético somático está más retardado que el craneofacial, aunque la erupción de los dientes y la formación de las raíces están a veces retrasadas o son incompletas.
Para controlar el crecimiento y el desarrollo orofacial se requiere una valoración ortodóncica precoz.
Hiperpituitarismo
El gigantismo o acromegalia es consecuencia de una hipersecreción primaria de hormonas hipofisarias, y la hiperplasia hipofisaria suele asociarse a neoplasia maligna de la hipófisis, muy poco frecuente en niños. No obstante, la hipersecreción de hormonas es a veces un hallazgo secundario en enfermedades tales como hipogonadismo, hiperadrenalismo e hipotiroidismo inducido por retroalimentación negativa.
La gravedad de las manifestaciones craneofaciales del hiperpituitarismo depende del tiempo de inicio y de la duración de la hipersecreción. En niños con epífisis abiertas, la hipersecreción de la hormona del crecimiento induce sobrecrecimiento generalizado del esqueleto y los tejidos blandos, con significativo aumento de la estatura y el tamaño en general.
Aunque infrecuente, el gigantismo se relaciona con adenoma eosinofílico, aunque también puede asociarse a un tumor hipotalámico. En adolescentes con epífisis cerradas, la hipersecreción da lugar a acromegalia, que consiste básicamente en hipertrofia de las partes distales del cuerpo (dedos de manos y pies) con aumento escaso, o nulo, de la estatura.
Consecuencias odontológicas
- Desarrollo precoz y acelerado del esqueleto craneofacial.
- Prognatismo.
- Desarrollo y erupción dentales acelerados.
- Lengua crenada e hipertrofiada y rasgos faciales toscos.
- Radiológicamente, se observa un marcado engrasamiento del cráneo y el hueso cortical de la mandíbula.
- Las estructuras óseas presentan sobredesarrollo, con escasa maduración y mala calidad del hueso (osteoporosis); es frecuente la hipercementación de las raíces dentales.
Tratamiento odontológico
El tratamiento odontológico de pacientes con trastornos hipofisarios se centra en el abordaje de las malformaciones craneofaciales. Debe ser cuidadosamente planificado y coordinado en un entorno multidisciplinar. No existen contraindicaciones para el tratamiento odontológico integral.
Trastornos tiroideos
Hipotiroidismo
El hipotiroidismo puede ser congénito (cretinismo) o adquirido (mixedema juvenil o tiroiditis de Hashimoto). El déficit de hormona tiroidea es casi siempre causado por una enfermedad primaria del tiroides y, con menor frecuencia, se asocia a insuficiencia hipotalámica y/o hipofisaria. El cretinismo es poco frecuente en los países en los que se realizan pruebas prenatales. Puede deberse a aplasia, hipoplasia o descenso anómalo de la glándula, errores metabólicos innatos familiares, agentes teratogénicos intrauterinos maternos, carencia de yoduro y causas idiopáticas. El mixedema juvenil se relaciona con múltiples causas, como tiroidectomía, irradiación del tiroides, enfermedades autoinmunes, infección o fármacos.
Entre los cambios hipotiroideos generales se cuentan retraso del crecimiento somático, disminución de la actividad física, disminución de la circulación, mal tono muscular, trastornos del habla, retraso del desarrollo mental y manifestaciones craneofaciales. Estos cambios dependen de la edad y del momento de inicio de la enfermedad, el nivel de desajuste en la producción de hormona tiroidea, y el momento del diagnóstico y el tratamiento.
El tratamiento se centra en compensar las carencias de hormona tiroidea con un derivado sintético (levotiroxina sódica) o con tiroproteína animal. En la mayoría de los países desarrollados, la función tiroidea anómala se detecta poco después del nacimiento mediante medición de hormonas tiroideas (T3 y T4), e instaurando un tratamiento inmediatamente después del diagnóstico inicial.
Consecuencias odontológicas
- Disminución del crecimiento facial vertical.
- Disminución de la longitud y el ángulo de la base del cráneo, protrusión maxilar y mordida abierta con patrones de inmadurez facial.
- Retraso en la erupción de los dientes y mayor separación entre dientes primarios y desarrollo de los dientes secundarios. Anomalías del desarrollo, como hipoplasia del esmalte.
Hipertiroidismo
Aunque de etiología indeterminada, el hipertiroidismo (tirotoxicosis) se relaciona con carencias inmunológicas, enfermedades infecciosas, trastornos hereditarios y neoplasias malignas infantiles. Las asociaciones más comunes son la enfermedad de Graves, el bocio multinodular tóxico, el adenoma tóxico y la tiroiditis subaguda. La tirotoxicosis es más frecuente en mujeres y suele aparecer entre los 12 y los 14 años de edad. Se asocia a bocio y presenta un curso clínico cíclico.
Los cambios relacionados con el hipertiroidismo pueden evocar un estado de hiperactividad del sistema nervioso simpático y sus manifestaciones clínicas típicas incluyen nerviosismo, inestabilidad emocional, intolerancia al calor, pérdida de peso a pesar del aumento del apetito, insomnio, sudoración intensa, cambios en piel, uñas y pelo y trastornos gastrointestinales. Además, se han detectado ciertas alteraciones oculares, como latencia palpebral, exoftalmos y ensanchamiento de las fisuras palpebrales, con varias anomalías cardiovasculares.
Consecuencias odontológicas
- Crecimiento y desarrollo acelerados del complejo craneofacial y el esqueleto.
- Erupción precoz de los dientes.
- Destrucción periodontal y periapical.
- Osteoporosis.
- Cambios orofaciales característicos son aumento de la altura facial vertical con mordida abierta anterior y prognatismo mandibular.
Tratamiento odontológico
El principal problema en niños con trastornos tiroideos es el incremento de los riesgos asociados a la anestesia general. El paciente hipotiroideo presenta riesgo de insuficiencia cardíaca congestiva, que puede verse precipitada por la anestesia. Cuando está presente, la anemia también aumenta el riesgo, al igual que la cardiomegalia, que puede inducir hipertensión súbita durante la inducción de la anestesia. Los potenciales efectos cardíacos adversos del hipertiroidismo incrementan asimismo los riesgos inherentes a la anestesia general, en especial en niños con trastornos crónicos del ritmo cardíaco. El paciente no tratado está además expuesto a riesgo de infección oral y, en los abordajes quirúrgicos, a que se precipite una crisis tiroidea.
Las infecciones orales parecen tener efectos lesivos sobre la glándula tiroides, directamente o a través de sustancias tóxicas, y pueden agravar el hipertiroidismo o exacerbar los síntomas asociados a hiperfunción. Las infecciones orales deben tratarse de forma agresiva, consultando previamente al endocrinólogo del niño. Los fármacos antitiroideos producen a veces parotiditis y agranulocitosis, que predisponen al paciente a episodios hemorrágicos, lesiones ulceronecróticas e infecciones orales crónicas.
El tratamiento general de estos pacientes es análogo al de los afectados por enfermedad hipertensiva. Las citas en la consulta odontológica deben ser breves, y el tratamiento ha de ser lo más sencillo posible. Siempre que se pueda, es preferible el tratamiento preventivo a las técnicas operatorias.
Trastornos paratiroideos
Hipoparatiroidismo
Esta afección suele ser consecuencia de deficiencias estructurales o funcionales de las glándulas paratiroides en la primera infancia, de paratiroidectomía durante la tiroidectomía, radiación de la glándula, neoplasia maligna o enfermedad autoinmune.
El tratamiento se centra en el mantenimiento de los niveles normales de caldo sérico y la administración de suplementos dietéticos y vitamina D. Los cambios en el hipoparatiroidismo incluyen hipocalcemia prolongada con hiperfosfatemia, excitabilidad neuromuscular y tetania. También se registran disfunción cardiovascular, epilepsia idiopática, defectos del ectodermo y manifestaciones craneofaciales, con retraso físico y mental permanente si el diagnóstico y el tratamiento son tardíos.
Consecuencias odontológicas
- Parestesia circumoral y espasmo de los músculos faciales se han comunicado en casos de hipocalcemia grave.
- Hipoplasia del esmalte.
- La hipodontia y las anomalías radiculares son hallazgos frecuentes.
- La erupción dental puede estar significativamente retardada o interrumpida.
- También se han referidos casos de aumento del riesgo de candidiasis oral aguda o crónica.
Seudohipoparatiroidismo (SHP)
Esta enfermedad también se conoce como osteodistrofia hereditaria de Albright. La herencia de la SHP es dominante y ligada al cromosoma X y, en ella, los niveles de hormona paratiroidea son adecuados, aunque con respuesta inapropiada en hueso y riñón. En general, los varones se ven más gravemente afectados que las mujeres, aunque en éstas el síndrome es más habitual.
Consecuencias odontológicas
- Fades redondeada con cuello corto.
- Erupción dental retrasada o incompleta.
- Hipoplasia del esmalte.
- Raíces dentarias cortas.
Hiperparatiroidismo
La producción excesiva de hormona paratiroidea puede ser consecuencia de un defecto primario de la glándula (hiperplasia por adenoma, hipertrofia) o de un fenómeno compensatorio secundario de corrección de los estados hipocalcémicos debidos a raquitismo o enfermedad renal crónica. El trastorno primario da lugar a hipercalcemia e hipercalcinuria, con debilidad muscular, trastornos gastrointestinales, poliuria, cálculos renales, calcificación de tejidos blandos, malformación ósea (osteoporosis u osteomalacia) y dolor. Whitlock (1970) resumió estos cambios con la expresión «cálculos, huesos, ruidos abdominales y lamentos físicos». En lactan tes y niños pequeños puede retrasar el crecimiento, provocar problemas nutricionales e hipotonía muscular e inducir retraso mental, convulsiones y ceguera.
Las lesiones óseas reciben la denominación de tumores pardos, ya que presentan zonas de hemorragia con abundantes células gigantes multinucleadas, fibroblastos y hemosiderina. La lesión ósea más habitual es la osteoporosis generalizada con reabsorción cortical, y los signos radiológicos incluyen rarefacciones múltiples, pérdida de la trabeculación característica, aspecto de vidrio esmerilado y calcificaciones metastásicas.
Consecuencias odontológicas
- Aumento de la movilidad de los dientes.
- Maloclusión grave y desplazamiento de los dientes, sin aparente formación de bolsas periodontales patológicas.
- Cambios radiográficos con calcificaciones metastásicas de los tejidos blandos, radiotransparencias periapicales, reabsorción radicular, pérdida de lámina dura y pérdida generalizada de radiodensidad.
Tratamiento odontológico
En general, el tratamiento odontológico de rutina no requiere modificaciones si no se presentan complicaciones asociadas. Las manifestaciones de la enfermedad de Addison (insuficiencia suprarrenal) acompañan a veces al hipoparatoroidismo, en cuyo caso el niño puede presentar riesgo ante intervenciones estresantes, como cirugía o anestesia general.
En ocasiones, el hiperparatiroidismo se asocia a arritmias cardíacas, que aumentan el riesgo de parada cardíaca durante la anestesia general. El riesgo de fractura patológica en casos avanzados de la enfermedad debe ser tomado en consideración durante la cirugía oral. La inmovilización de los dientes móviles es recomendable para prevenir un mayor desplazamiento tras la estabilización de la dentición.
Trastornos de las glándulas suprarrenales
Las glándulas suprarrenales están compuestas por dos sistemas endocrinos denominados cortical y medular. La corteza suprarrenal produce tres tipos principales de hormonas esteroideas: glucocorticoides, mineralcorticoides y hormonas sexuales. Los glucocorticoides (cortisol) desarrollan un papel importante en el metabolismo de hidratos de carbono, grasas y proteínas, contribuyen al mantenimiento de la presión arterial normal y protegen al cuerpo de diferentes agentes estresantes. Los mineralcorticoides (aldosterona) ayudan a mantener el equilibrio de sales y agua mediante su acción en el riñón. Las hormonas sexuales suprarrenales complementan las acciones de los esteroides gonadales en el desarrollo de los caracteres sexuales y la capacidad reproductiva.
Insuficiencia suprarrenal
Los principales problemas asociados a hipofunción suprarrenal son consecuencia de carencias de glucocorticoides y mineralcorticoides. La insuficiencia suprarrenal primaria (enfermedad de Addison) es una afección crónica caracterizada por:
- Anorexia.
- Pérdida de peso, vómitos.
- Apetito insaciable de sal.
- Náuseas.
- Debilidad.
- Hiperpigmentación cutánea.
Se registran bajos niveles sanguíneos de cortisol, y la crisis suprarrenal aguda puede verse precipitada por factores estresantes relativamente leves. El tratamiento consiste en suplementación inmediata con esteroides. La insuficiencia suprarrenal secundaria es causada por la administración prolongada de esteroides, que induce supresión del cortisol endógeno. Los niños no suelen presentarse con signos patentes, a no ser que estén sometidos a situaciones estresantes. La crisis suprarrenal se puede presentar sin previo aviso.
Hiperplasia suprarrenal congénita
La hiperplasia suprarrenal congénita (HSC) es causada por deficiencia enzimática (de 21-hidroxilasa) en la vía biosintética entre el colesterol y el cortisol. Entre las manifestaciones clínicas se cuentan desarrollo insuficiente, vómitos y deshidratación asociada a exceso de pérdida de sodio en orina (pérdida de sal) e hiperpotasemia. El tratamiento incluye restablecimiento del equilibrio electrolítico y reposición de mineralcorticoides.
Hiperfunción de la corteza suprarrenal
El síndrome de Cushing es un cuadro clínico caracterizado por manifestaciones de hiperfunción corticoadrenal, como «cara de luna», obesidad troncal, hirsutismo y mala cicatrización de las heridas. Puede ser iatrogénica o secundaria a tratamiento de enfermedades inflamatorias o autoinmunes con dosis altas de glucocorticoides. Se trata mediante adrenalectomía o cirugía hipofisaria.
Tratamiento odontológico
Antes de abordar el tratamiento odontológico, es importante confirmar el diagnóstico con el endocrinólogo. En función de la duración y dosificación del tratamiento previo, puede realizarse una valoración de la potencial supresión suprarrenal. Tras la consulta médica, deben administrarse esteroides suplementarios, en proporción al grado de supresión su prarrenal y el estrés inherente al abordaje odontológico. En general, la duplicación o triplicación de la dosis diaria es apropiada antes de la intervención, recomendándose una rápida disminución progresiva hasta la dosis original a lo largo de 3 días. En las técnicas quirúrgicas invasivas están indicadas la sedación consciente o la anestesia general con antibioterapia profiláctica.
Neurología
Convulsión febril
El término se usa para describir la convulsión padecida por un niño de menos de 5 años en respuesta a una enfermedad febril. Suele registrarse cuando la temperatura supera los 38 °C y no se puede determinar otra causa. Las convulsiones recurrentes no febriles son definidas como epilepsia.
Epilepsia
La epilepsia es el principal trastorno neurológico pediátrico y sus etiologías predominantes son las lesiones neonatales y las anomalías congénitas.
Las convulsiones pueden clasificarse como:
- Generalizadas, tónico-clónicas (gran mal) o con ausencias (pequeño mal).
- Focales (parciales), simples o complejas.
El síndrome de Lennox-Gastaut es una forma intratable de epilepsia grave, con ataques atónicos con inclinación de cabeza, pequeño mal atípico y breves convulsiones tónicoclónicas, generalmente nocturnas.
Actualmente, el tratamiento se limita al uso de fármacos anticonvulsivantes, con aumento progresivo de la dosis hasta alcanzar niveles sanguíneos terapéuticos, minimizando los efectos secundarios. Aproximadamente el 70% de los niños responden bien, o con problemas mínimos, incluso en tratamientos a largo plazo. No obstante, entre las complicaciones del tratamiento anticonvulsivante cabe citar somnolencia, ataxia, salivación excesiva, hiperactividad y comportamiento agresivo. La reducción gradual de los multifármacos tiene un efecto positivo en términos de mejora de la receptividad y disminución del número de con vulsiones. La fenitoína sódica continúa siendo el fármaco más eficaz para las convulsiones de gran mal, aunque los efectos adversos de índole cosmética, como hirsutismo o hipertrofia gingival, han reducido su empleo a favor de la carbamazepina.
Consecuencias odontológicas
Los principales problemas orodentales en niños epilépticos son hipertrofia gingival (fig. 10.11) y posible presentación de una convulsión durante la cirugía dental.
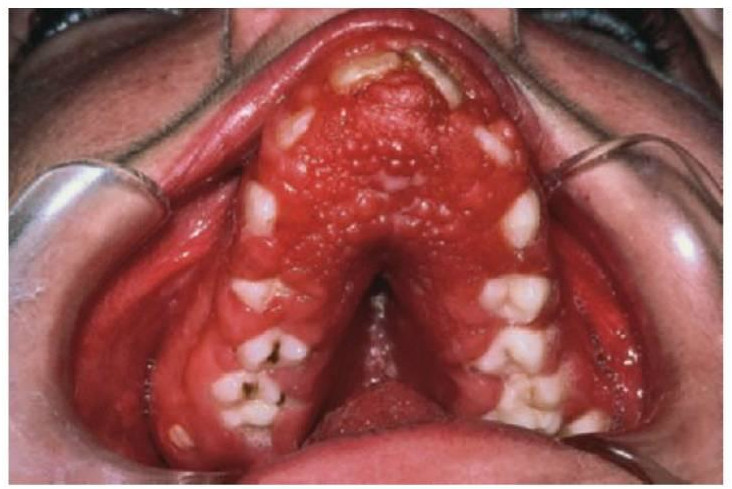
Tratamiento odontológico
El tratamiento de la hipertrofia gingival (fig. 10.9B) depende de los niveles de higiene oral y de desarrollo dental en el momento del diagnóstico. En la dentición permanente es a veces necesaria una gingivectomía de toda la boca, aunque el sobrecrecimiento gingival reaparecerá si la higiene oral no es óptima. El mantenimiento de esta higiene resulta particularmente problemático en niños con discapacidad intelectual adicional y depende en gran medida de la motivación y de la habilidad de padres y cuidadores. Los eliminadores de placa a pilas con pequeñas cabezas circulares son útiles a este respecto en los casos más difíciles. El uso diario de gel de clorhexidina es eficaz para reducir el componente inflamatorio del sobrecrecimiento gingival. Es siempre conveniente tener en cuenta los intereses del niño, en especial en lo que respecta a los tratamientos quirúrgicos agresivos, que pueden no beneficiar al paciente en el largo plazo.
El objetivo general del tratamiento odontológico en este caso se centra en evitar las convulsiones. Es importante conocer el tipo de epilepsia y los factores desencadenantes, los fármacos y su posología, el cumplimiento y el nivel de control de las convulsiones. Por otra parte, las interacciones farmacológicas con los anticonvulsivantes son frecuentes y su semivida y sus niveles sanguíneos pueden incrementarse de forma sustancial. Antes de iniciar el tratamiento es esencial consultar con el neurólogo del niño.
Para la prevención y control de las convulsiones en cirugía dental se recomienda seguir el siguiente protocolo:
- Reducir el estrés del niño con técnicas de tratamiento conductual y sedación consciente.
- Disminuir la luz directa sobre la cabeza del paciente, sobre todo en la epilepsia fotosensible.
- Evitar los fármacos que puedan inducir convulsiones, como los estimulantes del SNC o los anestésicos locales que contengan adrenalina.
- Es necesario disponer de fármacos de urgencia, como oxígeno, diazepam intravenoso o rectal y fenobarbital sódico intravenoso.
- Establecer previamente el procedimiento de traslado del paciente a un centro hospitalario, por si es necesario.
La anestesia general se prefiere en niños con mal control de las convulsiones, dado que la actividad neuronal anómala es completamente anulada bajo ella. Los traumatismos dentarios son consecuencias evidentes del tratamiento de niños con convulsiones frecuentes y mal controladas. Los aparatos extraíbles están contraindicados en niños epilépticos, ante el potencial riesgo de obstrucción respiratoria.
Parálisis cerebral
Las parálisis cerebrales conforman un grupo heterogéneo de encefalopatías estáticas que tienen en común el trastorno postural y del movimiento. La discapacidad motora es permanente y las manifestaciones clínicas son variables. Este tipo de parálisis se clasifican como:
- Espástica (hemiplejía, paraplejía o tetraplejía).
- Discinética (coreoatetoide y distónica).
- Ataxia.
- Combinada.
Los episodios adversos prenatales y perinatales que afectan al cerebro son responsables de la parálisis cerebral de causa conocida. No obstante, la mayoría de los casos son de causa desconocida.
La capacidad cognitiva de un niño con parálisis cerebral no puede establecerse de inmediato. Para determinar sus capacidades físicas y mentales se requiere tiempo. Numerosos pacientes con parálisis cerebral no presentan deterioro cognitivo alguno y a veces emplean formas de comunicación verbal que requieren medios electrónicos y paciencia por parte del operador. A menudo no es necesario cambiar el tono de voz o el nivel de lenguaje para evaluar a estos niños.
La protrusión maxilar y el espaciado entre los dientes anteriores son secuelas frecuentes, causadas por el tono neuromuscular orofacial anómalo. Otras presentaciones frecuentes son protrusión de la lengua, babeo, respiración por la boca y sensibilidad perioral. Las caries y la enfermedad periodontal pueden ser graves, por higiene inadecuada o después de cirugía para reparar los conductos glandulares salivales a fin de reducir el babeo.
Tratamiento odontológico
El reflejo de extensión de las extremidades puede activarse durante la visita odontológica si no se presta atención. Las contracciones se producen al pasar al paciente de la silla de ruedas al sillón dental. Es necesario comentar con padres o acompañantes la forma de efectuar el traslado. El reflejo también puede estimularse si la cabeza del niño queda caída o sin apoyo. Es necesario comprobar que el niño queda bien acomodado en el sillón con mantas o almohadas, o bien es sujetado con un cinturón o una malla. Si el reflejo de manifiesta cuando las extremidades están extendidas:
- Eleve el sillón.
- Estabilice la cabeza en la línea media.
- Coloque los brazos del niño por delante del cuerpo.
- Acomódelo.
Los reflejos de vómito, tos, mordida o deglución pueden estar deteriorados o ser anómalos en niños con parálisis cerebral. Cuando el reflejo nauseoso es exagerado, el paciente debe ser tratado en una posición más elevada, si es posible con el cuello levemente flexionado y las rodillas dobladas hacia arriba. En pacientes con dificultades de deglución es conveniente emplear abrebocas, teniendo en cuenta el riesgo de aspiración. Este riesgo se atenúa usando abrebocas manuales y ligaduras con hilo dental. El dique de goma también es útil en estos casos.
Si el reflejo de mordida ante la estimulación oral se mantiene, los instrumentos se han de introducir lateralmente en vez de por el área frontal. Para facilitar la exploración dental, se puede ejercer una leve presión con el dedo índice sobre el borde anterior del ramo ascendente y el triángulo retromolar. Ello reduce el riesgo de mordedura de algún dedo. La sedación con óxido nitroso ayuda a aminorar los movimientos involuntarios durante el tratamiento.
Hidrocefalia
La mayoría de los casos de hidrocefalia son debidos a obstrucción del flujo de líquido cefalorraquídeo (LCR), bien en los ventrículos cerebrales o bien en el espacio subaracnoideo. A medida que los ventrículos se agrandan por acumulación de LCR, la presión intra craneal aumenta, dando lugar a un franco deterioro neurológico si no se efectúa descompresión. Entre las causas posnatales de hidrocefalia se cuentan infección bacteriana, hemorragia y obstrucción neoplásica. Las causas prenatales son a veces imposibles de diagnosticar. El tratamiento mediante inserción de una derivación suele ser apropiado en lactantes con hidrocefalia grave. Numerosos pacientes afectados presentan otras deficiencias del desarrollo, como dificultades de aprendizaje o paraplejía.
Los niños con hidrocefalia sometidos a tratamiento odontológico requieren profilaxis antibiótica cuando presentan derivaciones que vierten directamente a los vasos sanguíneos principales (ventriculoauriculares), a fin de evitar la septicemia y la infección de la de rivación. Se suele considerar que, si el neurólogo no especifica lo contrario, los niños con derivación ventriculoperitoneal y espinoperitoneal no necesitan antibioterapia profiláctica.
Espina bífida
En este cuadro se produce una hernia (meningomielocele) de la médula espinal, las raíces nerviosas y las meninges, a través de una discontinuidad en las láminas y la apófisis espinosa de una o varias vértebras, generalmente a nivel sacro o lumbosacro. La médula expues ta es displásica, casi siempre no funcional y a menudo causante de paraplejía. El cierre quirúrgico inmediato se realiza para prevenir la infección, siendo posteriormente necesario proceder a tratamiento ortopédico y urológico. La rehabilitación se desarrolla preferible mente en clínicas multidisciplinares debidamente coordinadas.
Los niños con espina bífida presentan una incidencia de alergia al látex (guantes, dique de goma) mayor que la de la población pediátrica general. Se recomienda, pues, el uso de guantes de vinilo. En muchos casos, los niños están postrados en silla de ruedas y su comodidad ha de favorecerse siguiendo pautas similares a las indicadas para la parálisis cerebral. De otro modo, el tratamiento odontológico de rutina de estos pacientes debe abordarse en un entorno hospitalario.
Distrofias musculares
Las distrofias musculares son miopatías progresivas y degenerativas primarias, de origen genético. Sus signos clínicos incluyen debilidad muscular creciente, mal tono muscular, movimientos anómalos, cambios cutáneos, y deformidad articular y esquelética progresiva. La distrofia muscular de Duchenne y la miotónica son las dos formas más comunes de estos trastornos, cuyo actual tratamiento se centra en hacer que la evolución de los efectos de la atrofia por desuso sea más lenta. La deambulación no suele ser posible por encima de los 12 años de edad.
Entre las manifestaciones orales de esta enfermedad cabe citar deformidad craneofacial con dientes anteriores espadados y protruyentes, debido al mal tono orofacial y a la respiración por boca asociada, protrusión de la lengua y mordida abierta. Hallazgos habituales son mal control de la placa, gingivitis y traumatismos en los dientes anteriores. Las estrategias de tratamiento odontológico son similares a las indicadas para niños con parálisis cerebral, utilizando medios de soporte para cuerpo y cabeza y abrebocas. Con frecuencia se requieren sedación y anestesia general, ante la incapacidad de los pacientes para tolerar las técnicas orales de rutina en el sillón dental.
Enfermedades respiratorias
Asma
Australia presenta una de las tasas más elevadas del mundo de asma infantil, con uno de cada 5 niños y 1 de cada 7 adolescentes. Se trata de una enfermedad respiratoria caracterizada por aumento de la sensibilidad de las vías respiratorias a un amplio espectro de estímulos, que induce estrechamiento de dichas vías, con síntomas como disnea, sibilancias y tos. Entre los factores desencadenantes se cuentan estrés emocional, ejercicio, aire frío, infecciones respiratorias víricas, contaminación ambiental y consumo de ácido acetilsalicílico. La afección es reversible, bien de forma espontánea o mediante tratamiento broncodilatador. En la actualidad suscitan un notable interés los fármacos profilácticos, que previenen los episodios en vez de tratar los ataques agudos.
Entre los broncodilatadores hay fármacos (32-adrenérgicos, como el sulfato de salbutamol y la teofilina. Los agentes preventivos incluyen cromoglicato disódico y corticoides, como prednisolona, o corticoides inhalados, como dipropionato de beclometasona y xinafoato de salmeterol.
Consecuencias odontológicas
- La principal preocupación del odontólogo pediátrico es la exacerbación de un ataque agudo durante un abordaje quirúrgico.
- Se han de evitar los agentes desencadenantes antes de iniciar el tratamiento, asegurándose de que el niño tiene a mano la medicación adecuada (inhalador) para utilizarla como recurso de urgencia en caso de ataque.
- Algunos broncodilatadores y corticoides producen tinción extrínseca de los dientes, debido a cambios en la flora oral, y predisponen al desarrollo de candidiasis.
- Los niños que reciben dosis altas de corticoides (> 1.600 jxg/día) pueden estar inmunocomprometidos y, en ocasiones, requieren corticoides suplementarios el día del tratamiento, como consecuencia de la supresión suprarrenal.
- Los niños respiran muchas veces por la boca, lo que produce gingivitis e inflamación de los tejidos gingivales anteriores.
Tratamiento odontológico
- La profilaxis dental regular es necesaria cuando hay tinción extrínseca de los dientes.
- Indique a los padres que se aseguren de que el niño se cepilla bien los dientes después de la administración de los fármacos o que emplea un enjuague de boca que tenga efecto en especial durante la noche, para reducir el riesgo de erosión dental.
- Los niños ingresados que hayan padecido frecuentes episodios de asma en los últimos 12 meses o los tratados con dosis altas de corticoides no son adecuados para la cirugía de día, sino que han de ser hospitalizados con anterioridad a la intervención para ser examinados preoperatoriamente por el equipo neumológico pediátrico.
- Se recomienda no utilizar soluciones anestésicas locales que contengan adrenalina, por sus potenciales efectos adrenérgicos por vía intravenosa.
- No hay contraindicaciones para el uso de óxido nitroso o dosis sedantes de diazepam o pamoato de hidroxicina en niños asmáticos.
Fibrosis quística
Este trastorno multisistémico es una enfermedad autosómica recesiva que afecta a las glándulas exocrinas secretoras de moco, en especial de los sistemas respiratorio y gastrointestinal. Se estima que la frecuencia heterocigótica es de 1 de cada 25 personas de raza blanca. La fibrosis quística se caracteriza por obstrucción respiratoria crónica, infección respiratoria, malabsorción intestinal y retraso del crecimiento. El desarrollo sexual también está retardado en ocasiones. Aunque actualmente la enfermedad no tiene cura, el tratamiento agresivo de los síntomas ha mejorado la supervivencia y la calidad de vida de los que la padecen. La principal causa de muerte es la insuficiencia respiratoria por infección torácica recurrente.
Anteriormente, los niños eran tratados con tetraciclinas de amplio espectro y, a menudo, presentaban un característico patrón de tinción intrínseca e hipoplasia del esmalte de los dientes permanentes. Sin embargo, en Australia esta práctica fue abandonada en la dé cada de 1970, con lo que la incidencia de las alteraciones del esmalte se redujo drásticamente. Los niveles aumentados o alterados de flujo de saliva no parecen predisponer a caries, posiblemente debido al uso de antibióticos a largo plazo.
Tratamiento odontológico
- El tratamiento odontológico ha de basarse en la optimización de la prevención, incluyendo estricta higiene oral y control de la dieta. El tratamiento de rutina ha de abordar se una vez que se confirma que la afectación pulmonar está estabilizada y controlada con fármacos.
- Los anestésicos locales con vasoconstrictores no están contraindicados.
- Conviene evitar las citas prolongadas. En cualquier caso, el uso de sedación consciente o anestesia general ha de ser convenientemente analizado con el especialista pediátrico en aparato respiratorio, y sólo ha de emplearse cuando no sea viable el control del dolor.
- La fisioterapia y la antibioterapia profiláctica son necesarias tanto pre como postoperatoriamente en casos de afectación pulmonar grave.
- Aunque la esperanza de vida de estos pacientes ha aumentado con los abordajes terapéuticos actuales, ha de plantearse un enfoque del tratamiento y sus expectativas racional y pragmático.
Tuberculosis
La tuberculosis es una infección, causada por Mycobacterium tuberculosis, que induce inflamación granulomatosa y necrosis caseosa en el tejido pulmonar. La presentación más habitual en niños consiste en malestar, anorexia y pérdida de peso, fiebre y tos, con signos de linfadenitis cervical. El tratamiento se basa en antibioterapia a largo plazo con fármacos específicos. Los familiares y otras personas con las que el enfermo esté en contacto han de recibir quimioprofilaxis para evitar la dispersión de la enfermedad. La vacuna de bacilo Calmette-Guérin (BCG) se administra sistemáticamente en comunidades con tasas elevadas de tuberculosis.
No debe abordarse tratamiento odontológico alguno hasta que el diagnóstico y el agente causal se hayan establecido, y sólo se instaurará tras la correspondiente consulta con el médico de respiratorio.
Otros niños con necesidades especiales
Los niños con necesidades especiales requieren consultas odontológicas ajustadas a sus capacidades. El médico que sepa adaptarse a la discapacidad del pequeño podrá garantizar un entorno seguro para su tratamiento.
Trastorno de hiperactividad por déficit de atención (THDA)
El trastorno de hiperactividad por déficit de atención (THDA) es una alteración común del desarrollo, que afecta al 3-5% de la población. Se da con mucha más frecuencia en niños que en niñas. Se caracteriza por niveles inadecuados desde el punto de vista del desarrollo de impulsividad, falta de atención e hiperactividad. Los síntomas se perciben en la primera infancia, generalmente antes de la escolarización, y se manifiestan en todos los entornos.
El término THDA actualmente se aplica a una amplia diversidad de niños con dificultades funcionales variables, que comparten el rasgo de la falta de atención sostenida. Algunos son muy impulsivos, otros agresivos y otros silenciosos e inquietos. En muchos casos hay baja autoestima. Entre los trastornos concurrentes se cuentan trastornos del lengua je, ansiedad, comportamientos de oposición o desafiantes, dificultades motoras y de coordinación fina y alteraciones específicas del aprendizaje. Casi todos los niños con THDA presentan déficit de memoria auditiva a corto plazo.
Valoración
La valoración de un niño diagnosticado de THDA requiere una serie de componentes, entre los que se cuentan:
- Historial detallado del desarrollo.
- Exploración física, neurológica y del neurodesarrollo.
- Datos detallados referidos a la escala de valoración conductual estandarizadas, como la escala de Conners para la valoración de padres y maestros (Goyette y cois., 1978), obtenidos de dos fuentes, generalmente el hogar y el colegio.
Tratamiento
El tratamiento de los niños con TDHA se centra en tres áreas:
- Conductual.
- Educacional.
- Farmacológica.
A estos niños también se les aplican otros enfoques, como la modificación de la dieta, terapias «naturales» o complementarias de diversa índole, y optometría conductual. Aunque en algunos casos se han comunicado mejoras en la evolución de los niños, las evidencias de que este tipo de recursos sean eficaces no son concluyentes.
La medicación psicoestimulante es el principal abordaje farmacológico del THDA. Los dos estimulantes más empleados son el metilfenidato y la dexametamina.
- Con ellos se registran mejoras clínicas en aproximadamente el 75% de los niños correctamente diagnosticados.
- El inicio de los efectos sobre el comportamiento se produce a los 30-60 minutos de la ingestión.
Otros fármacos empleados en el THDA son el antihipertensivo clonidina, antidepresivos (inhibidores de la captación de serotonina, inhibidores de la monoaminooxidasa reversibles y tricíclicos) y, ocasionalmente, neurolépticos.
Consecuencias odontológicas
Es probable que la visita al dentista aumente los niveles de ansiedad en cualquier niño y. consecuentemente, en sus padres. En el niño con THDA, la ansiedad se suele manifestar con estados de sobreexcitación. Muchos padres se preocupan por el efecto del comportamiento de sus hijos en los demás. A veces, los padres se habitúan al sentimiento de fracaso, al llevar a sus niños «difíciles» al dentista para que se les diga sólo que el tratamiento/asistencia no resulta posible. Ello puede dar lugar a que los padres se muestren excesivamente protectores/turbados, con constantes disculpas por la conducta de su hijo o con una actitud inadecuada, reprendiendo continuamente al niño durante la consulta. En tales situaciones es probable que el niño reaccione contra sus padres, dificultando el establecimiento de una relación positiva con el odontólogo.
El tratamiento satisfactorio de los niños con THDA se ve facilitado mediante la aplicación de estrategias similares a las utilizadas para otras discapacidades. En general, la probabilidad de éxito aumenta cuando el dentista toma el control de la situación de forma inmediata. Al crear una atmósfera de confianza, muchas veces se alivia la ansiedad de los padres y se favorece el establecimiento de una relación adecuada en un entorno más relajado. Así, un planteamiento amable pero firme aporta al niño sensación de confianza y genera una estructura de la situación en la que es más fácil la adaptación.
Para el odontólogo resulta útil conocer las estrategias utilizadas con el niño, tanto en casa como en el colegio. Por ejemplo, si a un niño se le suele indicar que levante la mano para hablar, es conveniente que en la consulta haga lo mismo. Se le deben dar instrucciones claras, manteniendo siempre contacto visual y no sobrecargando su memoria a corto plazo. Las instrucciones deben impartirse cuando el paciente no está distraído por otras actividades que se desarrollen en la consulta.
El método de «decir-mostrar-hacer» resulta eficaz en la orientación del comportamiento al tratar a niños con THDA. Los elogios y las frases de ánimo desempeñan un papel importante en el tratamiento de estos niños, por lo que la conducta adecuada siempre ha de ser alabada y recompensada.
Estrategias terapéuticas
- El patrón de la medicación vigente ha de ser comentado con los padres y con el médico que ha realizado la prescripción. Al planificar la visita al dentista, es con frecuencia útil modificar la dosis o el momento de tomar los fármacos para optimizar su efecto. También parece que las consultas en la mañana son más eficaces, aunque es posible que ello se relacione con el momento en el que se toma la medicación más que con cualquier otro factor.
- El enfoque preventivo resulta fundamental.
- Es importante ser conscientes de que muchos de estos pacientes se están esforzando por dominar otras capacidades.
- El cepillado de los dientes y el control de la dieta requieren concentración, motivación y conocimiento, elementos que pueden plantear dificultades para el niño con THDA. Los esquemas gráficos sobre cómo lavarse los dientes, con un calendario para la verificación del cumplimiento diario, son en general más efectivos que las instrucciones orales.
- La repetición es importante para reforzar la autoconfianza del pequeño. Varias visitas cortas son más adecuadas que pocas consultas largas.
- No obstante, es importante tener en cuenta que la salud oral es sólo una de las prioridades de la familia de un niño con THDA, por lo que las diversas exigencias que se les plantean a los padres han de sopesarse siempre en correlación con la necesidad de la asistencia dental.
Discapacidades del desarrollo y discapacidades intelectuales
Las discapacidades del desarrollo se definen como diferencias en las funciones de base neurológica, que se inician antes del nacimiento, o bien que aparecen durante la infancia y se asocian a problemas a largo plazo. Las personas que se consideran intelectualmente discapacitadas presentan un Cl inferior a 70, déficit en la función adaptativa e inicio de las manifestaciones antes de los 18 años.
El término discapacidad del desarrollo incluye a todas las personas con discapacidad intelectual, si bien ello no siempre es así. Por ejemplo, las personas con parálisis cerebral o autismo presentan discapacidad del desarrollo, pero no todas padecen disfunciones intelectuales.
Como en otros casos de tratamiento médico para niños con algún tipo de compromiso, la primera cita es aquella en la que el odontólogo se familiariza con el trastorno del niño y en la que éste hace lo propio con el entorno odontológico. Es necesario determinar las preferencias, aversiones y pautas de comportamiento del paciente, así como proporcionar apoyo verbal y dejar el tiempo suficiente para que se establezca una relación.
Debe recabarse una detallada historia médica. El retraso del desarrollo es un concepto amplio que se aplica a niños con un amplio espectro de trastornos y síndromes médicos. Es fundamental investigar los síndromes poco claros antes de proceder al tratamiento. Deben obtenerse fotocopias de los datos relevantes que hayan de incluirse en la ficha del niño.
El apoyo de los padres o cuidadores es extremadamente importante en el reforzamiento y la aportación de asesoramiento preventivo, las prácticas de higiene oral y la modificación de la dieta. Para desarrollar esta última, es conveniente consultar con el colegio o la institución a la que el niño asista.
Los niños con discapacidades intelectuales presentar una mayor incidencia de:
- Desgaste dental.
- Control inadecuado de la placa.
- Maloclusión.
- Lesiones traumáticas autoinducidas y bruxismo.
Tratamiento del desgaste dental permanente en pacientes con discapacidad intelectual
Ante los primeros indicios de desgaste dental deben obtenerse modelos de estudio, a fin de evaluar su evolución temporal. Sus causas han de determinarse y, si es posible, eliminarse. El reflujo gastroesofágico es frecuente en personas con discapacidades del desarrollo, que han de ser convenientemente controladas para proceder a derivación a gastroenterología cuando sea pertinente. La incidencia del bruxismo también es mayor en esta población, por lo que debe valorarse siempre que sea posible.
El desgaste dental sólo se trata mediante técnicas restauradoras cuando:
- Existe desgaste descontrolado y continuo.
- Hay pérdida de vitalidad o riesgo de la misma.
- Por cuestiones estéticas.
- Por cuestiones funcionales.
El tratamiento de elección es la restauración de los dientes desgastados con resina de composite de uso indirecto, con mínima preparación de los dientes. Cuando se trabaja con pacientes con discapacidad del desarrollo, para tomar de forma adecuada las impresiones y mantener el aislamiento para las técnicas de cementación son necesarias dos sesiones bajo sedación.
Tratamiento del control de placa inadecuado
Todos los pacientes con discapacidades intelectuales requieren la debida asistencia para mantener una higiene oral adecuada y prevenir la gingivitis. Los responsables del cuidado del niño han de ser instruidos en las técnicas necesarias para aplicar las medidas de higiene dental de forma segura y eficaz. Sin embargo, algunos pacientes presentan defensa táctil, por lo que son referidos a un logopeda para que les aplique un programa de desensibilización. Este tipo de programas incluyen masaje vibratorio y extraoral para tratar las reacciones de defensa táctil.
Maloclusión
En personas con discapacidades intelectuales es elevada la incidencia de hipotonía e hipertonía de la musculatura oral. Estos pacientes también presentan a veces hábitos orales inusuales, como protrusión de la lengua, que dan lugar a maloclusiones. Numerosos pacientes con déficit intelectual toleran bien la ortodoncia convencional, con el nivel de apoyo oportuno. No obstante, para los pacientes que exhiben comportamientos problemáticos, la ortodoncia convencional no es a menudo viable. Todos los niños con discapacidad intelectual que desarrollan maloclusión en la fase de dentición mixta deben ser examinados por un ortodoncista, para que evalúe las pertinentes medidas ortodóncicas interceptivas que atenúen esa maloclusión.
Bruxismo
Muchos padres y cuidadores solicitan asistencia odontológica para tratar el bruxismo, o rechinar de dientes, y el consiguiente riesgo de lesiones dentarias. El problema puede generar inquietud a familiares, cuidadores y educadores, debiendo evaluarse la posibilidad de que el comportamiento sea una forma de llamar la atención, por ejemplo, por el cambio en las circunstancias familiares. El bruxismo puede ser fisiológico o patológico.
Bruxismo fisiológico
- A menudo se produce en períodos de concentración o por la noche, durante el sueño, aunque puede registrarse en cualquier momento.
- Se inicia durante la primera fase del desarrollo de la dentición primaria, casi siempre una vez que han erupcionado los primeros molares.
- Suele disminuir una vez que los dientes primarios se exfolian.
- No suele ser necesario más tratamiento que el apoyo de los familiares.
- Si el desgaste es excesivo y amenaza la exposición pulpar, es necesario proceder a extracción o restauración de las piezas dañadas.
- No es habitual que el fenómeno refleje una afección sistémica generalizada, y los antropólogos dentales lo relacionan con una forma ancestral de «afilado de los dientes» denominada tegosis.
Bruxismo patológico
- En este caso, el alcance del desgaste supera los límites que pueden considerarse normales. Los niños pueden llegar a perder la mitad de la altura de la corona en los dientes superiores anteriores. La pérdida generalizada de esmalte con facetas de desgaste y exposición de la dentina es en cambio inusual en los dientes posteriores.
- Se registra a menudo en niños con trastornos neurológicos o problemas médicos, como síndrome de Down, parálisis cerebral o lesión craneal.
- El aumento en la intensidad del bruxismo en estos niños puede ser indicativo de otros trastornos, como otitis, infección de las glándulas salivales o dolor generalizado en otra parte del cuerpo.
Tratamiento del bruxismo
- Cuando se ha producido pérdida importante de la estructura dental en la dentición primaria, es esencial controlar los posibles cambios en los primeros molares permanentes. A veces, el tratamiento implica implantación de coronas de acero inoxidable en los segundos molares primarios. Ello no se hace sólo para proteger los dientes permanentes, sino también para preservar la dimensión vertical de la oclusión y tender a reducir el bruxismo.
- El rechinar de dientes asociado a automutilación de los tejidos blandos es muy difícil de tratar; algunas estrategias al respecto se analizan en el capítulo 8.
- Cabe indicar que cuando, en los casos más graves, se contempla la extracción de dientes permanentes, finalmente pueden llegar a perderse todos los dientes. Para estos casos de bruxismo y automutilación no tratables, la extracción de sólo alguno de los dientes (anteriores) acaba invariablemente con la extracción de todos los dientes de la arcada.
Deterioro de la visión
Es necesario permitir que el niño haga pleno uso de su sensibilidad táctil y su olfato para familiarizarse con el entorno o las técnicas odontológicas.
Una vez establecida una relación adecuada, es necesario tranquilizar al paciente física y verbalmente, ya que es posible que no pueda ver nuestra sonrisa.
Se deben facilitar medios para que el paciente se haga una imagen mental, describiendo el tratamiento y el entorno en el que se desarrolla la técnica. Si se introducen instrumentos en la boca del paciente sin previo aviso, es posible que se generen reflejos de sobresalto.
Muchas de las personas que padecen deterioro de la visión presentan fotofobia. Es importante consultar a padres y niños sobre la sensibilidad a la luz. Las gafas de seguridad deben ser preferiblemente tintadas.
Deterioro de la función auditiva
Es necesario investigar cómo se comunica el niño.
Un error frecuente es hablar más alto en vez de hacerlo más lentamente. Si el paciente lee los labios, es aconsejable hablar frente a él, con claridad y despacio.
Es conveniente tener nociones básicas del lenguaje de signos, siendo consciente de que en los distintos países se emplean signos diferentes.
Es importante mantener siempre contacto visual, ya que estos niños pueden sobresaltarse si se les toca sin ese contacto visual previo.
Los niños sordos son en general muy sensibles a las vibraciones, por lo que los tornos, tanto de alta como de baja velocidad, han de manejarse con cuidado.
Cuando el niño usa audífono es necesario ajustar el volumen. Al maniobrar con los antebrazos debe evitarse el bloqueo de los oídos o del aparato, que puede acoplarse.
Disfunción oromotora en pacientes con discapacidad de desarrollo
Los niños con parálisis cerebral y retraso generalizado del desarrollo presentan con frecuencia disfunciones orales, entre las que se cuentan:
- Hipertonía.
- Hipotonía.
- Disfagia, dificultad de deglución.
- Disfasia, dificultad para hablar.
- Sialorrea, dificultad para deglutir la saliva.
Babeo
Los padres a menudo se muestran preocupados por la excesiva salivación del niño. El odontólogo pediátrico desempeña un papel destacado en el tratamiento de la sialorrea.
Las posibles opciones al respecto son:
- Eliminación de factores agravantes (caries, maloclusiones).
- Derivación a un equipo multidisciplinar para tratar la función oromotora.
- Tratamiento farmacológico.
- Cirugía.
Tratamiento quirúrgico
- Reconducción del conducto submandibular hacia el pilar tonsilar posterior.
- En el 70% de los casos se obtienen resultados buenos o excelentes.
Riesgos y efectos secundarios
- Formación de ránula.
- Pérdida de la glándula.
- Aumento del riesgo de caries.
- Aspiración de saliva por la disfagia.
Agentes farmacológicos
- Benzatripina.
- Clorhidrato de trihexifenidilo (clorhidrato de benzhexol).
- Parches transdérmicos de escopolamina.
- Glucopirrolato.
- Toxina botulínica A.
Los efectos secundarios de los fármacos son:
- Xerostomia.
- Caries dental.
- Retención de orina.
- Sofocaciones.
- Sequedad de las membranas mucosas.
- El trihexifenidilo puede dar lugar a cambios de comportamiento.
Tratamiento de la función oromotora
El tratamiento de la función oromotora es aplicado por equipos multidisciplinares integrados por logopedas, terapeutas ocupacionales, fisioterapeutas y dentistas. Su objetivo se centra en desarrollar las capacidades orales necesarias para controlar la saliva. Este enfoque multidisciplinar incorpora diversos elementos, como:
- Modificación del comportamiento.
- Favorecimiento neuromuscular propioceptivo.
- Adaptaciones posturales.
- Pantallas orales y aparatos dentales diseñados para estimular la musculatura oral.
Aparatos dentales
Son dispositivos diseñados para cada caso individual, para generar el movimiento apropiado de lengua, labios o mandíbula (fig. 10.12). Entre sus objetivos se cuentan los siguientes:
- Establecimiento de una posición correcta de la lengua.
- Estimulación del cierre de los labios.
- Estimulación de la elevación y la lateralización de la lengua.
- Estimulación de la estabilización de la mandíbula.
- Reducción del comportamiento oral.
Trastorno de espectro autista
El trastorno de espectro autista (TEA) se define como una alteración grave del desarrollo caracterizada por la clásica tríada de:
- Problemas de comunicación.
- Problemas de socialización.
- Patrones de conducta repetitivos y restringidos.
Aunque el TEA es de origen genético, hay algunos aspectos de su etiología que no son bien conocidos. Se trata también de una alteración biológica, con numerosos elementos asociados. El 70% de las personas afectadas presentan dificultades de aprendizaje moderadas o graves, algunas tienen niveles de serotonina elevados y pueden padecer otros cuadros concurrentes, como síndrome del cromosoma X frágil, síndrome de Rett, fenilcetonuria o epilepsia.
El tratamiento de niños autistas supone un importante desafío para el odontólogo pediátrico, por el comportamiento y los problemas de comunicación del paciente. Entre los problemas a él asociados se cuentan:
- Deterioro de la comunicación: los problemas de lenguaje y comunicación pueden hacer necesarios medios como el Makaton o el Sistema de Comunicación por Intercambio de Imágenes (conocido por sus siglas inglesas, PECS).
- Comportamiento errático e impredecible; algunos niños presentan rasgos de THDA.
- Ausencia de contacto visual, ausencia de «teoría de la mente» y sentido del humor.
- Uso previo de fármacos; algunos de ellos pueden ser cariogénicos e inducen sequedad de boca.
- Traumatismos asociados a epilepsia.
- Diagnóstico tardío de la enfermedad y, en consecuencia, retraso en el abordaje asistencial.
- Procesamiento anómalo de la información sensorial; muchos pacientes son hipo o hipersensibles a estímulos olfativos, visuales, sonoros o táctiles.
- Problemas en tratamientos, restricciones dietéticas, rechazo del fluoruro o la amalgama, uso de dulces como medio de recompensa ante el buen comportamiento como parte del abordaje conductual.
- Hábitos alimentarios peculiares.
- Ansiedad; tanto el niño como los padres pueden presentarla ante la visita al dentista.
Tratamiento clínico
Aunque la prevención es el elemento clave para tratar a un niño con necesidades especiales, ello adquiere singular relevancia en los pacientes con espectro autista. La anestesia local y la sedación por inhalación se limitan a los niños con mejor estado funcional, en los que la comunicación no está excesivamente comprometida.
La anestesia general es la pauta más habitual, sobre todo en niños de cierta edad con enfermedad grave. Es evidente que el tratamiento ha de ser definitivo e integral, incorporando elementos preventivos y curativos.
Puntos importantes del tratamiento
- Consolidar las pautas de cepillado dental lo antes posible es esencial en estos niños, no sólo por su salud dental, sino porque es la mejor manera de comenzar una exploración dental.
- Es conveniente emplear enfoques centrados en el comportamiento, como el análisis conductual aplicado, para establecer los patrones de cepillado.
- Debe tenerse en cuenta que, a veces, no es el propio cepillado lo que produce el rechazo del niño, sino el dentífrico. Conviene experimentar con nuevos sabores.
- Algunos niños ecolálicos son capaces de palabras y expresiones. Cuando se trate a uno de ellos puede indicarse a los padres que le animen a emitir el sonido «aaa» con la boca abierta, lo que ayudará a los propios padres en el cepillado, al dentista en el examen visual de los dientes y al médico en la exploración de la garganta del niño. El sonido «iii» puede hacer que el paciente muestre los bordes gingivales anteriores, a los que a veces es difícil tener acceso visual.
- Dada la frecuente asociación de autismo y epilepsia, es conveniente vigilar activa y rutinariamente posibles signos de traumatismos.
- Optimice el rápido contacto con los familiares por medio de las redes sanitarias locales y los equipos de desarrollo.
- Familiarícese con los distintos medios de ayuda a la comunicación que el niño maneja. Un conjunto de fotografías o dibujos puede disponerse en serie para que el niño esté dispuesto para la visita al dentista. Ello atenúa la ansiedad y hace que los acontecimientos sean más predecibles para el niño.
- Las visitas frecuentes hacen que el odontólogo tenga oportunidad de saber más sobre el niño y proporcione asistencia preventiva.
- Envíe una carta de tipo cuestionario previa a la cita y un folleto informativo sobre la misma.
- Optimice la comunicación, por ejemplo, colocándose en una posición en la que el niño pueda verle y usted pueda requerir su atención pronunciando su nombre antes de cada frase. El lenguaje utilizado debe ser lo más sencillo posible y es necesario hablar lentamente. También es importante atenuar al mínimo el ruido de fondo en la consulta.
- El asesoramiento nutricional ha de adecuarse a cada caso específico. Si se están utilizando complementos nutricionales, los más recomendables son las barritas energéticas sin azúcar. También debe recomendarse el consumo de dulces sin azúcar.
- Los niños extraordinarios necesitan dentistas extraordinarios. Los odontólogos pediátricos que trabajen a menudo con este tipo de pacientes deben sentir interés por los casos especiales, ser flexibles en sus planteamientos y estar preparados para afrontar el desafío que estos niños suponen.
Genética y dismorfología
Diagnóstico
Aunque no es frecuente, es posible que a la consulta odontológica acudan niños con alteraciones genéticas, con anomalías asociadas a las mismas o problemas médicos que compliquen el tratamiento dental. No debe darse por supuesto que todas las afecciones de esta índole han sido ya diagnosticadas antes de la presentación de los niños. De hecho, no son pocos los casos en los que las enfermedades genéticas se diagnostican en una fase avanzada de la infancia, bien porque el trastorno tenga manifestaciones tardías o, simplemente, porque sus síntomas han sido pasados por alto. Al recabar la historia médica, siempre es útil trazar un sencillo árbol genealógico de tres generaciones (fig. 10.13).

Son varios los trastornos que no siguen patrones de herencia mendeliana, aunque son claramente de origen «familiar» o genético. Numerosas enfermedades quedan encuadra das en esta categoría; a menudo no se trata de entidades aisladas, sino de cuadros heterogéneos que son el resultado último de múltiples efectos genéticos desarrollados en contra de un entorno ambiental variable (multifactorial o poligénico). Tal es el caso del labio leporino o el paladar hendido.
Uno de cada 170 nacidos vivos presenta una anomalía cromosómica importante. Las alteraciones cromosómicas, en particular las que afectan al equilibrio de los autosomas, suelen dar lugar a retraso del desarrollo y rasgos dismórficos, y con frecuencia suponen anomalías multisistémicas. Entre ellas se cuentan trastornos numéricos (como la trisomía 21 o síndrome de Down), y trastornos estructurales, tales como deleciones segmentarias (como el síndrome del maullido de gato), duplicaciones y translocaciones. Las alteraciones numéricas cromosómicas son mejor toleradas que las autosómicas e incluyen ejemplos tales como el síndrome de Turner en mujeres y el síndrome de Klinefelter en varones. Muchos otros trastornos genéticos son causados por mutaciones en los genes, que no pueden ser detectadas por análisis cromosómico, aunque sí se identifican mediante pruebas genéticas específicas una vez que el síndrome se ha reconocido (v. tabla 10.1).
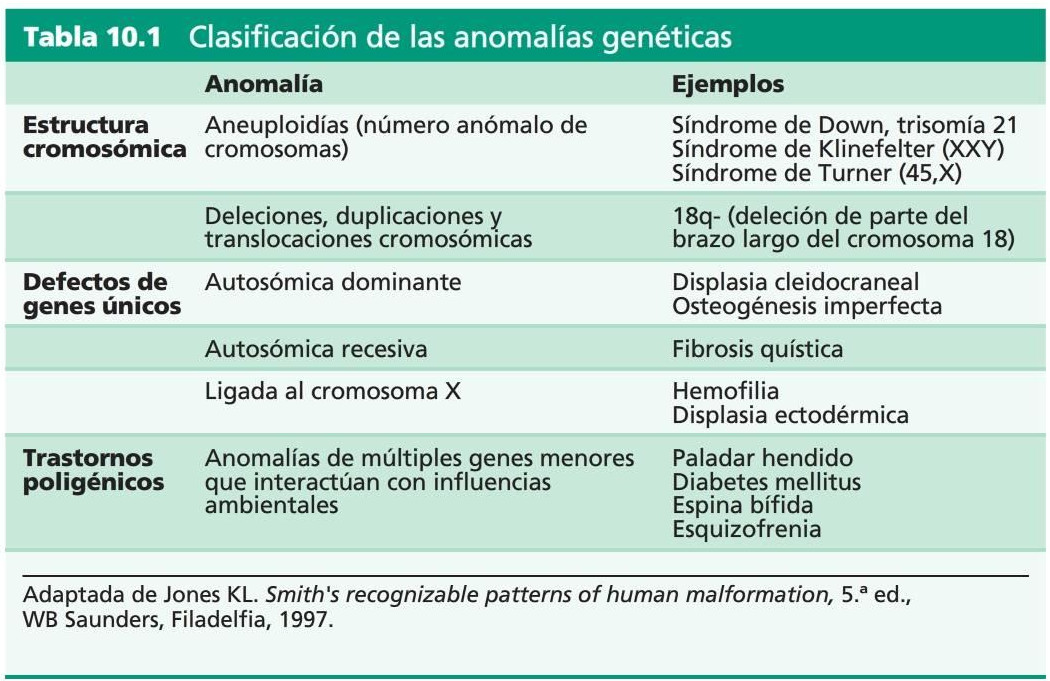
El primer paso para establecer el diagnóstico es el reconocimiento de que el niño es dismórfico o presenta aspecto inusual. Tal es el patrón de la propia dismorfología, más que un rasgo singular que ayude al diagnóstico. La precisión del diagnóstico es la clave del pronóstico, el tratamiento y, en ocasiones, la determinación de la causa subyacente del trastorno. Dicho diagnóstico también a ayuda a los padres a atenuar la ansiedad que genera la incertidumbre por la etiología y el pronóstico.
El procedimiento diagnóstico incluye consecución de la historia, exploración clínica e investigaciones de laboratorio. En función de la información recabada a través de ellas, los niños pueden diferenciarse en tres grupos, los que presentan:
- Síndromes ambientales fetales.
- Defectos del desarrollo.
- Síndromes genéticos.
Si no es posible establecer un diagnóstico puntual, es conveniente consultar la literatura sobre dismorfologías o un banco de datos electrónicos sobre síndromes de esta índole (POSSUM, www.possum.net.au) e investigar un posible diagnóstico en virtud de los rasgos expresados. Las investigaciones de laboratorio incluyen revisión radiológica, análisis cromosómico, valoración selectiva de sangre y orina, o cultivo de fibroblastos para la detección de deficiencias proteicas o enzimáticas específicas si se sospecha de un posible trastorno metabólico. A menudo se requiere la derivación a una clínica especializada en genética, a fin de determinar un diagnóstico con pruebas y asesoramiento genéticos especializados.
En la presente sección no se pretende detallar las anomalías que implican manifestaciones craneofaciales u orofaciales de alcance y que entran en el ámbito de interés de los odontólogos. Se remite al lector a textos y fuentes online específicas que se ocupan de este tipo de afecciones (v. Bibliografía y lecturas complementarias).
Términos empleados enmorfogénesis
Secuencia
Una secuencia es un patrón de múltiples anomalías secundario a un solo suceso o defecto estructural. Generalmente, se origina en la fase inicial del desarrollo con problemas específicos que generan anomalías secundarias y se manifiestan con déficits en el nacimiento o con posterioridad. Las secuencias pueden diferenciarse en tres grupos básicos:
- Secuencia de malformación:
- Formación de tejidos inadecuada.
- Puede ser única o múltiple, constando en cualquier caso de anomalías estructurales primarias.
- Mal pronóstico en lo que respecta al crecimiento normal de las áreas afectadas.
- Tasa de recurrencia del 1-5%.
- Ejemplo: paladar hendido.
Las malformaciones pueden presentarse como:
- Tejidos accesorios (ej. polidactilia, pólipos periauriculares).
- Hamartomas (ej. hemangioma/linfangioma).
- Morfogénesis incompleta:
- Agenesia (ej. agenesia de las glándulas salivales).
- Hipoplasia (ej. hipoplasia del esmalte en la amelogénesis imperfecta).
- Tabicación incompleta (ej. defecto septal ventral (DSV).
- Migración incompleta del ectomesénquima (ej. asociación de Di George).
- Ausencia de muerte celular (apoptosis) (ej. espina bífida, paladar hendido, sindactilia).
- Secuencia de deformación:
- Fuerzas inusuales que actúan sobre tejidos normales, generalmente por presiones intrauterinas anómalas.
- Buen pronóstico de crecimiento normal y bajo riesgo de recidiva.
- Ejemplos:
- Pie equinovaro.
- Micrognatia.
- Tortícolis.
- Secuencia de disrupción:
- Destrucción o descomposición de tejido normal, debida a causas vasculares, infecciosas o físicas.
- Bajo riesgo de recidiva, mal pronóstico de crecimiento normal en áreas afectadas.
- Ejemplos:
- Sordera por rubéola congénita.
- Hendidura facial por bandas amnióticas.
- Microsomia hemifacial (por hemorragia de la arteria estapedial).
Síndrome
- Patrón reconocible de malformación.
- Déficits múltiples por patogenia asociada, derivada directamente de una causa concreta (genética o adquirida).
Asociación
- Desarrollo no aleatorio de diversas alteraciones morfológicas no identificadas como síndrome o secuencia.
- Bajo riesgo de recurrencia.
- Ejemplos: asociación VATER (V, anomalías vertebrales con DSV; A, atresia anal; TE, fístula traqueoesofágica; R, displasia radial y renal).
Riesgo de recurrencia en los trastornos genéticos
Herencia autosómica dominante
Existe un riesgo del 50% para cada uno de los hijos de un progenitor afectado. Muchas alteraciones dominantes presentan una expresión variable, por lo que sus manifestaciones pueden ser más o menos importantes que las del progenitor. También se registran nuevas alteraciones genéticas dominantes.
Autosómica recesiva
Los portadores no expresan el carácter. Si ambos progenitores son portadores, el riesgo de afectación del niño (homocigótico; el carácter sería expresado) es del 25%; el riesgo de ser portador es del 50%, y la probabilidad de ni estar afectado ni ser portador es del 25%. Si uno de los progenitores es portador, el riesgo de que el niño sea portador es del 50%.
Ligada al cromosoma X (ligada al sexo)
- Un 50% de riesgo de transmisión por mujeres portadoras a los hijos (que resultarían afectados) o las hijas (que serían portadoras).
- Sin transmisión masculina de padre a hijo, aunque todas las hijas son portadoras.
Los términos «recesivo ligado al cromosoma X» y «dominante ligado al cromosoma X» se emplean para describir enfermedades ligadas al sexo con alteración de la frecuencia de la expresión fenotípica. Generalmente, los varones tienen un solo cromosoma X. Los que presentan una anomalía relacionada con dicho cromosoma se definen como hemicigóticos para ese carácter y resultarán afectados. Las mujeres suelen tener dos cromosomas X y las portadoras de un carácter ligado al cromosoma X son heterocigóticas. En los trastornos recesivos ligados al cromosoma X, las mujeres portadoras pueden no resultar afectadas, o bien serlo con mucha menos gravedad que los varones. En ocasiones poco frecuentes, las mujeres son homocigóticas para un carácter ligado al cromosoma X, por lo que resultan afectadas con la misma gravedad que los varones hemicigóticos. Los caracteres dominantes ligados al cromosoma X se manifiestan en mujeres y varones, aunque éstos suelen presentar mayor grado de afectación.
El grado de expresión fenotípica en mujeres heterocigóticas es determinado por el patrón de la inactivación del cromosoma X (lyonización: v. cap. 9) en cada tejido. Por ejemplo, las mujeres portadoras de la hemofilia A presentan una reducción medible (subclínica) del factor VIII, y las que son portadoras de displasia ectodérmica hipohidrótica también pueden mostrar cierta variación fenotípica en la dentición, con rasgos como microdontia u oligodontia, pero no en la misma medida que los varones. El incremento de la frecuencia de mujeres afectadas por ciertas afecciones dominantes ligadas al cromosoma X, como la incontinencia pigmentaria o la hipoplasia dérmica focal (síndrome de Goltz-Gorlin) puede deberse a la letalidad de estas mutaciones en varones hemicigóticos.
Pruebas prenatales de anomalías genéticas
Ecografía
La ecografía se ha convertido en prueba de rutina en la mayoría de los embarazos. No es invasiva ni para la madre ni para el feto, y permite diagnosticar múltiples alteraciones. Entre las técnicas ecográficas habituales cabe mencionar la medida de la translucencia nucal (TN) en el primer trimestre (para evaluar el riesgo de síndrome de Down) y la evaluación de la morfología fetal en el segundo trimestre.
Amniocentesis
Es la toma de muestras de células del líquido amniótico a las 15-18 semanas. Con ella pueden realizarse pruebas como:
- Obtención del cariotipo.
- Determinación del sexo.
- Diagnóstico de ADN.
- Ensayos enzimáticos.
Muestras de vellosidades coriónicas
Esta prueba se realiza antes que la amniocentesis, a las 10-12 semanas. Las pruebas que permite realizar son similares a las de amniocentesis, aunque con la ventaja de su anticipación.
Valoraciones de población
- Niveles maternos de alfafetoproteína en el segundo trimestre para detectar defectos del tubo neural.
- Prueba triple en suero materno para valoración del riesgo de síndrome de Down.
- Valoración de suero materno en el primer trimestre (combinada con TN) para evaluación del riesgo de síndrome de Down.
Pruebas posnatales
Citogenética
Para todos los niños con rasgos dismórficos o anomalías múltiples.
Análisis del ADN
Para trastornos específicos; detección directa de mutaciones o análisis de correlación genética.
Pruebas de d etección neonatales
Varias son las pruebas de detección de anomalías que se realizan en cada país, aunque suelen registrarse notables variaciones entre ellas. Algunas de las más comunes son las de:
- Fenilcetonuria.
- Fibrosis quística.
- Hipotiroidismo congénito.
- Galactosemia.
- Talasemia.
- Drepanocitosis.
- Aminoacidopatías.
- Acidemias orgánicas.
- Defectos de la oxidación de ácidos grasos.
Asesoramiento genético
El asesoramiento genético es el proceso a través del cual se aportan valoraciones diagnósticas, información y apoyo a familias o personas que se enfrentan a defectos neonatales, o tienen algún riesgo de hacerlo, anomalías cromosómicas o enfermedades hereditarias. Esta disciplina, en la que hay especialistas en clínica y en asesoramiento genéticos, comprende valoración médica e investigación, interpretación de la información referida al trastorno, análisis de los patrones de herencia y riesgo de recurrencia y revisión de las opciones terapéuticas con la familia. Los especialistas en esta área se encargan también de prestar apoyo a familias y personas y, cuando procede, de referirlos a grupos o servicios de apoyo.
Tratamiento odontológico
El objetivo del tratamiento odontológico ha de ser el de integrarse en el equipo que presta asistencia al niño. Se orienta a reducir las consecuencias discapacitantes de la alteración. Los abordajes restauradores o quirúrgicos de la disfunción dental específica (ej. hipoplasia del esmalte o hipodontia) han de considerarse en el marco de un plan terapéutico a largo plazo. Éste puede comprender diferentes áreas, como ortodoncia, periodoncia, cirugía oral y odontología restauradora, integradas en un programa conjunto. El éxito global del tratamiento se evalúa en virtud de la rehabilitación total del niño y sus consecuencias en la familia.