Enterocolitis Necrosante
La enterocolitis necrosante o necrotizante (ECN) es una lesión intestinal, más o menos extensa y devastadora, que constituye la enfermedad quirúrgica más frecuente en las unidades de cuidados intensivos neonatales. Su incidencia oscila entre el 2 y el 5% de los niños ingresados en estos centros, siendo el 90% de los afectados RN pretérmino. La mortalidad se estima en alrededor del 25% y es mayor cuanto menor edad gestacional tiene el paciente.
Etiología
Aunque la ECN es conocida desde hace décadas, su etiología no ha sido completamente definida. A lo largo de los años se han postulado varios agentes etiológicos, pero hoy está ampliamente aceptado que son cuatro los factores fundamentales de riesgo que predisponen a la ECN: prematuridad, alimentación enteral, isquemia/hipoxia y colonización bacteriana.
El nacimiento prematuro y el aporte alimenticio tienen un papel importante en el desarrollo de la enfermedad, ya que el 90% de los afectados nacen antes de la semana 37 de gestación y han recibido alimentación.
Estos niños presentan inmadurez de la función intestinal con alteración de la barrera mucosa, que puede producir una malabsorción de los carbohidratos con aumento del gas y la presión intraluminal, disminuyendo el flujo vascular a la pared del intestino. La lactancia materna disminuye la incidencia de ECN. El mecanismo protector puede atribuirse a la presencia en la leche materna de la enzima antagonista del factor de activación plaquetaria y eritropoyetina, reguladores ambos del estrés inflamatorio y ausentes en las fórmulas lácteas. En el momento actual se estudia la posibilidad de que la duración de la alimentación trófica y el ritmo de avance del aporte oral puedan modificar los factores de riesgo de la ECN.
Existen numerosos estudios epidemiológicos que relacionan la isquemia intestinal primaria con la ECN. Hay varios trastornos que pueden provocarla, como la hipotensión, asfixia perinatal, poliglobulia, persistencia del conducto arterioso, consumo materno de cocaína en el embarazo, cateterización de los vasos umbilicales y la restricción mantenida del flujo sanguíneo que ocurre en niños con bajo peso para la edad gestacional. Se han descrito brotes de ECN con características epidemiológicas, pero no se ha demostrado un único microorganismo responsable.
Sólo un 30% de los que desarrollan la enfermedad tienen el hemocultivo positivo y generalmente son gérmenes pertenecientes a la flora entérica.
En resumen, diferentes mecanismos pueden activar la cadena fisiopatológica con el mismo resultado final: isquemia y necrosis intestinal, lo que sugiere la posibilidad de una etiología multifactorial.
Fisiopatología
El paso final y fundamental de la ECN es la isquemia intestinal, a la cual se llega a través de complejos mecanismos que comportan la intervención de factores desencadenantes que, por acción de unos mediadores endógenos, activan la cadena inflamatoria. El factor de activación plaquetaria (FAP) parece jugar un papel fundamental en el inicio del proceso, produciendo la migración de polimorfonucleares hacia las vénulas de la mucosa intestinal, estimulando una serie de agentes proinflamatorios y citocinas (prostaglandinas, C4, factor de necrosis tumoral y leucotrienos).
Todos estos mediadores aumentan la noradrenalina endógena, con la consiguiente vasoconstricción isquémica, que es el principal sustrato de la lesión anatomopatológica. La isquemia provoca la migración bacteriana con producción de endotoxinas que favorecen el aumento del FAP y mantienen un círculo constante que agrava la enfermedad. En niños con ECN, el FAP está aumentado mientras que su enzima antagonista, el FAP acetil-hidrolasa, está disminuido o ausente. Existen factores bloqueantes endógenos, como el óxido nítrico, la eritropoyetina y la arginina, o exógenos, como los probióticos. El disbalance entre los factores activadores y los bloqueantes es lo que explicaría la aparición y gravedad de la enfermedad.
Clínica
La edad de comienzo de la enfermedad guarda una relación inversa con la edad gestacional. Suele debutar en la primera o segunda semana de vida, aunque no es excepcional la presentación más tardía en RNP de muy bajo peso. Se han descrito casos de inicio precoz en RN a término. La presentación clínica puede ser lentamente progresiva o súbita con deterioro fulminante. En la enfermedad larvada, la sintomatología inicial suele ser inespecífica (intolerancia digestiva, irritabilidad, apneas) asociando posteriormente distensión abdominal, palpación dolorosa y cambios en el patrón de las heces.
El cuadro de inicio agudo presenta un deterioro clínico grave y rápidamente progresivo. Se produce afectación del estado general, inestabilidad hemodinámica, térmica y respiratoria, distensión abdominal y, frecuentemente, heces sanguinolentas. Asocia una respuesta inflamatoria sistémica que puede confundirse con un choque séptico, al presentar graves alteraciones circulatorias, acidosis mixta y coagulación intravascular diseminada. La exploración abdominal puede mostrar una distensión o una zona de eritrosis localizada. Por palpación, puede demostrarse la reacción peritoneal, por la presencia de dolor y, a veces, de una masa en la zona lesionada.
Diagnóstico
La sospecha clínica de ECN se confirma mediante estudios radiológicos seriados. La dilatación intestinal generalizada es el signo radiológico más precoz. Puede presentar otros signos inespecíficos iniciales como el engrosamiento de la pared de las asas intestinales o la presencia de líquido libre en el peritoneo. De modo más tardío, pueden observarse signos más específicos de ECN como la neumatosis intestinal (aire intramural) (Fig. 2.24.2).
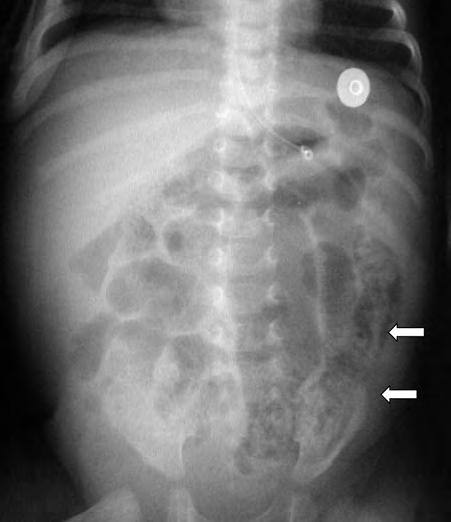
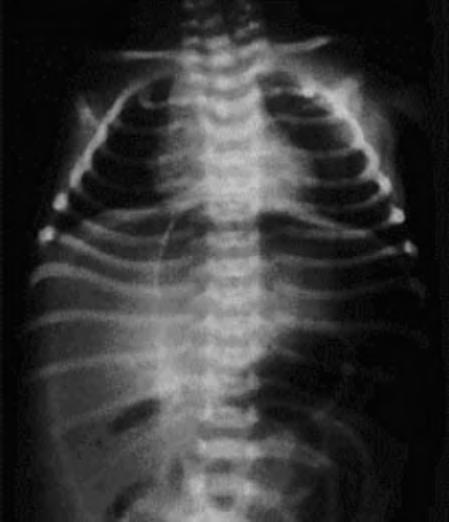
Es importante comprobar la presencia de otros signos radiológicos que pueden indicar una evolución tórpida con presencia de un asa intestinal fija, extensión de la neumatosis a la circulación venosa portal o la presencia de neumoperitoneo (Fig. 2.24.3).
Es de utilidad la radiografía abdominal en decúbito lateral con rayo horizontal, que permite detectar pequeñas colecciones de aire libre, que podrían pasar desapercibidas en la proyección antero-posterior. La ecografía abdominal puede tener valor en casos dudosos al visualizar, de modo más precoz que la radiografía simple, signos de ECN. Hay estudios que sugieren que estos hallazgos pueden ser de utilidad, no sólo en predecir la evolución de la enfermedad sino, también, en orientar y adelantar el tipo de tratamiento.
Bell y cols. presentaron un sistema de clasificación por estadios, según la evolución clínica y radiológica de la enfermedad. Posteriormente fue modificado por Walsh y Kliegman, quienes propusieron una base para la toma de decisiones terapéuticas según la etapa clínica de la enfermedad:
- Estadio I, signos y síntomas clínicos de sospecha con radiología inespecífica.
- Estadio II, signos y síntomas definidos con neumatosis intestinal en la radiografía.
- Enfermedad leve.
- Enfermedad moderada con toxicidad sistémica.
- Estadio III, enfermedad avanzada y con estado grave.
- Perforación intestinal inminente.
- Perforación intestinal demostrada.
Otras escalas, como la Duke Abdominal Assesment Scale, determinan con una puntuación de 0 a 10 los hallazgos radiológicos anómalos en neonatos con sospecha clínica de ECN. Estas manifestaciones, junto con la sintomatología, pueden orientar la necesidad y el tipo de tratamiento.
Las zonas más frecuentemente afectadas por la ECN son el íleon y el colon ascendente, aunque puede existir una afectación de todo el intestino en los casos más graves. El examen anatomopatológico de la porción de intestino extirpada, en las primeras fases, muestra edema de la mucosa, hemorragia y necrosis intestinal. Cuando la enfermedad progresa, la hemorragia, la inflamación y la necrosis se extienden a todo el espesor de la pared intestinal. Los cambios reparadores observados (regeneración epitelial, formación de tejido de granulación y fibrosis) indican que la enfermedad evolucionó durante varios días antes de la intervención.
Diagnóstico diferencial
Debe hacerse con infecciones sistémicas o intestinales, íleo paralítico u otros cuadros obstructivos abdominales, trombosis vascular y, sobre todo, con la perforación intestinal aislada del RNP de muy bajo peso, que durante mucho tiempo no se diferenciaba de la ECN y que recientemente ha quedado definida como una entidad separada. Los defectos congénitos de la muscular intestinal, la isquemia intestinal, los agentes infecciosos y medicaciones, como la indometacina y la dexametasona, parecen relacionarse con este proceso. La presencia de neumoperitoneo sin imagen de neumatosis, ni otras alteraciones aparentes, apoya el diagnóstico (Fig. 2.24.3). La lesión suele ser única a nivel del íleon terminal, siendo normal el resto del intestino.
Prevención
La mejor profilaxis de la ECN es evitar el parto prematuro pero, si éste es inminente, la administración de corticoides prenatales, que es obligada para inducir la madurez pulmonar, hace disminuir también las tasas de ECN. Debe recomendarse y facilitar siempre la lactancia materna. Los resultados obtenidos con otros tratamientos preventivos, como la administración de eritropoyetina, factor de crecimiento epidermal, e inmunoglobulinas, han sido dispares, siendo precisos más estudios antes de poder recomendarlos. Sin embargo, se ha estudiado más la administración de probióticos orales para la prevención de la ECN. La patogenia de esta enfermedad es multifactorial, pero se sabe que la colonización bacteriana desorganizada puede resultar decisiva en el desarrollo de la misma.
Los probióticos son organismos vivos, bacterias anaerobias que pueden mejorar la defensa intestinal a través de la regulación de los patrones de colonización: secreción mucosa de IgA, reacción inflamatoria y proliferación celular. Varios trabajos recientes han demostrado la acción beneficiosa de los probióticos en la disminución de la incidencia y la gravedad de la ECN; sin embargo, son necesarios más estudios para documentar su seguridad en términos de sepsis secundarias a los mismos, resultados del neurodesarrollo y función inmune a largo plazo.
Tratamiento
Tratamiento médico
Debe instaurarse pronto ante la sospecha de ECN. El objetivo es evitar la progresión de las lesiones y corregir la respuesta sistémica asociada a la enfermedad. Se debe suspender la alimentación enteral y descomprimir el estómago con una sonda orogástrica abierta o conectada a un dispositivo de aspiración intermitente. Conviene reponer el aspirado con suero 2/3 salino, para reponer el agua y cloro perdidos en el líquido aspirado. Tras toma de cultivos, debe iniciarse antibioterapia sistémica que cubra los microorganismos predominantes en cada UCIN. La mayoría de los autores consideran que la ampicilina y un aminoglucósido pueden ser una alternativa inicialmente adecuada. Se añadirá una cobertura para gérmenes anaerobios si el cuadro es grave o existe sospecha de perforación intestinal. Es preciso un estricto control de la función renal, por la frecuente asociación de choque hipovolémico por pérdidas de líquidos y proteínas al tercer espacio abdominal. Se deben administrar líquidos suficientes para mantener la diuresis y aportar solutos para mantener el equilibrio ácido-básico e hidroelectrolítico. Puede ser necesario utilizar fármacos vasoactivos y respiración asistida, para mejorar el gasto cardiaco y la oxigenación tisular y, más específicamente, la mesentérica. Se mantendrá un valor de hematocrito óptimo, para mejorar la capacidad transportadora de oxígeno de la sangre; se corregirá la posible coagulopatía de consumo con plasma fresco, y la trombocitopenia con plaquetas.
La ECN está considerada, por las guías para el tratamiento del dolor en RN, como una de las causas más importantes de mismo. Se administrará la analgesia necesaria y adecuada a la situación clínica.
Tratamiento quirúrgico
A pesar del inicio precoz del tratamiento médico, un 25-50% de casos puede requerir tratamiento quirúrgico. Hasta hace poco tiempo el neumoperitoneo era una indicación absoluta de cirugía abierta. En el momento actual hay equipos quirúrgicos que recomiendan inicialmente el drenaje peritoneal (DP), sobre todo en RN con labilidad hemodinámica, como medida de estabilización preoperatoria. Esta técnica disminuye la distensión abdominal, elimina toxinas y detritus que favorecen la inflamación peritoneal, y puede propiciar una mejoría en la circulación mesentérica y en el estado hemodinámico del paciente. Si no se produce mejoría a las 24 horas del drenaje, habrá que valorar la necesidad de laparotomía diferida. En muchos casos el DP evita la cirugía posterior al facilitar una recuperación del intestino dañado. Existen grupos que lo consideran un procedimiento definitivo, especialmente en RN pretérmino extremadamente inmaduros. Además, el DP es beneficioso en casos de ECN con gran distensión abdominal, aunque no se objetive perforación.
El deterioro clínico progresivo, a pesar del tratamiento intensivo, constituye la principal indicación de laparotomía. Existen diversas técnicas quirúrgicas. La mayoría de las veces se realiza una ostomía de descarga, intentando preservar inicialmente la mayor parte de intestino posible, lo que, en ocasiones, obliga a una segunda laparotomía 24-48 horas después de la inicial y así determinar qué áreas de intestino son realmente viables. El cierre de la ostomía dependerá de la zona y cantidad de intestino afectado, pero nunca antes de que haya remitido completamente el proceso infeccioso-inflamatorio.
Pronóstico y complicaciones
El pronóstico vital de la ECN es peor en los RN de muy bajo peso, en las formas fulminantes y en las que existe una afectación intestinal extensa. Pueden producirse infecciones locales de la herida o sistémicas en el transcurso de la alimentación parenteral. A medio plazo, pueden desarrollarse segmentos de estenosis intestinal por retracción de las cicatrices de la inflamación en áreas dañadas.
Las principales complicaciones a largo plazo asociadas a la ECN dependen de la longitud de intestino resecado y de la afectación y resección de la válvula íleo-cecal. Cuando es necesaria la resección masiva (síndrome del intestino corto) disminuyen las posibilidades de supervivencia y, en todo caso, será precisa la alimentación parenteral a largo plazo. Sin embargo, existe un alto potencial para crecimiento y adaptación del intestino corto resultante. Las vellosidades intestinales se hipertrofian, de modo que la superficie total de absorción es la misma a pesar de que el intestino sea mucho más corto. La malabsorción y malnutrición derivadas del síndrome de intestino corto pueden requerir la alimentación parenteral a largo plazo.