Hernia diafragmática congénita
La hernia diafragmática congénita (HDC) consiste en un orificio diafragmático, generalmente posterolateral izquierdo, por el que pasa al tórax parte del contenido intestinal. Este defecto se asocia a un grado variable de hipoplasia pulmonar y a otras malformaciones. La compresión pulmonar por las vísceras herniadas, junto con alteraciones estructurales pulmonares primarias, dificulta gravemente el inicio de la función respiratoria en el momento del nacimiento, provocando una insuficiencia que es frecuentemente letal. Se trata de una de las malformaciones más temibles ya que causa la muerte de cerca del 50% de quienes la sufren y sigue representando un desafío terapéutico enorme.
Etiopatogenia
El defecto diafragmático se origina durante la vida embrionaria al no completarse la tabicación de la primitiva cavidad celómica para separar el tórax del abdomen. El diafragma se forma por esbozos musculares procedentes de la somatopleura en el límite entre ambas cavidades, por el crecimiento de la placa mesenquimal posthepática y, más tarde, por el cierre de los canales pleuroperitoneales. El tejido muscular se forma en parte con mioblastos procedentes de la zona cervical, lo que explica su inervación por un nervio de este origen como es el frénico, pero también por mioblastos troncales y periesofágicos. La causa de esta malformación, como la de otras, se desconoce aunque parece probado que existe una disregulación de los mecanismos moleculares de la embriogénesis a este nivel, particularmente los mediados por los retinoides.
La existencia del defecto diafragmático posterolateral permite el paso al tórax de las vísceras intraabdominales, particularmente del intestino delgado y del grueso y, ocasionalmente, del lóbulo izquierdo del hígado, del bazo o del riñón. La compresión pulmonar imposibilita el desarrollo adecuado de los pulmones en los que la ramificación broncoalveolar y el desarrollo vascular son anormales e insuficientes. Estudios embriológicos en modelos experimentales de la enfermedad ponen en duda en parte esta explicación mecanicista que relaciona las lesiones pulmonares propias de la HDC con la compresión. La asociación frecuente de malformaciones cardiacas, traqueobronquiales, músculoesqueléticas y otras permite suponer que la noxa responsable del defecto diafragmático lo es también de la hipoplasia pulmonar y de las restantes malformaciones. La compresión pulmonar y mediastínica agravaría dichas lesiones primarias.
Las malformaciones cardiacas asociadas a la HDC suelen ser comunicación interventricular perimembranosa, pseudotruncus, tetralogía de Fallot, ventrículo derecho de doble salida y anomalías de los grandes vasos así como cierto grado de hipoplasia cardiaca, especialmente izquierda.
Fisiopatología
Este complejo malformativo altera la fisiología fetal ya que en no pocos embarazos con HDC hay polihidramnios. En el momento del nacimiento se ve seriamente dificultado el tránsito desde el patrón de circulación fetal, en el que la sangre evita el lecho vascular pulmonar pasando a través del ductus y del foramen oval abierto al círculo mayor, hasta el propio de la vida extrauterina en el que se cierran dichos cortocircuitos poniendo en marcha la circulación pulmonar. Si la hipoplasia pulmonar es tan grande como para dificultar irreversiblemente la hematosis el paciente muere a pesar de la reanimación, pero si la superficie alveolar, aun reducida, es capaz de sostener un intercambio gaseoso mínimo es posible la sobrevivencia. En ocasiones la oxigenación puede mantenerse con asistencia ventilatoria pero en otras se produce un cierre de las arteriolas pulmonares que origina hipertensión pulmonar persistente, escapándose la sangre que debería irrigar el círculo menor al sistémico a través del ductus arterioso y del foramen oval. La persistencia del patrón de circulación fetal por hipertensión pulmonar, que puede ser inmediatamente postnatal o aparecer tras un periodo de “luna de miel”, es extraordinariamente difícil de tratar y causa la muerte de muchos de estos pacientes. Junto a la ocupación torácica por vísceras intraabdominales, la malformación pulmonar y las alteraciones cardiovasculares, existen otros factores que agravan aún más el ya serio compromiso respiratorio: el sistema surfactante pulmonar, responsable del desplegamiento alveolar que hace posible la hematosis, es anormal y no permite ampliar el reducido número de cavidades alveolares funcionantes. Además, la hipoplasia cardiaca puede comprometer de por sí la puesta en marcha del patrón de circulación extrauterino.
Si las enérgicas medidas de reanimación, ventilación asistida y soporte cardiovascular que son necesarias para mantener una hematosis adecuada aunque no siempre óptima bastan, el pulmón neonatal continúa su desarrollo y madura mientras el árbol vascular se estabiliza. La sobrevivencia es entonces posible tras este periodo crítico. Pero, cuando después del periodo de “luna de miel” reaparece la hipertensión pulmonar persistente propia del patrón circulatorio fetal que imposibilita la hematosis, la muerte puede ser inevitable.
Cuadro clínico
La HDC puede diagnosticarse ecográficamente antes del nacimiento en el estudio sistemático fetal o tras la detección de polihidramnios. Después del parto, salvo en algunos raros casos asociados a trisomías 18 ó 21 o síndrome de Fryns, el RN está normalmente constituido y sufre un distrés respiratorio más o menos grave. El color es azulado y la respiración, muy trabajosa. El tórax está a menudo abombado en el lado afecto mientras que el abdomen está excavado y parece vacío. El latido cardiaco está desplazado hacia la derecha y a veces puede palparse en el abdomen un hígado anormalmente conformado a causa de su parcial desplazamiento al tórax. La ventilación manual se ve dificultada por una resistencia aumentada de la vía aérea que no conviene forzar. La ventilación con oxígeno al 100% permite a veces mejorar el color y la vitalidad pero esto no ocurre siempre. En las horas sucesivas y con ventilación mecánica adecuada, el paciente puede mejorar haciendo posible el tratamiento quirúrgico pero en otras ocasiones hacen falta medidas extraordinarias de apoyo respiratorio y cardiovascular. Es preciso explorar intencionadamente los demás órganos del cuerpo y particularmente el cardiovascular, el genitourinario y el esquelético buscando las frecuentes malformaciones asociadas.
Unos pocos de estos RN sufren la malformación con síntomas menos graves e incluso tan ligeros que el diagnóstico puede pasar inicialmente desapercibido. En ellos la cantidad de vísceras herniadas suele ser menor, hay más a menudo un saco herniario que limita la invasión y hasta es posible que ésta sólo se produzca en el momento de las primeras inspiraciones al generarse por primera vez presiones negativas intratorácicas. En ciertos casos la radiografía neonatal es normal y la HDC se hace visible pasadas semanas, meses o incluso años.
Diagnóstico
El diagnóstico prenatal es relativamente fácil, por lo menos en la última parte de la gestación, al observarse imágenes líquidas de aspecto intestinal o parénquima hepático en la cavidad torácica. Cuando hay polihidramnios, este diagnóstico se hace más pronto. La estimación indirecta con ecografía o resonancia magnética del volumen pulmonar en relación con el tamaño cefálico permite predecir el grado de hipoplasia pulmonar y la relación de las dimensiones pulmonares con el volumen cardiaco puede también tener algún valor pronóstico.
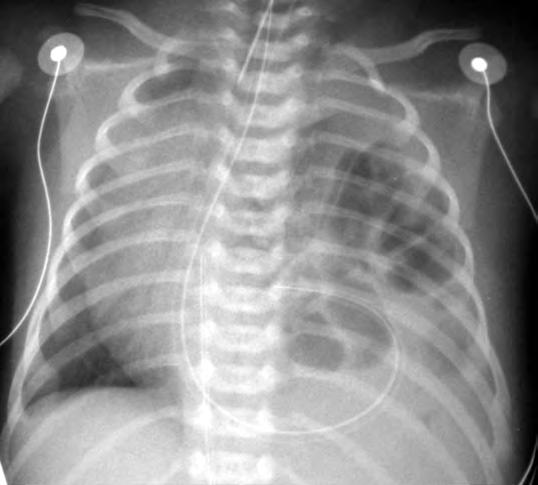
Tras el nacimiento, la observación de abdomen excavado con latido cardiaco desviado en un niño con dificultad respiratoria permite un diagnóstico clínico inmediato y fácil que se confirma con una simple radiografía del tórax en la que se aprecia la desviación mediastínica hacia el lado opuesto a la hernia y la presencia de intestino y/o vísceras macizas en el tórax (Fig. 2.31.1). La ventilación con oxígeno puro proporciona una indicación grosera de la capacidad del lecho pulmonar reducido para permitir una hematosis suficiente si eleva la pO2 rebajando la pCO2 en sangre arterial. Es imprescindible un estudio ecocardiográfico inmediato para detectar la posible participación cardiaca en la malformación. También debe inspeccionarse ecográficamente el aparato genitourinario y buscar en las radiografías anomalías músculoesqueléticas.
Tratamiento
El tratamiento de la HDC requiere los mejores medios de asistencia intensiva hoy disponibles: monitorización invasiva y percutánea de presión y de gases sanguíneos, ventiladores sofisticados y drogas de soporte cardiovascular. Contra lo que se aceptaba anteriormente, el cierre quirúrgico del defecto diafragmático con reposición de las vísceras abdominales desplazadas al tórax, aun siendo necesario, no es urgente ni la parte más importante del tratamiento. Este es principalmente ventilatorio y de soporte y sólo secundariamente, quirúrgico. Se resumen a continuación las modalidades del tratamiento médico y del quirúrgico.
Tratamiento médico
Cuando se hace el diagnóstico prenatal de HDC es tentador administrar corticosteroides a la madre para acelerar por vía transplacentaria la maduración pulmonar como se hace ante una amenaza de parto prematuro en fetos sin malformaciones, pero no parece haber evidencia convincente de los beneficios de semejante medida que tiene además algunas contrapartidas indeseables. También parecía tentador instilar surfactante exogéno intratraqueal para intentar paliar la inmadurez/insuficiencia existente en estos RN, pero la evidencia disponible solamente prueba que esta maniobra es más bien perjudicial. Cuando se conoce el diagnóstico antes del nacimiento, la intubación debe hacerse incluso antes de cortar el cordón para no desestabilizar el delicado sistema vascular cardiopulmonar.
En los primeros minutos tras el nacimiento deben insertarse las vías venosa y arterial, una sonda uretral para monitorizar la diuresis y una sonda nasogástrica para que no se distienda el aparato digestivo superior.
La ventilación asistida representa el problema mayor del tratamiento neonatal de la HDC pues la reducida capacidad vital y las dificultades de desplegamiento alveolar causan altas presiones en la vía aérea que amenazan la integridad del parénquima enfermo. Por este motivo, la ventilación convencional con oxígeno al 100% sin sobrepasar presiones de más de 20 ó 25 cm de H2O suele sustituirse por ventilación de alta frecuencia en la que se intenta compensar el reducido volumen corriente con un mayor número de respiraciones por minuto. Los aparatos de alta frecuencia oscilatoria han permitido maximizar estos principios haciendo posible un intercambio gaseoso adecuado sin subidas prohibitivas de la presión en la vía aérea. Desgraciadamente ninguna de estas medidas ha conseguido poner remedio a los graves problemas ventilatorios de todos estos enfermos. En algunos basta la ventilación convencional mientras que en otros ninguna de las más sofisticadas llega a ser suficiente.
La certeza de que la aplicación sucesiva de estas modalidades de asistencia respiratoria representa un barotrauma creciente que daña a más o menos largo plazo el delicado parénquima pulmonar del neonato con HDC, ha impulsado una política ventilatoria menos agresiva basada en una asistencia mínima, sin parálisis, en la modalidad de ventilación mandatoria intermitente para permitir alguna respiración espontánea con presiones en la vía aérea que no suban de 20 mmHg. Para que esto sea posible es preciso conformarse con objetivos gasométricos más modestos que los convencionalmente aceptados en otras enfermedades. Esta política, conocida como de “hipercapnia permisiva”, se satisface con saturaciones postductales superiores del 80% sin prestar demasiada atención a las presiones parciales de O 2 que pueden mantenerse por debajo de 40 mmHg y aceptando niveles de hipercapnia cercanos a 75 u 80 mmHg.
Cuando todas la medidas de oxigenación convencionales fallan, la única posibilidad de sobrevivencia es la hematosis extracorpórea, usando durante periodos más o menos largos de tiempo un oxigenador de membrana extracorpóreo semejante al que se utiliza en la cirugía a corazón abierto. Esta técnica, llamada “ECMO”, se realiza por vía venoarterial (canulando la arteria carótida y la vena yugular) o por vía venovenosa cíclica (a través únicamente de la yugular por la que se extrae la sangre para su oxigenación, reinyectándola tras la misma). El uso del ECMO permite la adecuada oxigenación tisular sin barotrauma pulmonar mientras acontece la maduración y el desarrollo pulmonares en ausencia de insulto ventilatorio. En algunos países el uso del ECMO en pacientes con HDC se ha generalizado bastante pero, salvo en los contados casos en los que la predicción de mortalidad basada en la insuficiencia respiratoria neonatal y en el peso sea superior al 80%, los beneficios obtenidos no están a la altura de las expectativas alcanzadas y es incluso dudoso que se obtengan beneficios a largo plazo, pues la mortalidad tardía tras este procedimiento invasivo es relativamente alta y las secuelas pueden ser considerables. De todos los pacientes con insuficiencia respiratoria neonatal tratados con ECMO, los que padecen HDC son los que obtienen de esta técnica menos beneficio.
Junto a estas medidas de oxigenación son necesarios medicamentos para intentar revertir la circulación fetal o evitar el retorno a la misma. Para reducir la constricción arteriolar pulmonar se usan vasodilatadores que tienen siempre el riesgo de que los efectos hipotensores benéficos sobre el lecho pulmonar sean en parte anulados por los paralelamente producidos en el sistémico. La tolazolina o las prostaciclinas se usaron con este fin pero con resultados no satisfactorios. La introducción del óxido nítrico inhalado abrió expectativas que tampoco se han visto plenamente colmadas pues, aunque su uso produce una caída rápida de la presión arterial pulmonar con mejora de la hematosis en algunos pacientes, en muchos otros los efectos son menos espectaculares o incluso imperceptibles o transitorios.
También se usan fármacos inotrópicos para intentar paliar los efectos de la hipoplasia o de la malfunción miocárdica y vasoconstrictores periféricos, como la adrenalina, para contrarrestar la vasodilatación periférica aumentando la presión en el círculo sistémico, con el fin de dificultar el cortocircuito ductal o interauricular. Otras medidas de soporte, como aportes adecuados de líquidos, alimentación parenteral y antibioterapia, son igualmente necesarias en el tratamiento de la HDC.
Tratamiento quirúrgico
La frecuencia con la que se hace el diagnóstico prenatal de esta malformación invita a intentar manipulaciones intrauterinas basadas en la interpretación mecanicista de la patogenia de las lesiones pulmonares. En efecto, si éstas fueran consecutivas a la compresión, la descompresión prenatal facilitaría el desarrollo alveolar. Tras experimentos en fetos de conejo y de cordero, en los que se creaba quirúrgicamente una HDC reproduciendo la hipoplasia e inmadurez bioquímica pulmonares con alteraciones vasculares semejantes a las del humano, una descompresión quirúrgica permitió revertir las lesiones. Quedaba así abierta una expectativa realista aplicable a fetos humanos. Desgraciadamente estas operaciones han dado unos resultados limitados y las expectativas se han trasladado a otra aproximación intrauterina al problema: la obstrucción traqueal fetal revierte la hipoplasia pulmonar restableciendo una histología pulmonar normal. Esta obstrucción, que se practicó primero por vía abierta pero que ahora se hace por abordaje fetoscópico sin necesidad de abrir el abdomen y el útero de la madre, que ha de ser reversible en el momento del nacimiento o antes del mismo, está ya siendo practicada en humanos y pronto será adecuadamente evaluada.
Si la reparación quirúrgica de la HDC es un acto relativamente fácil, la elección del momento óptimo es difícil. No se gana nada operando enseguida tras del nacimiento pues cualquier manipulación incrementa la constricción vascular pulmonar dificultando la hematosis y por ello se retrasa la operación hasta que el enfermo está “estabilizado”, o sea, hasta que la hematosis es suficiente, la función cardiovascular, estable, la diuresis, adecuada y las presiones parciales de gases sanguíneos, aceptables. Sin embargo, en los pacientes en quienes no puede lograrse un intercambio de gases satisfactorio, que requieren ventilación oscilatoria de alta frecuencia, óxido nítrico, soporte inotrópico e incluso ECMO, es difícil decidir cuándo hay que proceder a la intervención. La estabilización puede hasta ser imposible y en tales casos la operación no está indicada. La cirugía, antes considerada como una urgencia, ocupa hoy un lugar más secundario, pues lo que mata o salva al paciente no es, obviamente, el cierre del defecto y la reposición de las vísceras al abdomen, sino el mantenimiento permanente de una hematosis adecuada. La intervención quirúrgica persigue la reposición de las vísceras desplazadas al abdomen seguida del cierre del defecto diafragmático. Cuando el defecto es muy grande puede requerirse un parche protésico para cerrarlo. A menudo se operan estos pacientes en la unidad de cuidados intensivos neonatal en lugar de en los quirófanos convencionales para disminuir la reactividad vascular perjudicial favorecida por cambios ambientales y para no trasladar con el enfermo al quirófano el abundante equipamiento usado en la unidad.
También debe tenerse en cuenta que la HDC comporta un serio riesgo de secuelas en los supervivientes. Una proporción considerable de éstos sufre insuficiencia pulmonar crónica, déficits neurológicos consecutivos a la anoxia mantenida, sordera, malnutrición, deformidades torácicas, obstrucciones intestinales y reflujo gastroesofágico. Algunas de estas complicaciones requieren tratamientos activos, incluso quirúrgicos, en diversos momentos de la vida.
La HDC sigue siendo uno de los procesos más mortíferos con los que pueden enfrentarse intensivistas neonatales y cirujanos pediatras, por lo que es seguro que en el futuro se desarrollarán nuevas medidas o modificaciones y refinamientos de las que se han descrito.