Patología respiratoria del recién nacido
La dificultad respiratoria es uno de los síndromes más frecuentes en la época neonatal. Su expresión clínica no pasa desapercibida, es muy fácil de identificar por los padres y cuidadores sus signos clínicos: polipnea, tiraje o retracciones, quejido espiratorio, estridor inspiratorio, patrón respiratorio anormal, cianosis. La insuficiencia, dificultad o fallo de otros órganos y sistemas también es frecuente en el recién nacido (RN), que ha de adaptarse a la vida extrauterina sin haber alcanzado aún la madurez anatómica y la funcional, pero las manifestaciones externas son, en comparación con la dificultad respiratoria, menos fáciles de identificar clínicamente.
Habida cuenta de las múltiples patologías que pueden ser la causa de los signos y síntomas de dificultad respiratoria, para su aproximación diagnóstica se necesita realizar una cuidadosa anamnesis, comprender la fisiopatología de las manifestaciones clínicas y de las alteraciones encontradas en los exámenes complementarios.
Valoración clínica
Para estimar la gravedad y fisiopatología de la dificultad respiratoria, las medidas de soporte respiratorio necesarias y otras posibles intervenciones terapéuticas es obligado y urgente llevar a cabo:
- la valoración clínica, en especial una cuidadosa y detenida inspección,
- la completa evaluación de toda la información ofrecida por los analizadores de sangre automatizados sobre el equilibrio ácido-básico, cooximetría y contenido de oxígeno, electrolitos y metabolitos,
- la radiografía de tórax (en ocasiones la disponibilidad inmediata de ultrasonografía puede ser de gran utilidad) y
- la atención a las variables de función pulmonar que ofrecen los respiradores neonatales en la actualidad.
Anamnesis
La historia prenatal de la madre y del feto, del parto y estado del RN tras el nacimiento, ofrece en muchas ocasiones información útil para identificar los potenciales factores de riesgo para el desarrollo de enfermedad respiratoria en el RN. En prácticamente todos los nacidos con menos de 28 semanas de gestación existe dificultad respiratoria de inicio inmediato tras nacer, riesgo que disminuye conforme aumenta la edad gestacional hasta alcanzar las 34 semanas. Este riesgo es mayor si no se han administrado corticoides prenatales (betametasona) a la madre, en varones, en segundo gemelo, en nacidos por cesárea sin trabajo de parto, asfixia fetal y depresión al nacimiento, hipotermia, hermano previo con EMH, diabetes materna, enfermedad hemolítica neonatal. La adicción materna a narcóticos, tabaco y el alcohol, reduce la incidencia de enfermedad de EMH.
La extracción por cesárea sin trabajo de parto con ausencia de compresión de la pared torácica en el canal del parto, y consiguiente expulsión de líquido pulmonar, es un factor de riesgo de maladaptación pulmonar (taquipnea transitoria, pulmón húmedo) en los nacidos antes de las 35 semanas. En los pretérminos esta disfunción en la adaptación, producida por retraso en la reabsorción del líquido pulmonar fetal tras el nacimiento, puede coexistir con distrés respiratorio por inmadurez pulmonar (enfermedad de la membrana hialina).
En nacidos a término o postérmino con meconiorrexis intraparto en el curso de asfixia fetal y líquido amniótico teñido de meconio, existe un riesgo importante de aspiración pulmonar de ese líquido meconial. El neonato que ha sufrido de asfixia perinatal grave puede presentar taquipnea secundaria a acidosis metabólica; en estos RN la función miocárdica puede estar comprometida por lesión hipóxico-isquémica con riesgo de edema pulmonar, en ocasiones hemorrágico. También la asfixia perinatal es un factor de riesgo para desarrollar hipertensión pulmonar.
El antecedente de maniobras de reanimación con ventilación pulmonar con presión positiva intermitente excesiva o de esfuerzos inspiratorios espontáneos con presiones intrapleurales negativas muy importantes puede asociarse a la ruptura alveolar y posterior desarrollo de enfisema intersticial, neumotórax, neumomediastino, neumopericardio, enfisema subcutáneo e incluso neumoperitoneo. Los RN con dificultad respiratoria, con o sin soporte respiratorio, cuyos alvéolos están sometidos a elevadas presiones transpulmonares (presión alveolar-presión intrapleural) pueden también, tras la rotura de sus alvéolos, presentar empeoramiento clínico y del equilibrio ácido-básico y aire extraalveolar en las radiografías de tórax.
La rotura precoz de las membranas amnióticas (> 24 horas), la presencia en la madre de fiebre, taquicardia, leucocitosis, dolorimiento o sensibilidad uterina anormal, leucorrea, uso de antibióticos en la madre, cultivo rectovaginal positivo para bacterias (SGB), líquido amniótico maloliente o purulento y, en menor grado, la historia de infección del tracto urinario, comportan un riesgo, además de prematuridad, de infección del feto por introducción de líquido o secreciones contaminadas antes de nacer, por vía ascendente o durante el paso del mismo por el canal del parto. La presencia de oligoamnios aumenta la probabilidad de infección amniótica, con el consiguiente riesgo fetal. Estos antecedentes, sobre todo los de corioamnionitis, alertan sobre el riesgo de infección pulmonar, meningitis y/o sepsis neonatal, además de hemorragia intracraneal y leucomalacia periventricular. La corioamnionitis supone también un riesgo de infección puerperal en la madre.
Los neonatos, en especial los menores de 28 semanas de edad gestacional con ventilación mecánica invasiva, esto es, a través del tubo intratraqueal, y prolongada tienen un alto riesgo de que su sistema respiratorio sea colonizado y en ocasiones infectado por patógenos bacterianos y hongos, lo que obliga a su vez a prolongar la permanencia de la intubación endotraqueal.
En la actualidad, los exámenes ecográficos durante el embarazo pueden objetivar malformaciones de los sistemas respiratorio, cardiovascular, nervioso central, musculoesqueléticas, renales, del tracto gastrointestinal, etc. que, de modo directo y/o por ser causa de oligoamnios (agenesia renal, ruptura prolongada de membranas, hipoplasia pulmonar) o polihidramnios (hernia diafragmática, fístulas traqueoesofágicas), alertan del riesgo de presentar, entre otras manifestaciones, signos y síntomas de dificultad respiratoria. Dependiendo obviamente de la patología concreta del paciente neonatal, la expresión clínica tendrá sus peculiaridades específicas pero, en cualquier caso, se debería valorar la presencia de hipoplasia pulmonar, hipertensión pulmonar, linfangiectasias pulmonares y obstrucción de la vía aérea superior.
En la historia del RN es obligado conocer cómo nació (test de Apgar), si precisó medidas de reanimación, edad de inicio del cuadro de dificultad respiratoria, puntuación del test de Silverman (tabla 2.17.2) y constantes vitales (frecuencias respiratoria y cardiaca, pulsioximetría, tensión arterial, temperatura). Igualmente se debe valorar la evolución (observaciones clínicas, constantes vitales, exámenes complementarios realizados y medidas terapéuticas) durante el periodo de tiempo previo al ingreso, especialmente en los RN trasladados desde otros hospitales.
| 0 | 1 | 2 | |
|---|---|---|---|
| Movimiento de la pared superior del tórax | Sincronizado con el movimiento del abdomen | Falta de sincronización en inspiración | Falta de sincronización en inspiración y en espiración (imagen de balancín) |
| Retracciones intercostales en la parte inferior del tórax | Ausentes | Poco visibles | Marcadas |
| Retracción xifoidea | No existe | Poco visible | Muy marcada |
| Aleteo nasal | Sin dilatación del ala de la nariz | Dilatación mínima | Dilatación marcada y apertura de la boca |
| Quejido espiratorio | Ausente | Audible con fonendo | Audible sin fonendo |
Exploración clínica
Ninguno de los signos clínicos de dificultad respiratoria es específico de una enfermedad respiratoria neonatal determinada. Pueden presentarse, por otra parte, en patología cardiaca y en alteraciones de otros sistemas.
Las constantes vitales y los signos de dificultad respiratoria deben vigilarse con frecuencia en las primeras 6 horas de vida, periodo en el cual pueden comenzar la mayoría de las enfermedades graves pulmonares. En los primeros 30 minutos de vida se acepta como normal la presencia de aleteo nasal, polipnea, quejido y pequeñas retracciones de la pared costal. Cuando estos signos son importantes o persisten pasadas las primeras horas de vida es obligada la vigilancia muy estrecha y la realización de exploraciones complementarias, ya que puede existir patología cardiopulmonar. El test de Silverman se utiliza desde hace más de 50 años en el RN para valorar el grado de dificultad respiratoria y estimar la gravedad de la enfermedad que la causa (tabla 2.17.2). Los RN con dificultad respiratoria suelen presentar, en mayor o menor grado, polipnea, retracciones de la pared torácica, aleteo nasal, quejido espiratorio y cianosis. En los neonatos de menor edad gestacional sobre todo, y en los pacientes más graves y agotados por el trabajo respiratorio muscular, pueden observarse periodos o pausas de apnea, desaturación de la hemoglobina y bradicardia.
Polipnea o taquipnea
La polipnea o frecuencia respiratoria en reposo mayor de 60 respiraciones/minuto, (normal, 40-60 respiraciones por minuto), como signo clínico aislado, es el más sensible de dificultad respiratoria. El patrón respiratorio neonatal es, por lo general, irregular en frecuencia (30-60 respiraciones por minuto) y en profundidad (varía con la temperatura ambiental, estado de sueño, alimentación); la respiración es más abdominal que torácica. Muchos prematuros “normales” y algunos nacidos a término tienen un patrón periódico de respiración: salvas de respiración seguidas de periodos de 5-10 segundos en que cesan las respiraciones, por lo que se debe valorar el número de respiraciones durante un minuto completo. En las pausas de apnea cesan los movimientos respiratorios durante más de 20 segundos y se acompañan de bradicardia y de hipoxemia. En estos enfermos es urgente un soporte respiratorio inmediato para evitar la parada respiratoria, desaturación importante de la hemoglobina y, en ocasiones extremas, parada cardiaca. La polipnea, con la reducción consiguiente del tiempo de espiración, disminuye la pérdida de volumen de gas pulmonar al final de la espiración (capacidad residual funcional), facilitando de este modo el recambio gaseoso y la ventilación alveolar. La menor profundidad de los esfuerzos respiratorios o respiración superficial disminuye el requerimiento de oxígeno y el gasto energético del trabajo respiratorio.
Retracciones de la pared torácica
Como la pared torácica del RN, sobre todo del ≤ 1.000 g, es muy distensible (gran compliancia), en los pacientes con disminución de la distensibilidad pulmonar (enfermedad de membrana hialina, taquipnea transitoria, edema pulmonar, bronconeumonía) o aumento de la resistencia de la vía aérea (aspiración meconial, obstrucción de vía aérea malformativa, lesión adquirida, tapón de moco, broncoespasmo, enfisema intersticial) la mayor presión pleural negativa que ha de generarse por el diafragma y otros músculos respiratorios para lograr un volumen corriente aceptable “succiona” las estructuras de la pared ocasionando su retracción entre las costillas (intercostal), por encima de las clavículas (supraclavicular), por debajo del reborde costal (subcostal), en la parte superior del esternón (supraesternal) o en su área inferior o xifoides (xifoidea). Aun cuando la obstrucción de la vía aérea, como se ha señalado, puede causar retracciones, la causa más frecuente de tiraje es la disminución de la compliancia pulmonar, por lo general en la EMH. Cuando el distrés respiratorio es moderado sólo se observa un ligero tiraje intercostal y subcostal; cuando la dificultad respiratoria aumenta, la retracciones son más profundas y generalizadas, pudiendo la retracción xifoidea en ocasiones simular un pectus excavatum. Cuando el RN contrae al máximo el diafragma para intentar introducir más aire en la inspiración, el abdomen se desplaza hacia arriba, coincidiendo con un hundimiento de la parte superior del tórax y esternón (indicando un pobre llenado pulmonar), se observa como el movimiento de un balancín (see-saw) o patrón respiratorio paradójico.
Aleteo nasal
La dilatación de los orificios nasales durante la inspiración, por la activación del músculo de las alas de la nariz, conduce a una disminución de la resistencia nasal al flujo aéreo y, por consiguiente, a una disminución importante del trabajo respiratorio, especialmente en los RN que respiran, preferentemente, por vía nasal. El aleteo nasal, “intento” para disminuir la resistencia de la vía aérea, se interpreta como un signo de hambre de aire; puede ser intermitente, a veces es muy evidente y otras apenas perceptible. Presumiblemente, cuanto mayor es la presión inspiratoria generada para introducir el aire mayor es el grado de aleteo. En ocasiones se observa en ausencia de otros signos de dificultad respiratoria, como durante la alimentación.
Quejido espiratorio
Es el sonido producido durante la salida del aire del final de la espiración hacia el exterior a través de unas cuerdas vocales parcialmente cerradas. Con este mecanismo adaptativo, para prevenir el colapso alveolar o una capacidad residual disminuida, compensador de la falta de surfactante en la EMH, se logra, al mantener una presión positiva al final de la espiración, mejorar el cociente ventilación alveolar/perfusión pulmonar (V/Q) y, por consiguiente, el recambio gaseoso, debido al aumento de la presión en la vía aérea durante la espiración y de la capacidad residual funcional por el atrapamiento de aire alveolar.
Estridor
La laringe, tráquea y bronquios del RN tienen una compliancia mayor que la del adulto, razón por la cual su vía aérea es muy susceptible a las fuerzas de dilatación o de compresión. El estridor es el sonido agudo, de tono alto, producido durante la entrada de aire en inspiración a través de una vía aérea superior de diámetro reducido por malformación congénita o patología adquirida de la epiglotis, laringe, cuerdas vocales, área subglótica, tráquea y bronquios principales. Causas importantes y frecuentes de estridor inspiratorio son la laringomalacia, el edema laríngeo, la lesión de la glotis o de las cuerdas vocales tras la retirada del tubo endotraqueal (extubación), la estenosis subglótica congénita, anillos vasculares. En la laringotraqueobroncomalacia congénita o la secundaria a ventilación mecánica muy prolongada en el RN de peso extremadamente bajo se observa con el broncoscopio la aproximación de la pared anterior y posterior de la tráquea durante la inspiración, el paciente puede presentar estridor inspiratorio y sibilancias, necesitando en los casos más graves medidas de soporte respiratorio mecánico.
Cianosis
La coloración cianótica de manos y pies (cianosis periférica o acrocianosis) es frecuente en el RN normal. La cianosis central, observada en lengua, mucosa oral y en la piel del RN en ausencia de llanto, es siempre patológica pasados los primeros minutos de vida. Si es mantenida, constituye un signo característico de las cardiopatías congénitas, de hipertensión pulmonar persistente neonatal con shunt derecha-izquierda a nivel del ductus arteriosus y/o foramen oval, de la patología del sistema respiratorio asociada a la hipoventilación alveolar intensa (con presión parcial alveolar de CO2 muy elevada y de O2 muy disminuida: hipoventilación central y periférica, alteración en el cociente ventilación alveolar/perfusión pulmonar y a cortocircuito derecha-izquierda intrapulmonar (EMH, neumonía, síndrome de aspiración meconial).
La cianosis central indica que la cantidad de hemoglobina no saturada es mayor de 3 g/dL en sangre arterial. El paciente con anemia importante no tiene, aun en presencia de hipoxemia grave, una cantidad suficiente de hemoglobina desaturada para presentar cianosis. La ausencia de cianosis no excluye, pues, la existencia de una hipoxemia importante. La policitemia, frecuente en neonatos a término o postérmino con hipoxia fetal sostenida, hace posible, por el contrario, la aparición de cianosis central más precozmente pues el nivel de 3 g/dL de hemoglobina reducida es más fácil de alcanzar. Debido a la presencia en el RN de hemoglobina fetal, con mayor afinidad por el oxígeno que la hemoglobina adulta, la cianosis aparece en el neonato con niveles de presión parcial de oxígeno menores que en el adulto. La cianosis central indica, en presencia de una cifra de hemoglobina normal, una PaO2 menor de 40 mmHg, por lo que la aparición de cianosis franca señala una hipoxemia muy grave y, en patología pulmonar, una insuficiencia respiratoria muy avanzada. Un ligero descenso de PaO2 en estas circunstancias conduce a una caída importante de saturación de la hemoglobina, contenido de O2 arterial y de su transporte a los tejidos. La palidez de la piel o el aspecto moteado o salpicado sugieren choque, vasoconstricción cutánea (descartar la causada por el frío) o anemia.
Auscultación pulmonar
Como el tórax es muy pequeño, puede resultar difícil, a pesar del reducido tamaño del estetoscopio usado, localizar alteraciones en la auscultación; por otra parte, los ruidos respiratorios se transmiten fácilmente de un área torácica a otra. En los prematuros de muy bajo peso no es fácil adaptar sobre la pared del tórax la campana o membrana del fonendo para tratar de excluir la presencia de ruidos externos ajenos al tórax. Otra dificultad, también muy frecuente en el pretérmino es que, al colocar el fonendo sobre el tórax, el paciente se mueve o contornea, lo que dificulta la auscultación sobre todo del corazón; en este caso el estetoscopio calentado se deja durante 5-10 segundos sobre el tórax para que el niño se habitúe al estímulo y permanezca quieto.
Cuanto más pequeño es el neonato mayor es la conducción del sonido producido por la entrada del aire. La disminución del sonido de la entrada del aire durante la inspiración en una zona concreta (atelectasia, consolidación) es muy difícil de apreciar, debido a que los sonidos de las zonas próximas no alteradas se transmiten al área afectada. Cuando hay diferencia en la entrada de aire entre un pulmón y el otro, se debe sospechar atelectasia, neumotórax o enfisema lobar en el pulmón que no ventila.
Puede haber una disminución simétrica, bilateral, en la entrada del aire, en la enfermedad de membrana hialina, edema pulmonar y neumonía; en estos pacientes se pueden auscultar estertores crepitantes. Las sibilancias, sobre todo en espiración, son infrecuentes en las primeras semanas de vida pero pueden oírse en las etapas iniciales de la displasia broncopulmonar (enfermedad pulmonar crónica), edema pulmonar o neumonía, indicando una obstrucción de la vía aérea. En presencia de secreciones en vías aéreas, o tras la aspiración de restos gástricos, pueden auscultarse roncus de baja frecuencia (roncus gruesos). Un error importante auscultando a un neonato en ventilación mecánica es no darse cuenta de que el aire puede estar entrando y saliendo del estómago y no del pulmón cuando se ha salido de la tráquea el tubo endotraqueal.
Al examinar al RN en ventilación mecánica se debe prestar atención a las expansiones torácicas para evaluar el grado de desplazamiento (aumentado por mayor compliancia tras el uso de surfactante, disminuido por extubación accidental, obstrucción del tubo endotraqueal, insuficiente presión inspiratoria) y simetría (ausente en intubación del bronquio principal o neumotórax). Antes de auscultar se debe eliminar el agua de los tubos del circuito pues el gas a través del líquido de las asas produce un sonido audible.
Los sonidos de la respiración pueden estar alterados por la estrechez de la vía aérea superior causada por el tubo endotraqueal y por el flujo del gas del ventilador que puede aumentar la turbulencia. La ausencia de entrada de aire en inspiración puede ser causada por obstrucción del tubo endotraqueal, extubación accidental, neumotórax, lesión que ocupa espacio. La pérdida de gas alrededor del tubo endotraqueal provoca durante la inspiración un sonido de alta frecuencia.
Cuando el soporte respiratorio es la ventilación de alta frecuencia, el RN por lo general no tiene movimientos respiratorios espontáneos. Las altas frecuencias del respirador provocan vibraciones del tórax, abdomen, cuello. Se debe observar y palpar el tórax para valorar la calidad y la simetría de la vibración. Los excesivos movimientos de tórax y abdomen pueden sugerir hiperventilación. El sonido de alta frecuencia o musical puede indicar la existencia de secreciones, y la disminución de la entrada de aire, la presencia de neumotórax.
Exploraciones complementarias
Equilibrio ácido-básico
La monitorización de los valores de pO2 y pCO2 sanguíneos y cutáneos, de la pulsioximetría y del pH y equilibrio ácido-básico, es una práctica habitual en el cuidado del RN con dificultad respiratoria. Los valores de pO2/pulsioximetría y de pCO2 y su influencia sobre el pH sanguíneo dependen sobre todo de la composición y volumen de los dos determinantes del recambio gaseoso pulmonar, es decir, del gas alveolar (ventilación alveolar) y de la sangre venosa mixta que perfunde los alvéolos (flujo pulmonar efectivo) y, en menor grado, de los mecanismos físicos del intercambio gaseoso alveolocapilar (difusión de gases). Los mecanismos de alteración del recambio gaseoso en el pulmón pueden ser los siguientes: disbalance entre ventilación y perfusión (V/Q normal es 1:1), shunt (cardiopatía congénita, hipertensión pulmonar persistente, atelectasia), hipoventilación y dificultad para la difusión de gases.
El recambio gaseoso en el neonato con dificultad respiratoria experimenta cambios muy frecuentes e importantes, como consecuencia de la evolución de la patología existente, del desarrollo de complicaciones como neumotórax, edema pulmonar, obstrucciones repetidas de la vía aérea, hipertensión pulmonar, shunt ductal o sangrado pulmonar. Por otra parte, las innumerables estrategias terapéuticas utilizadas en estos pacientes son igualmente responsables de cambios importantes en la función pulmonar que se reflejan en los valores de pO2, pCO2, y pulsioximetría y, en mayor o menor grado, en el pH y equilibrio ácido-básico. Así sucede con motivo de cambios en los parámetros de ventilación mecánica, uso de surfactante, de óxido nítrico inhalado, broncodilatadores, corticoides, diuréticos, manipulación farmacológica del ductus arteriosus con ibuprofeno, indometacina o PGE1.
Presión parcial de oxígeno en sangre arterial
En el RN con patología respiratoria grave la causa más frecuente de una importante desaturación de oxígeno de la hemoglobina, por disminución de la PaO2, es la falta de adecuación entre ventilación y perfusión (V/Q normal 1:1) producida por la existencia de unidades alveolocapilares con escasa ventilación (V/Q menor de 1). Cuando el cociente V/Q está disminuido, como en la EHM, la incorporación de O2 y lavado de CO2 en la sangre venosa mixta es insuficiente. El único modo de elevar la pO2 arterial en estos pacientes es incrementando la pO2 de sus alvéolos (PA O2) mal ventilados (V/Q < 1) administrando altas concentraciones de O2 (FiO2 elevada).
La presencia de unidades alveolocapilares con cociente V/Q aumentado (V/Q > 1) por hiperventilación alveolar, también presente en muchos de los neonatos con patología pulmonar grave, sólo aumenta muy ligeramente su PaO2 aunque se incremente mucho la FiO2, pues se puede incorporar muy poco O2 a una sangre cuya hemoglobina ya está saturada. La hipoxemia (disminución de PaO2), la hiposaturación de la hemoglobina y el descenso en el contenido arterial de oxígeno (CaO2 = Hb g x 1,37 x % SatO2 + PaO2 x 0,003) causados por la presencia de shunt, tiene lugar cuando la sangre venosa cortocircuita los alvéolos ventilados, como sucede en cardiopatías congénitas cianóticas, hipertensión pulmonar persistente con un cortocircuito derecha-izquierda a nivel del foramen oval y/o conducto arterioso o en presencia de atelectasia pulmonar (V/Q = 0). La administración de oxígeno no corrige en estos casos la hipoxemia.
La hipoventilación es una causa frecuente de hipoxemia, al aumentar la PACO2 y disminuir la PAO2 y en algunos pacientes, como en prematuros con pausas de apnea prolongadas, por falta de una monitorización adecuada, la desaturación puede ser muy importante. Las limitaciones en la difusión de los gases afectan poco a la oxigenación, no siendo en el RN mecanismos frecuentes de hipoxemia que, por otra parte, se corrige fácilmente aumentando la FiO2.
En los pacientes más graves, con soporte respiratorio por lo general, pueden utilizarse dos índices para valorar de un modo objetivo la intensidad de la alteración en la oxigenación, así como para indicar y comprobar el efecto de determinadas terapéuticas, como surfactante, óxido nítrico, oxigenación por membrana extracorpórea (ECMO). El cociente arterio/alveolar de O2 (PaO2 /PAO2 o a/AO2), que no tiene unidades y disminuye cuando empeora la oxigenación, puede calcularse con la ecuación:
$$\frac{PaO_{2}}{PAO_{2}} = \frac{PaO_{2}}{\left (PB - PH_{2}O \times FiO_{2} - \left (\frac{PACO_{2}}{R} \right ) \right )}$$
donde PB: presión barométrica (mmHg); PH2O: presión del vapor de agua (47 mmHg); PACO2: se aproxima a PaCO2; R (cociente respiratorio): 0,80,85 (se aproxima a 1). Dividir PaCO2 por 0,8 es igual a multiplicar PaCO2 x 1,25. (PB - PH2O) x FiO2 = PiO2 (presión parcial de O2 en el aire inspirado).
$$\frac{PaO_{2}}{PAO_{2}} = \frac{PaO_{2}}{PiO_{2} - \left (PaCO_{2} \times 1,25 \right )}$$
El cociente a/A normal es 0,75. Gradientes de a/A menores de 0,22 y, más recientemente, < 0,36 han sido usados en la EMH para indicar la administración de surfactante.
La diferencia alvéolo-arterial de O2 (PAO2 - PaO2 o Aa DO2), expresada en mmHg, aumenta cuando se deteriora la oxigenación; se utiliza menos en neonatología que en edades posteriores y puede calcularse con la fórmula siguiente:
P(A-a)O2 = (PB - PH2O) x FiO2 - (PACO2/R) - PaO2
siguiendo las simplificaciones usadas para la estimación de la PAO2, la fórmula puede expresarse:
P(A-a)O2 = (PiO2 - PaCO2 x 1,25) - PaO2
En ocasiones se utiliza el índice respiratorio (IR), que se traduce como el cociente entre la diferencia alveolo-arterial de O2 y la pO2 arterial de oxígeno
IR = P (A-a)O2/PaO2
Como en los RN en ventilación mecánica, el valor de PaO2 está muy determinado por la presión media en la vía aérea, es práctica habitual el uso del índice de oxigenación:
$$IO = \frac{PMVA \times FiO_{2} \times 100}{PaO_{2}}$$
donde PMVA es “Presión media en vía aérea (cm H2O)”.
En los pacientes más graves, con valores altos de presión media en la vía aérea y de FiO2 y PaO2 muy baja, los valores IO son de 30-40 y la mortalidad, muy elevada. Cifras superiores durante 3 horas a 40 en ventilación mecánica convencional, o a 60 en ventilación de alta frecuencia, son utilizadas como criterio para el uso de ECMO.
Presión parcial de dióxido de carbono en sangre arterial
La presión parcial de dióxido de carbono en sangre arterial, PaCO2, es de gran utilidad para medir la función pulmonar. El intercambio de CO2 a nivel pulmonar está alterado en presencia de hipoventilación alveolar, de disbalance ventilación/perfusión y en presencia de shunt o cortocircuito de la sangre venosa de los alvéolos ventilados.
La disminución de la ventilación alveolar (disminución del volumen corriente o de la frecuencia respiratoria o, más raramente, aumento del volumen del espacio muerto) en relación al consumo de O2 y a la producción de CO2 se denomina hipoventilación y se refleja en un descenso de la PaO2 y en un aumento de pCO2 alveolar, pCO2 arterial y de la pCO2 en el gas del final de la espiración. Por el contrario, si la ventilación alveolar aumenta hasta el punto de que la entrada de O2 y el lavado de CO2 son superiores a las necesidades, los depósitos alveolares y arteriales de O2 aumentan y los de CO2 disminuyen. Los valores descendidos de la pCO2 arterial (hipocapnia) y de la pCO2 del final de la espiración establecen en clínica el cuadro de hiperventilación y su grado. En los RN con patología grave y prolongada del sistema respiratorio, como en los pacientes con displasia broncopulmonar, es habitual la hipercapnia crónica compensada por alcalosis metabólica. Los valores de pCO2 en sangre venosa son generalmente 6-10 mmHg más elevados que los de las muestras arteriales simultáneas, pero pueden variar dependiendo del gasto cardiaco y de las demandas metabólicas. Las muestras de sangre capilar, no útiles para valorar la oxigenación, en general, aunque no siempre, reflejan la pCO2 arterial.
La monitorización continua transcutánea de pCO2 y pO2 es muy útil en situaciones en que pueden producirse cambios rápidos o inesperados en sus valores: desacostumbramiento rápido del soporte respiratorio, cambio en la mecánica pulmonar (compliancia y resistencia) sin los ajustes adecuados en los parámetros del respirador, paso de ventilación mecánica convencional a ventilación de alta frecuencia, grado de tolerancia del paciente con displasia broncopulmonar a las manipulaciones (fisioterapia), pacientes con riesgo muy alto de neumotórax.
Radiología de tórax
Aun cuando los antecedentes y la presentación clínica ayudan a presumir el diagnóstico específico de dificultad respiratoria en el RN, la radiografía de tórax, anteroposterior por lo general, es imprescindible para establecer un diagnóstico, concreto por una parte, pero también para valorar la evolución de la patología, la presencia de complicaciones (aire extraalveolar, infección nosocomial), la repercusión de las medidas terapéuticas (hiperinsuflación pulmonar por aumento de presión intrapulmonar en ventilación mecánica, evacuación de derrame pleural), localizar la posición de catéteres (vasos umbilicales, epicutáneos, drenajes torácicos) y del tubo endotraqueal. Para la interpretación de la radiografía de tórax se debe, en principio, valorar el grado de penetración, comparando la densidad de los cuerpos vertebrales y del espacio entre ellos, la rotación del tórax por asimetría de clavículas e hiperaireación de un hemitórax, la angulación inadecuada del haz de rayos X (hacia la cabeza se acompaña de horizontalización de las costillas o hacia los pies con las costillas en forma de abanico).
Antes del examen detallado cardiopulmonar se han de valorar huesos (descartar fracturas, formas anormales, número y asimetrías), partes (tejidos) blandas y posición del abdomen incluida en la radiografía de tórax. Identificar pliegues cutáneos de piel redundante, por lo general paralelos a la pared de tórax (no confundir con neumotórax), la imagen circular del agujero de la incubadora, la zona radiolucente en fosa supraesternal si hay tiraje supraesternal (no confundir con bolsón proximal esofágico en atresia de esófago). Presencia, localización, tamaño y forma de burbujas gástricas y asas intestinales, posición del hígado, trayecto de catéteres, etc.
Examen cardiopulmonar. Hallazgos normales
El clínico debe saber que en la radiografía de tórax del RN hay hallazgos que se consideran normales: desviación de la tráquea hacia el lado derecho, presencia de broncograma aéreo detrás de la silueta cardiaca, presencia de marcas perihiliares menos prominentes que en el niño mayor, en la porción media de los campos pulmonares, visualización de cisuras interlobares sobre todo de la cisura menor derecha, línea mediastínica por reflexión pleural. Con una buena inspiración el pulmón neonatal normal se expande de modo uniforme entre los arcos posteriores, dirigidos hacia abajo, de la octava y novena costillas. El diámetro de la silueta cardiaca normalmente es menor del 60% del total torácico. Frecuentemente puede verse aire dentro del esófago, pero si es muy llamativo o mantenido debe sospecharse la existencia de una fístula traqueoesofágica tipo H o un reflujo gástrico esofágico importante. En atresia de esófago, se identifica, por lo general, el bolsón aéreo esofágico superior.
Examen cardiopulmonar. Patrones anormales
Al examinar la radiografía de tórax es útil seguir un determinado orden, aunque en la práctica clínica esa aproximación secuencial se lleve a cabo, por lo general, tras la percepción global inicial que, a primera vista, conduce a formular una impresión diagnóstica la cual, en ocasiones, puede ser apresurada.
El orden recomendado sugiere separar, con la dificultad que ello implica, los siguientes apartados: aireación pulmonar (hiperinsuflación uni o bilateral, pulmones claros u oscuros, opacificación pulmonar), patrón parenquimatoso anormal generalizado (granular, brumoso o borramiento difuso, reticulonodular), presencia de burbujas aéreas pequeñas o grandes, aumento de marcas vasculares, líquido en cisuras, derrame pleural.
En la posterior descripción individualizada de las afecciones pulmonares se mencionan los hallazgos radiográficos característicos de cada entidad. En algunas afecciones, como alteraciones de vía aérea superior y tráquea y enfermedades congénitas del parénquima pulmonar (malformaciones quísticas del pulmón, secuestro pulmonar, etc), pueden ser necesarias otras exploraciones, como RM, TC o broncoscopia.
Función pulmonar
Los neonatos con dificultad respiratoria son atendidos en las unidades de cuidado intensivo neonatal (UCIN). Los pacientes más graves necesitan un soporte respiratorio como ayuda a su esfuerzo respiratorio espontáneo durante la etapa más crítica de su enfermedad. La mayoría de los respiradores de última generación, usados para la ventilación mecánica del RN con insuficiencia respiratoria grave, han incorporado la tecnología necesaria para medir la presión y flujo en la vía aérea en un área proximal. Es una gran ventaja disponer de una interfase que de modo continuo y en tiempo real proporcione información sobre la interacción entre el paciente y el ventilador con la información siguiente:
- Gráfica de las ondas de presión, flujo en vía aérea y volumen, por una parte, y de los bucles o curvas de presión-volumen y flujo-volumen.
- Datos numéricos de los parámetros del respirador seleccionados, o resultantes de la interacción ventilador/paciente: volumen corriente o tidal VT, frecuencia respiratoria mecánica y espontánea, volumen minuto (VM), flujo máximo o pico en inspiración, presión inspiratoria máxima o pico (PIP), presión positiva al final de la espiración (PEEP), tiempos inspiratorio (Ti) y espiratorio (Te).
- Mediciones y estimaciones de mecánica pulmonar: compliancia dinámica (VT/PIP - PEEP), compliancia del 20% final de la excursión de presión inspiratoria (C20) y cociente (C20/C), estática (VT/P estática - PEEP), resistencia o relación de presión a flujo en inspiración y espiración (Rva respiratoria, tubo endotraqueal incluido, = PIP - PEEP en cm H2O/flujo en L/seg), constante de tiempo en segundos del sistema respiratorio que se define como el producto de la compliancia por la resistencia (L/cm H2O x cm H2O/L/seg).
La información sobre la función pulmonar obtenida de este modo es de mayor utilidad cuando se valora junto a la cuidadosa observación clínica, la monitorización del pH y equilibrio ácido-básico y, en ocasiones, control radiológico. Los objetivos de estas ayudas son:
- La valoración de la situación respiratoria del paciente, estimando la gravedad de la afectación, la naturaleza preferentemente restrictiva (disminución de compliancia) u oclusiva (aumento de resistencia).
- Ayudar a los datos anamnésicos, clínicos y radiológicos a establecer el diagnóstico específico de la patología pulmonar.
- Evaluación del curso de la enfermedad, especialmente en patologías crónicas, como la displasia broncopulmonar.
- Ayudar a optimizar los diferentes parámetros, PIP, PEEP, VT, Ti, Te, flujo, grado de sincronización de la ventilación mecánica seleccionada, a mantenerla o cambiar de modalidad (intermitente mandatoria sincronizada, asistida controlada, controlada por volumen, controlada por presión, soporte de presión, ventilación de alta frecuencia oscilatoria).
- Aprovechar la información sobre el grado de sincronización del respirador a la demanda respiratoria del paciente (atención a las curvas de flujo, volumen y presión junto a observación de movimientos de tórax y ciclos del respirador), señalización de atrapamiento aéreo por tiempo espiratorio insuficiente (curva de flujo) y riesgo de PEEP inadvertida, pérdida de gas peritubo endotraqueal (menor volumen tidal espiratorio que inspiratorio, la porción espiratoria de la onda de presión no alcanza la línea cero, termina antes) que puede ser oído, mejor con fonendo, en los prematuros de menor peso o cuando el soporte respiratorio es muy importante.
- Valoración de los esfuerzos respiratorios del paciente (VT de las respiraciones espontáneas en el trazado de VT y en los datos numéricos en comparación con los propios de las respiraciones mecánicas, patrón respiratorio) para estar preparado para retirar la ventilación mecánica. La observación clínica del trabajo respiratorio espontáneo y de su repercusión en el estado general del neonato es de gran utilidad en este contexto.
- Ayuda para la indicación de intervenciones terapéuticas y para valorar el beneficio presumido de las mismas sobre la distensibilidad pulmonar, la resistencia de la vía respiratoria y, consecuentemente, sobre necesidades de suplemento de oxígeno y soporte mecánico respiratorio.
Tratamiento del recién nacido con dificultad respiratoria
En la dificultad respiratoria aguda, las medidas de soporte respiratorio constituyen el tratamiento más importante, en especial en los pacientes con insuficiencia respiratoria más grave. No obstante, toda una serie de estrategias, encuadrables como cuidados generales, son necesarias para evitar el empeoramiento de la dificultad respiratoria y la aparición de complicaciones pulmonares o de otros órganos y sistemas, sobre todo en los pacientes más vulnerables, como los RN pretérmino de muy bajo peso, los neonatos que han sufrido asfixia perinatal o septicemia grave. El tratamiento de la patología cronificada, como la displasia broncopulmonar, es complejo pues son muchas las dianas (vía aérea, pulmón, circulación pulmonar, infección, malnutrición, posible morbilidad neurológica) a las que dirigir las medidas de soporte respiratorio y las generales para prevenir o aminorar las potenciales complicaciones a nivel cardiopulmonar y en otros órganos y sistemas. En algunos de los cuadros de dificultad respiratoria neonatal se añaden, al soporte respiratorio y a los cuidados generales, medidas terapéuticas concretas, como la administración intratraqueal del surfactante en el cuadro clínico de enfermedad de membrana hialina, la antibioterapia en la infección pulmonar, el cierre farmacológico del ductus arteriosus persistente con ibuprofeno o indometacina, el óxido nítrico inhalado en hipertensión pulmonar, evacuación del neumotórax con catéter insertado en el tórax.
Cuidados generales
Son muchas las atenciones y controles que desde el comienzo del cuadro de dificultad respiratoria y durante su evolución y recuperación requieren estos neonatos. A continuación se enumeran los principios básicos de los cuidados generales más necesarios de conocer.
Transporte a la unidad de cuidados intensivos neonatales (UCIN)
Se debe realizar por enfermeras y médicos neonatólogos, después de conseguir una estabilización cardiopulmonar suficiente para evitar el deterioro durante el traslado. Es obligado, con la excepción del RN asfíctico con riesgo de encefalopatía hipóxico-isquémica, evitar la hipotermia, amenaza muy importante tras el nacimiento en el RN de muy bajo peso al que se debe proteger con una bolsa de polietileno colocada tras nacer en la sala de partos. El soporte respiratorio necesario para el transporte dependerá de la valoración clínica del grado de dificultad respiratoria con el test de Silverman, de la saturación de la hemoglobina monitorizada con el pulsioxímetro y de la edad gestacional y madurez del RN. En muchos hospitales se introduce un tubo endotraqueal para administrar surfactante y poner en ventilación mecánica a los RN de muy bajo peso, sobre todo en los menores de 700-800 g. El soporte respiratorio con una presión de distensión continua por vía nasal (CPAPn) tras nacer es una práctica frecuente en los prematuros con dificultad respiratoria moderada o grave.
Cuidados inmediatos tras el ingreso en la UCIN
Al llegar a la UCIN se ha de colocar en incubadora con temperatura elegida en el rango seleccionado por su peso, edad gestacional y postnatal como ambiente térmico neutro, para tratar de minimizar el consumo de oxígeno. Los RN con hipoxia no tienen capacidad para aumentar la tasa metabólica y producción de calor, cuando están sometidos al estrés de la hipotermia, por lo cual entrarían en hipotermia con los potenciales riesgos de acidosis metabólica, hipoglucemia, aumento de la resistencia vascular pulmonar; en casos más extremos, alteraciones de la coagulación y sangrado pulmonar y, sobre todo, una mayor mortalidad neonatal. La hipertermia yatrogénica, al tratar de evitar la hipotermia, se acompaña, al igual que el estrés por frío, de un aumento del consumo de oxígeno y de la tasa metabólica que conduce a taquicardia, polipnea, irritabilidad, respiración periódica y apnea; la hipertermia grave puede producir deshidratación, acidosis y lesión cerebral. Con el RN ingresado y tras la aproximación clínica inicial al probable diagnóstico del cuadro de dificultad respiratoria, se solicitarán las exploraciones complementarias necesarias para valorar el grado de insuficiencia respiratoria y para precisar el diagnóstico específico de la dificultad respiratoria.
Estabilidad hemodinámica
En todo paciente con dificultad respiratoria importante se busca la estabilidad hemodinámica, para evitar o corregir una disminución del gasto cardiaco que ocasionaría un menor transporte de oxígeno a las células; igualmente se debe evitar o tratar los aumentos bruscos y sostenidos de la tensión arterial, por el riesgo de hemorragia intraventricular en los primeros días de vida en los RN de muy bajo peso, así como por el riesgo que supone para el corazón, en ocasiones ya comprometido, el aumento de la poscarga. De los diferentes escenarios clínicos de RN con dificultad respiratoria, se destacan en este capítulo los siguientes:
- En el RN menor de 1.000 g y con EMH al que frecuentemente se administra surfactante por vía traqueal, se debe evitar la sobredistensión pulmonar al aumentar la compliancia, la disminución del retorno venoso y gasto cardiaco; por ello, es necesario vigilar estrechamente (clínica, parámetros de ventilación mecánica, imagen radiológica, circulación sistémica) las variables implicadas. Los menores de 1.000 g presentan frecuentemente valores de TA media en mmHg inferiores al valor de la edad gestacional en semanas, lo que exige buscar alguna posible razón como: disminución de precarga, hipovolemia por sangrado materno o hemorragia intracraneal, disfunción miocárdica o septicemia. Debe valorarse la repercusión de la presumible hipotensión arterial en los diferentes órganos y sistemas, muy especialmente en el sistema nervioso central, aun cuando ello constituye un reto en la actualidad para el quehacer clínico y finalmente, si se considera necesario elevar la tensión arterial, elegir la terapéutica más pertinente, atendiendo a la posible causa del paciente en concreto. Se valorarán además de las medidas específicas según etiología, la expansión de la volemia (10 mL/kg de suero salino 0,9%), el uso de inotrópicos e hidrocortisona en casos refractarios. Otro hallazgo frecuente en RN de muy bajo peso es la presencia de un conducto arterioso permeable (DAP) con cortocircuito izquierda-derecha, al disminuir la presión arterial en la arteria pulmonar cuando mejora la patología pulmonar y disminuye la resistencia vascular pulmonar. Por otra parte, el robo de sangre en el circuito sistémico puede ocasionar complicaciones en cerebro, tracto gastrointestinal y riñón por hipoperfusión. En algunos hospitales se utiliza indometacina de modo profiláctico y en otros, ibuprofeno o indometacina en presencia de un DAP con repercusión hemodinámica.
- Un segundo escenario menos frecuente es el del RN con asfixia perinatal con disfunción miocárdica, en ocasiones con aspiración pulmonar de meconio y en ventilación mecánica. En estos pacientes es obligado vigilar el rendimiento miocárdico, la función pulmonar, valorar la existencia de hipertensión pulmonar y, como en todo paciente con afectación cardiopulmonar importante en ventilación mecánica, prestar mucha atención a la influencia que sobre la función miocárdica y recambio gaseoso pulmonar tienen los cambios de presión intrapul153 monar y presión vascular pulmonar, determinantes de la interacción mecánica cardiopulmonar. El neonato que ha sufrido asfixia perinatal puede tener afectación de otros órganos y sistemas, junto al corazón y pulmón, por el insulto hipóxico-isquémico, sobre todo encéfalo, riñón, hígado, tracto gastrointestinal.
Control del equilibrio ácido-básico
El RN con insuficiencia respiratoria aguda, muchas veces en ventilación mecánica, presenta con frecuencia acidosis metabólica y respiratoria y, ocasionalmente, alcalosis respiratoria. En la patología pulmonar crónica, displasia broncopulmonar por lo general, la respuesta renal a la hipercapnia crónica y, con frecuencia, al uso prolongado de diuréticos, conduce al desarrollo de alcalosis metabólica.
Acidosis metabólica en la insuficiencia respiratoria aguda
La causa más frecuente es la falta de O2 a nivel mitocondrial secundaria, sobre todo, a hipoxemia arterial y en ocasiones a hipoperfusión, anemia y sepsis. La insuficiencia respiratoria avanzada, en ausencia de un soporte respiratorio y de nutrientes aceptable, puede conducir a un estado catabólico con acúmulo de ácidos inorgánicos, nitratos y fosfatos, que contribuirán a la acidosis metabólica. El RN a término normal presenta un déficit de bases de 3 a 5 mEq/L. Con valores entre 5-10 mEq/L, si la exploración clínica (relleno capilar, circulación periférica, gradiente de temperatura centralperiférica, diuresis) hace presumir una aceptable perfusión tisular no es necesaria la administración de bicarbonato sódico. Si el déficit de bases es mayor de 10 mEq/L se debe realizar una valoración rápida y cuidadosa en busca de signos de hipoperfusión, pues cuando ésta existe se deben identificar las causas presumibles de la acidosis metabólica y tratar de corregirla, dado que ello es una aproximación más efectiva, y de menor riesgo, que la administración de bicarbonato sódico como suplemento de bases. Cuando la deficiencia de bases no disminuye actuando sobre las causas determinantes, el pH es menor de 7,20, existe hipoperfusión periférica y preocupación por una menor síntesis de surfactante o aumento de la resistencia vascular pulmonar, se puede administrar bicarbonato sódico 1/6 molar de modo lento (menos de 0,5 mmol/min) y en la cantidad mínima necesaria para elevar el pH por encima de valores de riesgo (7,15-7,20).
La cautela en el uso de bicarbonato sódico en los neonatos ingresados en CIN está muy presente en la actualidad, destacándose como posibles efectos adversos de su uso: fluctuaciones en el flujo sanguíneo cerebral, hemorragia intracraneal, disminución del transporte de oxígeno a los tejidos, empeoramiento de la acidosis intracelular, agravamiento de la lesión miocárdica y deterioro de la función cardiaca.
Alteración de la pCO2 en la insuficiencia respiratoria aguda
En estos pacientes es frecuente la acidosis respiratoria por hipercapnia, por lo general junto a acidosis metabólica. Cuando la hipercapnia es aguda e importante, en las primeras horas/días de vida comporta un riesgo de vasodilatación cerebral con aumento del flujo sanguíneo cerebral y amenaza de hemorragia intraventricular en el RNMBP. Además, facilita la hipoxemia, menor PAO2 por aumento de PACO2, y una menor incorporación de O2 por la hemoglobina. Por último, en el grupo de los RN de peso extremadamente bajo, supone la hipercapnia un riesgo adicional para el desarrollo de retinopatía de la prematuridad. Un cierto grado de permisividad con la hipercapnia es aceptable, pues se ha asociado a una menor incidencia de displasia broncopulmonar, por lo cual en los RN con dificultad respiratoria más maduros, y en los menores de 1,5 kg pero mayores de 1 semana que están en periodo de desacostumbramiento del soporte respiratorio, se aceptan valores de pCO2 elevados (hipercapnia permisiva), siempre que el neonato esté clínicamente estable, con un trabajo respiratorio no excesivo y con unos valores de pH y de bases satisfactorios. Además de la disminución de volutrauma y de lesión pulmonar, se reduce la duración de ventilación mecánica y se facilita la cesión de O2 a los tejidos.
La hipocapnia grave, pCO2 menor de 25-30 mmHg, y brusca es una amenaza muy importante para el cerebro pues provoca vasoconstricción y disminución del flujo sanguíneo cerebral, con riesgo importante de leucomalacia periventricular, pérdida auditiva y parálisis cerebral. Causada por un aumento de la ventilación alveolar (VA = volumen corriente - volumen del espacio muerto x frecuencia), por lo general por falta de control de los parámetros del respirador y ausencia de monitorización transcutánea de pCO2, conlleva un aumento del riesgo de aire extraalveolar y de displasia broncopulmonar. Por todo ello, es obvio que debe evitarse y corregirse rápidamente si se presenta.
Alcalosis metabólica en la displasia broncopulmonar con hipercapnia crónica
La respuesta renal en estas situaciones es el aumento en la reabsorción de bicarbonato, principalmente en el túbulo proximal, causa de sus elevados niveles y de los disminuidos de cloro por el aumento de su excreción urinaria. En estos pacientes es frecuente el uso de furosemida, hidroclorotiazida y espironolactona, que pueden ocasionar depleción de cloro y potasio, contracción del espacio extracelular y alcalosis metabólica, que si es grave desencadena una hipoventilación compensadora para normalizar el pH sanguíneo. La expresión del trastorno en el balance ácido-básico, entre la acidosis respiratoria sostenida y el uso prolongado de diuréticos, depende de la influencia predominante, pudiendo en ocasiones obtenerse un pH superior a 7,40 en el espacio extracelular.
En estos pacientes es importante, además del patrón más frecuente de pH y sus cambios, el análisis cuidadoso de los mecanismos compensadores renal y pulmonar y de las pérdidas urinarias de cloro, potasio, sodio, calcio y magnesio para evitar intervenciones médicas erróneas y corregir los déficits electrolíticos severos.
Fluidoterapia y nutrición
En el grupo de RN de muy bajo peso con EMH un aumentado aporte de fluidos en los primeros días de vida puede incrementar la incidencia de DAP, DBP y enterocolitis necrosante. Por otra parte, con un aporte de sólo 60 mL/kg/día y el 10% del aporte calórico como aminoácidos puede mantenerse un balance nitrogenado positivo. En todo RN ingresado en CIN, especialmente en los menores de 1.000 gramos de peso, se deben vigilar los valores de Na, K, Cl, Ca, Mg y glucemia con determinaciones secuenciales, para llevar a cabo los ajustes necesarios en los aportes y lograr el mantenimiento de los niveles plasmáticos en rangos adecuados.
Los RN con trastornos respiratorios agudos tienen un trabajo respiratorio aumentado lo que conduce a un incremento en el gasto energético y en el consumo de oxígeno. A pesar de ello, el aporte calórico y de nutrientes es menor del recibido por los RN sin dificultad respiratoria. A los neonatos con dificultad respiratoria aguda grave se añaden frecuentemente otras situaciones de estrés (dolor, falta del descanso adecuado, estímulos adversos, patologías añadidas) facilitadoras de catabolismo proteico (concentraciones sanguíneas aumentadas de cortisol, catecolaminas y citocinas proinflamatorias).
Las situaciones señaladas, junto a las repercusiones de la enfermedad y de las terapéuticas empleadas sobre digestión, absorción, metabolismo y excreción, entorpecen el aprovechamiento adecuado de los nutrientes. Es obligado señalar la disminuida reserva calórica y de todo tipo de sustratos en los nacidos antes de las 30 semanas de gestación y en los desnutridos durante la vida fetal. Por otra parte, la reparación de los tejidos lesionados en la patología del paciente requiere contemplar las necesidades energéticas, nitrogenadas y de nutrientes que ello supone. No existen, salvo excepciones, estudios prospectivos bien diseñados sobre los problemas mencionados pero la práctica clínica ha incorporado la necesidad del aporte precoz de energía, nitrógeno y de nutrientes específicos (como la vitamina A, en los menores de 1.000 gramos con alto riesgo de DBP) para tratar de reducir la duración del soporte respiratorio, la desnutrición e hipocrecimiento, incluido el de los músculos respiratorios, y los adversos efectos a medio y largo plazo, en especial sobre el cerebro.
Un aporte de glucosa en el nacido a término superior a 40 kcal/kg/día (10 g/kg/día) se acompaña de lipogénesis a partir de la glucosa por haber sido superada la capacidad oxidativa máxima de glucosa, con aumento de la producción de CO2, que puede causar un aumento en la PaCO2 en pacientes con disminución de la ventilación alveolar, como sucede en el neonato con grave dificultad respiratoria aguda o crónica. En esta situación de estrés, con aumento de los niveles de catecolaminas, glucagón y cortisol, es frecuente la hiperglucemia, con los aportes recomendados de glucosa, por neoglucogénesis y resistencia a la insulina a niveles hepático y periférico.
El aporte de 1-1,5 g/kg/día de aminoácidos desde el nacimiento es suficiente para evitar el catabolismo proteico en la mayoría de los RN. Se incrementan los aportes hasta 3-3,5 g/kg/día en los menores de 1.500 g a los 2-3 días de vida.
Con la administración de 0,5-1 g/kg/día de una emulsión lipídica (Intralipid ® 20% o Lipofundina ® MCT/LCT 20%) puede evitarse la deficiencia de ácidos grasos esenciales. Cuando la administración intravenosa se realiza a lo largo de las 24 horas y no supera el aporte de 2 (sin evidencia de sepsis) a 3 g/kg/día, el riesgo de efectos adversos en neonatos con patología pulmonar es clínicamente irrelevante. En pacientes con DBP con hipertensión pulmonar ha sido señalado que el aporte de 3 g/kg/día de Intralipid ® puede provocar aumento de resistencia vascular pulmonar.
Los RN con dificultad respiratoria grave pueden presentar íleo con ausencia de peristaltismo, vaciamiento gástrico retrasado, ausencia de ruidos intestinales y de emisión de meconio. A pesar de ello, existen razones para iniciar lo antes posible un aporte mínimo (0,5-1 mL/h) de nutrientes por vía enteral, con fines tróficos para el enterocito, desarrollo enzimático e inicio de la peristalsis. Durante este periodo de nutrición enteral mínima, la presencia de un DAP, el uso de indometacina, y la hipotensión arterial sistémica, frecuentes en los primeros días de vida del menor de 1.000 g, pueden acompañarse de una menor perfusión en el territorio esplácnico, induciendo al clínico a interrumpir o no progresar en el aporte enteral de nutrientes. El aumento progresivo del aporte enteral de nutrientes, pasada la etapa de nutrición enteral trófica, obliga, en especial en los pacientes con dificultad respiratoria de evolución más tórpida, a no subestimar el compromiso que supone el llenado gástrico para el desplazamiento diafragmático de las respiraciones espontáneas que, en los RN más inmaduros, sobre todo si tienen una sonda nasogástrica (aumento de resistencia nasal) o gafas nasales para administrar un flujo de aire suplementado con oxígeno, puede facilitar la aparición de hipoxemia, bradicardia y apnea. La alimentación oral supone para el neonato con lesión pulmonar residual un esfuerzo muscular añadido, peor tolerado si el entrenamiento es pobre, en presencia de valores de hemoglobina en límites bajos, existencia de problemas en succión-deglución de origen central.
Otros cuidados
Otras medidas, también de vital importancia en el cuidado de estos neonatos, son: la prevención de la colonización e infección (bacterias, hongos y virus) respiratoria y sistémica, la atención a las alteraciones de la coagulación y a la anemia, yatrogénica en gran medida, la analgesia y la sedación pertinentes, el manejo mínimo o imprescindible, la atención individualizada al desarrollo y el cuidado centrado en la familia.
Soporte respiratorio
El término de soporte respiratorio puede usarse para englobar las estrategias terapéuticas destinadas a mantener un recambio gaseoso adecuado a nivel pulmonar hasta que se haya solucionado el problema que causó el fallo de la función respiratoria en el intercambio de O2 y CO2.
Las medidas terapéuticas más empleadas en la actualidad, de menor a mayor agresividad y complejidad, incluyen: oxigenoterapia o suplemento de oxígeno, en el aire ambiente que respira o administrado a través de gafas o cánulas nasales, aplicación de presión positiva continua por vía nasal (CPAPn) a través de cánulas nasales, tubo nasofaríngeo unilateral o mascarilla, ventilación mecánica no invasiva (sin tubo endotraqueal) por vía nasal a través de cánulas nasales o mascarilla, con insuflaciones programadas por el operador o sincronizadas (sensor abdominal) con las inspiraciones espontáneas del paciente, ventilación mecánica invasiva (a través de tubo endotraqueal), y ventilación de alta frecuencia. Los objetivos de estas estrategias terapéuticas usadas en el neonato con dificultad respiratoria son buscar para cada paciente el soporte respiratorio menos agresivo y durante el menor tiempo posible, para minimizar la lesión pulmonar, la toxicidad del oxígeno a nivel de los diferentes órganos y sistemas y otras complicaciones, aún presentes a pesar de los progresos realizados, como hipocapnia grave, alteraciones hemodinámicas significativas por aumento de la presión intrapulmonar, infección pulmonar/sistémica nosocomial.
Los objetivos gasométricos del soporte respiratorio en el RN con dificultad respiratoria aguda son los siguientes: a) en el RN pretérmino, PaO2 50-60 mmHg, saturación de O2 (pulsioximetría) 88-92% y PaCO2 4555 mmHg. En la insuficiencia respiratoria mantenida o crónica se permiten valores más altos de PaCO2 (hipercapnia permisiva), por lo general con valores de bicarbonato y exceso de bases elevados por compensación renal por lo que los valores de pH no son inferiores a 7,20-7,25; b) los valores en el RN a término son: PaO2 50-70 mmHg, saturación de O2 9295% y PaCO2 45-55 mmHg, siendo también válida la hipercapnia permisiva en determinadas circunstancias.
En el momento actual el soporte respiratorio utilizado en cada patología pulmonar específica (EMH, neumonía, síndrome de aspiración meconial, hernia diafragmática congénita, displasia broncopulmonar) suele ser bastante similar en las diferentes UCIN, existiendo guías clínicas relativamente parecidas. Las innovaciones en los sistemas y modelos de aplicación de las diferentes estrategias de soporte respiratorio previamente señaladas van siendo incorporadas en las UCIN, tras la obligada etapa de aprendizaje y entrenamiento de médicos y enfermeras.
En la llamada ventilación mecánica convencional, las modalidades más usadas en patología pulmonar neonatal en el momento presente son aquellas en las que el respirador se adapta al patrón respiratorio propio del paciente, bien sea la ventilación mecánica sincronizada con todas las respiraciones espontáneas del paciente (ventilación asistida controlada) o la sincronización en sólo un número de ciclos por minuto seleccionado por el operador (ventilación intermitente mandatoria asistida o sincronizada). Otra modalidad de ventilación mecánica convencional, que se usa añadida a la sincronización y es utilizada prácticamente en todas las UCIN, es la ventilación con un volumen garantizado (VG) seleccionado (4-8 mL/kg), que ofrece la ventaja de enviar al paciente el volumen corriente elegido, con independencia de los cambios de compliancia o resistencia del sistema respiratorio, evitando la lesión en vía aérea y alvéolos producida por volúmenes tidales inspiratorios muy elevados (volutrauma) y el riesgo de hiperventilación inadvertida e hipocapnia muy grave, se reduce también la duración de la ventilación mecánica y disminuyen los valores de citocinas proinflamatorias en el aspirado traqueal. Puede aplicarse con cualquier modalidad de ventilación mecánica convencional.
La ventilación con soporte de presión (PSV) es otra modalidad en la cual cada respiración espontánea del paciente, como en la modalidad asistida controlada (AC), es ayudada por un pico de presión cuyo inicio controla el RN pero que, a diferencia de la AC, el final de la inspiración termina cuando el flujo inspiratorio desciende a un umbral seleccionado (10-20%) respecto al pico máximo de flujo. En esta modalidad, el paciente regula la duración del tiempo de inspiración de cada ciclo por lo cual, en principio, proporciona una sincronización completa pacienteventilador, disminuyendo el trabajo respiratorio. Los cortos tiempos de inspiración pueden facilitar la atelectasia si no se aplica una presión positiva al final de la espiración (PEEP) adecuada para mantener la presión media en la vía aérea.
En nuestro medio las modalidades descritas son muy utilizadas como ventilación mecánica de inicio (AC con VG, PSV con VG) o como ventilación mecánica en la etapa de desacostumbramiento del respirador (PSV con VG, SIMV con VG, AC con VG). En los últimos años se ha incorporado, para evitar la ventilación mecánica invasiva y sus riesgos, el uso como soporte respiratorio inicial de la CPAP nasal con o sin ciclos de presión de insuflación añadidos, que en el RN inmaduro con distrés respiratorio por déficit de agente tensioactivo se aplica muy precozmente con la administración de surfactante en ocasiones.
Otra estrategia terapéutica que comienza a ser utilizada en neonatología es el “reclutamiento alveolar” o concepto de “pulmón abierto” aplicando una PEEP adecuada en ventilación mecánica convencional, que había sido utilizada desde hace años en ventilación de alta frecuencia como estrategia de volumen pulmonar óptimo. El objetivo de la aplicación del nivel de PEEP adecuado, según el valor de la compliancia pulmonar, es abrir los alvéolos atelectasiados para que aumente la compliancia. El volumen corriente seleccionado y garantizado (VG) será distribuido de un modo más uniforme en la población total de alvéolos, los abiertos previamente y los reclutados, evitando que se hiperdistiendan y lesionen los alvéolos ya abiertos antes de la maniobra de reclutamiento, disminuyendo por ello la cuantía del cortocircuito intrapulmonar y, consecuentemente, la FiO2. La información gráfica y numérica en tiempo real de la función pulmonar es necesaria para la realización de las maniobras de reclutamiento alveolar.
En los últimos años las estrategias de ventilación mecánica señaladas han demostrado ser útiles para minimizar la lesión pulmonar inducida por el ventilador convencional, por lo que la ventilación de alta frecuencia oscilatoria (VAFO) con volúmenes tidales más pequeños que el espacio muerto anatómico, eficaces para el recambio gaseoso y efectivos para la prevención y tratamiento de la lesión pulmonar, ha visto disminuido el entusiasmo para su uso como terapéutica de inicio en la dificultad respiratoria neonatal, utilizándose como terapéutica de rescate de neonatos en ventilación mecánica convencional que presentan enfisema intersticial importante, neumotórax, hipoxemia/desaturación y/o hipercapnia incontrolables, y en los que las maniobras de reclutamiento descritas con VMC no han logrado su objetivo. En algunos de estos pacientes, se utiliza a veces de modo combinado VAFO y VMC.
El cuidado del RN en ventilación mecánica abarca toda una serie de intervenciones a cargo de enfermeras neonatales entrenadas: aspiración de secreciones del tubo endotraqueal, fisioterapia respiratoria, vigilancia de la humedad y temperatura de los circuitos del respirador, control del funcionamiento de los tubos y resto del sistema, de drenaje torácico de neumotórax, posicionamiento del niño, influencia en las variables de función pulmonar monitorizadas de las diferentes intervenciones (aseo, exploración física, analgesia, sedación y otros fármacos, cuidado canguro, exámenes radiológicos y ecográficos, peso del bebé). La responsabilidad de la enfermera en la atención global de estos pacientes ha aumentado en UCIN con mejores resultados.
La retirada del soporte respiratorio, en especial cuando el paciente está sometido a ventilación mecánica, aun cuando ha de realizarse lo antes posible para disminuir los riesgos acompañantes, debe llevarse a cabo de manera muy ordenada para evitar si es posible los fracasos, a veces repetidos, de la extubación. El desacostumbramiento del respirador (destete o weaning) es el proceso a lo largo del cual el trabajo respiratorio realizado por el ventilador para a ser asumido por el RN conforme se va disminuyendo el nivel de soporte respiratorio de la máquina. Los datos que sugieren el inicio del desacostumbramiento son: la mejora en el recambio gaseoso que permite disminuir la FiO2 y el grado de soporte mecánico y el aumento en el número y fuerza de las respiraciones espontáneas.
Aun cuando hoy se realiza una desescalada progresiva del soporte respiratorio más agresivo, usando tras la extubación medidas de soporte menos invasivas como la CPAP, se requiere, no obstante, combinar el razonamiento fisiopatológico sobre las numerosas variables predictoras de potencial éxito o fracaso en la extubación, junto a la atención cuidadosa y detallada de enfermeras y médicos para captar los mensajes que ofrecen la observación clínica y los monitores.
Neumopatías infecciosas
En la infección pulmonar neonatal pueden diferenciarse dos grandes grupos de procesos desde el punto de vista clínico y etiológico, la bronconeumonía precoz con manifestaciones clínicas en los 2-3 primeros días de vida, y la infección pulmonar tardía, bien de origen nosocomial en RN ingresados y generalmente sometidos a ventilación mecánica, o adquirida en la comunidad.
La etiología de la infección pulmonar precoz es similar a la de la sepsis neonatal precoz, siendo Streptococcus agalactiae, E. coli, y Listeria monocytogenes los agentes causales más frecuentes. Si existen antecedentes de candidiasis vaginal, corioamnionitis, herpes genital o procesos respiratorios agudos maternos previos al parto se debe investigar la presencia de especies de Candida, Ureaplasma urealyticum, virus herpes, adenovirus o enterovirus. Puede afectar tanto al RN a término como a pretérmino. Además de taquipnea y retracciones, con hipoxemia e hipercapnia variables según la gravedad, la afectación importante del estado general, acidosis metabólica y tendencia a la apnea precoz son datos clínicos que sugieren infección. Neutropenia o aumento de formas inmaduras en el recuento y fórmula leucocitaria e incremento de proteína C reactiva o procalcitonina son hallazgos frecuentes en la infección bacteriana o por hongos y no suelen estar alterados en los otros cuadros de dificultad respiratoria neonatal precoz. El patrón radiológico más característico consiste en condensaciones bronconeumónicas inhomogéneas distribuidas por ambos campos pulmonares, pero puede ser semejante al descrito en la enfermedad de membrana hialina o en la maladaptación pulmonar. En la infección pulmonar precoz es muy poco frecuente la neumonía afectando solamente a un lóbulo o pulmón. Debido a la extrema gravedad y rápida evolución fatal de la sepsis precoz con participación pulmonar, el tratamiento antibiótico debe iniciarse ante la sospecha clínica, después de obtener muestras para hemocultivo, hemograma y reactantes de fase aguda. De modo empírico, ampicilina asociada a un aminoglicósido son los fármacos de elección. Si se sospecha o existe confirmación de alguno de los otros agentes etiológicos anteriormente señalados (hongos, herpes, ureaplasma, etc) se iniciará el tratamiento adecuado (véase capítulo correspondiente). Las neumonías por Chlamydia o Mycoplasma, aunque de transmisión vertical, suelen iniciar la sintomatología pasada la primera semana de vida y requieren pruebas diagnósticas serológicas o de cultivo específicas cuando se sospechen.
En la infección pulmonar precoz grave, por la hipoxemia, hipercapnia y acidosis, junto con el compromiso hemodinámico se puede asociar un cuadro de hipertensión pulmonar persistente neonatal con cortocircuito derecha-izquierda a través del foramen oval y/o ductus arterioso que pueden agravar la hipoxemia y requerir tratamiento con óxido nítrico inhalado.
El factor diferencial más importante en la infección pulmonar tardía es la diferente epidemiología. La infección nosocomial se produce en grandes inmaduros o RN a término con patología quirúrgica que requieren intubación traqueal prolongada. Desde el punto de vista clínico el cuadro es de comienzo más insidioso, con un aumento de las necesidades de soporte respiratorio pero con una afectación del estado general menos importante que en la infección precoz. La etiología depende de la situación epidemiológica de la unidad; los aislamientos más frecuentes son Klebsiella pneumoniae, Pseudomonas aeruginosa, Enterobacter cloacae, Burkholderia o Stenotrophomona. La antibioterapia debe basarse en los datos de sensibilidad del mapa epidemiológico de la unidad y en el antibiograma de los cultivos.
Los agentes etiológicos de la infección pulmonar adquirida en la comunidad son los mismos que afectan a otros lactantes y niños, sobre todo S. pneumoniae, S. aureus, H. influenzae, virus respiratorio sincitial, etc. La investigación epidemiológica de posibles contactos (padres, hermanos, cuidadores), incluyendo el despistaje de tuberculosis endometrial o pulmonar materna si la etiología no está clara, son de utilidad junto con los datos de laboratorio para el diagnóstico y para orientar el tratamiento antibiótico.
Síndrome de dificultad respiratoria
Entre los cuadros de dificultad respiratoria de comienzo inmediato al nacimiento, la enfermedad de membrana hialina o síndrome de dificultad respiratoria neonatal, por sus especiales características, se estudia en otro capítulo.
Maladaptación pulmonar (MP)
La denominación de este cuadro, tomada de Hjalmarson, es equivalente a otras denominaciones, como taquipnea transitoria del RN, pulmón húmedo o distrés respiratorio tipo II. Es la entidad que con mayor frecuencia produce dificultad respiratoria de comienzo inmediato al nacimiento; su incidencia se ha estimado entre 1 y 5%, siendo más frecuente en los pretérminos entre 30 y 36 semanas.
Patogenia
La persistencia de excesivo líquido pulmonar tras el nacimiento se considera el factor etiológico más importante y ello puede ser debido a un defecto de reabsorción y eliminación del líquido que rellena los alvéolos pulmonares en la vida fetal, o bien a una aspiración en el parto de líquido amniótico claro. También se atribuye a inmadurez y/o retraso o mal funcionamiento de los mecanismos que modifican el comportamiento de los canales de sodio que permanecen cerrados en la vida fetal y son activados entre otros factores por la estimulación adrenérgica que se produce en torno al nacimiento, permitiendo la reabsorción de líquido pulmonar. El factor de riesgo más importante de malaadaptación pulmonar es el nacimiento mediante cesárea con o sin trabajo de parto previo, en cuyo caso, además de la posible falta de adaptación hormonal, se suma la falta de compresión torácica y evacuación de líquido pulmonar que se produce al paso por el canal del parto y que condiciona un menor volumen de gas torácico después de un nacimiento por cesárea comparado con el de un parto vaginal. Otros factores predisponentes son prematuridad, sexo masculino, antecedentes de asma en la familia, y diabetes materna. La mecánica respiratoria en la MP se caracteriza por una disminución moderada de la distensibilidad, y valores más bajos de volumen corriente y ventilación alveolar que, aunque están parcialmente compensados por el aumento de frecuencia respiratoria, condicionan en los casos más graves un aumento de los valores de PCO2.
Cuadro clínico
Los síntomas de dificultad respiratoria, taquipnea, retracción sub e intercostal y quejido espiratorio pueden comenzar desde el nacimiento o en las dos primeras horas de vida, alcanzando su máxima gravedad en la mayoría de los casos antes de las 12 horas de vida. Las necesidades de oxígeno suplementario para mantener una oxigenación adecuada son variables, raramente superiores al 40%, y la FiO2 máxima suele alcanzarse antes de las 12 horas de vida. Posteriormente las necesidades de oxígeno empiezan a descender y los signos que indican un aumento del trabajo respiratorio, retracciones, aleteo nasal, quejido, disminuyen su intensidad aunque la taquipnea, con respiración más superficial, persiste entre 24 y 72 horas. Las gasometrías antes de las 6-12 horas de vida pueden mostrar moderada hipoxemia y ligero aumento de la PCO2 con normalización posterior, incluso antes de que los signos clínicos remitan. En la Rx de tórax se pueden observar en diferente grado marcas broncovasculares perihiliares prominentes, condensaciones inhomogéneas difusas, volumen pulmonar adecuado (diafragma a nivel de la 9a costilla) o con ligera hiperinsuflación y, en algunos casos, ligero derrame pleural o líquido en cisuras (Fig. 2.17.1).
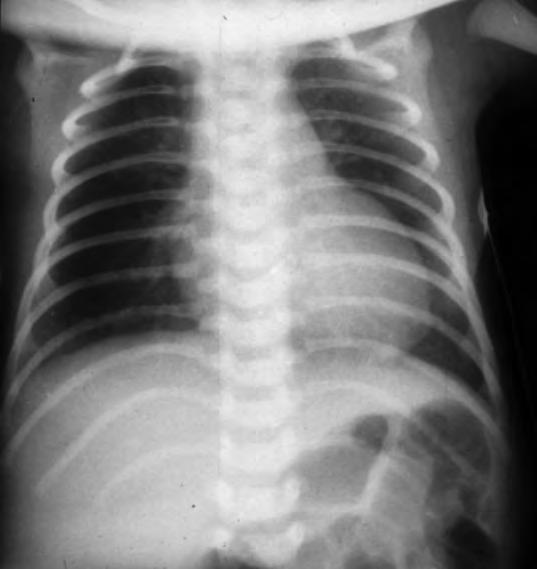
Diagnóstico diferencial
En la fase inicial el cuadro es clínicamente indistinguible de una enfermedad de membrana hialina o una infección pulmonar precoz, aunque en estos últimos, en general, hay mayor afectación del estado general y repercusión hemodinámica. La Rx de tórax es de utilidad para diferenciar la EMH y la MP pero no la infección pulmonar precoz. Antecedentes perinatales o datos de laboratorio sugestivos de infección (véase sección de infección pulmonar), y la mayor afectación del estado general son los datos que sugieren la posibilidad de infección. Resulta difícil diferenciar la contribución de una posible aspiración de líquido amniótico claro al retraso del aclaramiento del líquido pulmonar puesto que en ambos casos la fisiopatología y los cambios clínicos son similares.
Tratamiento
No se dispone de un tratamiento específico de la MP. Fluidoterapia y control de glucemia junto con oxigenoterapia para mantener saturaciones de oxígeno adecuadas son las medidas básicas. El empleo de PPC (CPAP nasal) puede disminuir el trabajo respiratorio en las fases iniciales y acelerar la reabsorción de líquido pulmonar. El pronóstico es en general bueno y el curso, autolimitado. La medida profiláctica más eficaz sería disminuir lo más posible los nacimientos por cesárea y, especialmente, aquellas que se realizan sin trabajo de parto previo.
Distrés respiratorio leve
Se incluyen en este grupo, según la clasificación de Hjalmarson, cuadros de dificultad respiratoria que se inician al nacimiento o en los primeros minutos de vida pero con una evolución muy recortada, duración inferior a 4-6 horas y menor intensidad que en la maladaptación pulmonar de la taquipnea, retracciones y quejido espiratorio, sin alteraciones gasométricas ni radiológicas significativas y con nulas o mínimas necesidades de oxígeno suplementario.
Pulmón seco
Esta “pseudohipoplasia pulmonar” se ha descrito en RN de muy bajo peso con antecedentes de oligoamnios, generalmente por rotura de membranas de más de una o dos semanas de duración. La Rx de tórax muestra un volumen pulmonar disminuido con 5-6 espacios intercostales, a veces con buena aireación del parénquima y en otras ocasiones con atelectasia probablemente por una enfermedad de membrana hialina asociada y frecuentemente con datos ecocardiográficos o clínicos (gradiente pre-postductal de saturación de oxígeno) de hipertensión pulmonar persistente neonatal. Es reversible en 24-48 horas, pero necesita inicialmente altas presiones del ventilador (PI de 30 cm H2O y PPER de 6 cm H2O) y FiO2 elevada, debiendo vigilarse la posibilidad de escape aéreo. El diagnóstico diferencial debe hacerse con la hipoplasia pulmonar verdadera, no reversible o de evolución mucho más complicada, en la que el oligoamnios forma parte, junto con deformidades articulares y una facies característica por compresión fetal, del síndrome de Potter, con agenesia o malformaciones renales graves o con rotura de membranas muy prolongada.
Síndromes de aspiración
Son frecuentes en la época neonatal y producidos por causas variadas.
Síndrome de aspiración de meconio (SAM)
El SAM se produce por la inhalación de meconio antes, durante o inmediatamente después del nacimiento. La emisión intraútero de meconio en cantidades muy variables y su paso al líquido amniótico (LA) es un hecho frecuente que aparece en el 8-15% de los embarazos, sobre todo a partir de las 34 semanas y con una frecuencia creciente en relación con la edad gestacional. De estos casos, sólo un 2-4% (especialmente si existe distrés fetal, meconio espeso en LA y tráquea, Apgar bajo al 1 y 5 minutos) van a presentar el SAM. La mortalidad asciende hasta el 2-4% y es debida a hipertensión pulmonar secundaria o a síndrome de escape aéreo.
Patogenia
Cuando el meconio llega a la pequeña vía aérea distal origina un efecto valvular con aumento de la resistencia de vías aéreas y de cierre espiratorio; tiene también una acción irritante sobre la pared bronquial (aparece a los 2 ó 3 días en forma de exudación e inflamación, terminando como una verdadera neumonitis), favorece las infecciones sobreañadidas e inhibe la función del surfactante. Estas alteraciones condicionan la existencia de zonas de sobredistensión alveolar y atelectasia con mala distribución de la ventilación, hipoxemia e hipercapnia y explican la mayor frecuencia de neumotórax y/o neumomediastino, y la frecuente asociación de hipertensión pulmonar persistente neonatal con cortocircuito derecha-izquierda a través del foramen oval y ductus arterioso.
Clínica y radiología
En general, se trata de RN a término o cerca de término con signos de insuficiencia respiratoria variable pero que puede llegar a comprometer gravemente su oxigenación. La piel y cordón umbilical tendrán el aspecto característico de la impregnación por meconio.
El patrón radiológico es muy variable y no guarda buena correlación con la gravedad clínica. Inicialmente se caracteriza por zonas infiltrativas con imágenes hiliofugales de intenso refuerzo junto con áreas de hiperinsuflación, y aire extraalveolar (Fig. 2.17.2). En las formas más graves suele predominar la imagen de atelectasia, edema y bajo volumen pulmonar probablemente por la inactivación del surfactante y fallo cardiaco relacionado con el episodio asfíctico concomitante.
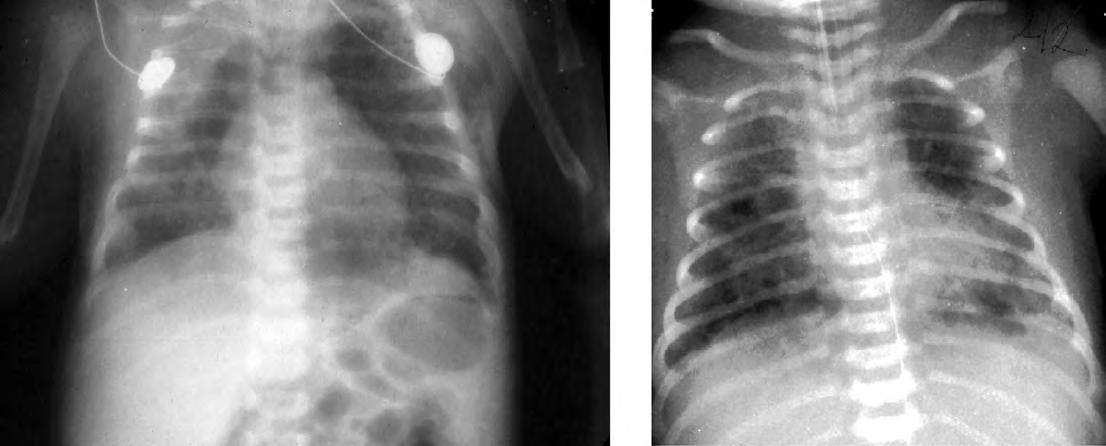
Profilaxis
Evitar en lo posible la asfixia perinatal y reducir los embarazos postérmino son medidas eficaces en la prevención del SAM. Ante la existencia de líquido meconial espeso se está ensayando la práctica de amnioinfusiones que parece disminuyen el riesgo de SAM. En el parto, y antes de la primera inspiración neonatal, es fundamental la correcta aspiración del meconio de la cavidad orofaríngea evitando, si es posible, la presión positiva o los estímulos cutáneos, que impactarían el meconio en las vías aéreas inferiores, hasta la finalización de la eliminación del mismo. No se recomienda la aspiración sistemática de la tráquea en los niños vigorosos, reservándose este procedimiento sólo en los deprimidos que no tengan esfuerzo respiratorio y requieran intubación endotraqueal. En estos casos puede ser necesario repetir varias veces la succión endotraqueal para extraer la mayor cantidad posible de meconio pero tratando a la vez de evitar maniobras repetidas y prolongadas que agraven la muy probable hipoxemia precedente y sus consecuencias.
Tratamiento
Las medidas de soporte respiratorio deben adecuarse al grado de insuficiencia respiratoria y pueden variar desde mínimas cantidades de oxígeno suplementario o CPAP hasta ventilación convencional o de alta frecuencia. La administración de surfactante intratraqueal o lavados con surfactante diluido se han mostrado eficaces en los casos más graves. Si el índice de oxigenación es superior a 25 se administrará óxido nítrico inhalado (hipertensión pulmonar) y se considerará la ventilación de alta frecuencia si falla la convencional o existe un escape aéreo.
La ECMO tendrá su indicación en los pocos casos en que el índice de oxigenación se eleve por encima de 40. Se debe prestar atención a la situación hemodinámica y controlar los factores que pueden condicionar un aumento de la resistencia vascular pulmonar (hipoxemia, hipercapnia, acidosis) así como la necesidad de sedación / analgesia y parálisis muscular en los casos más graves. Aunque clásicamente se ha recomendado antibioterapia profiláctica, algunos estudios recientes indican que, en los casos leves, si no hay antecedentes ni datos sugestivos de infección, su empleo no sería necesario.
Otros síndromes de aspiración en el recién nacido
Aspiración de líquido amniótico claro
Es una entidad mal definida puesto que se solapa con la maladaptación pulmonar tanto desde el punto de vista fisiopatológico como clínico y resulta difícil de objetivar la cuantía de la posible aspiración y la contribución del retraso en la absorción del líquido pulmonar. La Rx de tórax puede sugerir una bronconeumonía o un SAM. Su existencia se confirma por el hallazgo en la autopsia de RN que fallecen por otras causas, de escamas del vérnix caseoso en los pulmones. Las causas serían las que provocan movimientos respiratorios intrauterinos intensos, es decir, capaces de provocar pérdida de bienestar fetal. El pronóstico, si no existe infección, es bueno en general, aunque la gravedad inicial puede ser mayor que en la maladaptación pulmonar.
Síndrome de aspiración alimentaria
Es bastante frecuente y se ve favorecido por ciertas malformaciones (macroglosia, labio leporino, atresia esofágica, fístula tráqueo-esofágica, quistes del conducto tireogloso, tiroides sublingual, síndrome de Pierre-Robin, atresia de coanas o hernia diafragmática tras la intervención), por estados patológicos del RN que dificulten la deglución y también por la prematuridad. Cursa con un cuadro agudo de sofocación, disnea o apnea, cianosis y bradicardia.
Son posibles los antecedentes de atragantamiento. El tratamiento agudo consiste en aspirar, mantener permeable la vía aérea extra e intratorácica y garantizar una adecuada ventilación y oxigenación. Si tras la fase aguda persiste la dificultad respiratoria se debe valorar la posibilidad de atelectasia, escape aéreo o infección.
La aspiración de jugo gástrico (síndrome de Mendelson) puede producirse en RN con atresia de esófago y fístula traqueoesofágica inferior o en casos de reflujo gastroesofágico. El carácter ácido del aspirado produce una lesión inflamatoria del parénquima pulmonar y vía aérea y puede condicionar la aparición de pausas de apnea en RN de muy bajo peso.
Atelectasia pulmonar
La reducción del volumen pulmonar en todo o una parte del parénquima pulmonar es frecuente en el periodo neonatal por las características fisiológicas de su pulmón y caja torácica. La atelectasia difusa más frecuente se observa en la enfermedad de membrana hialina. Una atelectasia localizada en un pulmón, un lóbulo o uno o varios segmentos pulmonares se asocia frecuentemente a obstrucción de la vía aérea bien por secreciones, infección, lesión traumática en pacientes con intubación prolongada o malformaciones de la vía aérea. Puede presentarse durante la ventilación asistida, si se introduce excesivamente la cánula de intubación, o bien postextubación, por tapones de moco bronquial. A la auscultación se detecta hipoventilación del área afecta; si es extensa se produce un aumento del trabajo respiratorio y de las necesidades de oxígeno por cortocircuito derecha-izquierda intrapulmonar. En la Rx de tórax la zona afecta está opacificada con disminución del tamaño de los espacios intercostales y desplazamiento del mediastino hacia el lado afecto. Para su prevención es importante asegurar una buena humidificación de los gases inspirados, sobre todo en ventilación mecánica, y el tratamiento incluirá fisioterapia, cambios posturales que faciliten el drenaje de las secreciones, humidificación adecuada y aspiración de secreciones con o sin intubación traqueal dependiendo de la etiología, gravedad y duración del cuadro.
Edema pulmonar
El edema pulmonar puede producirse por uno o varios de los siguientes mecanismos: aumento de presión hidrostática en la circulación pulmonar (generalmente, asociada a insuficiencia cardiaca), disminución de la presión oncótica intravascular (hipoproteinemia), aumento de permeabilidad del endotelio vascular (infección-inflamación). En el periodo neonatal son numerosas las causas que pueden producirlo (Cuadro 2.17.5).
Si es muy grave, pueden auscultarse estertores crepitantes junto con taquipnea, hipoxemia y retención de CO2. En la Rx de tórax se observa un velamiento pulmonar difuso o imagen de hilios en alas de mariposa. El tratamiento etiológico será el de la causa desencadenante. El empleo de diuréticos (furosemida), CPAP o ventilación mecánica pueden aplicarse como medidas de tratamiento sintomático pues todas ellas permiten una reducción del contenido de agua en el pulmón.
Cuadro 2.17.5. Principales causas de edema pulmonar neonatal
- Ductus arterioso persistente en pretérminos
- Cardiopatías con insuficiencia cardiaca e hiperaflujo pulmonar
- Hipoxia
- Hipervolemia
- Infección pulmonar
- Daño por radicales libres de oxígeno (oxigenoterapia prolongada)
- Hipoproteinemia de origen renal, digestivo, malnutrición, etc.
- Hidrops fetal
- Linfangiectasia, quilotórax congénito
- Distrés respiratorio tipo adulto
- Circulación extracorpórea
- Choque séptico
Síndromes de escape aéreo
Enfisema intersticial pulmonar (EIP), neumotórax y neumomediastino
Son los procesos más frecuentes, a menudo de presentación simultánea y con una patogenia común en la mayoría de los casos como ocurre en otras edades. El periodo neonatal, debido al estado de desarrollo de su pulmón con número reducido de alvéolos y escaso desarrollo de los tejidos reticular y elástico, que constituyen el tejido de sostén del acini pulmonar y con ausencia de canales de comunicación interalveolar (poros de Khon), es la época de la vida en que se produce con más frecuencia.
Patogenia
La presencia conjunta de zonas de atelectasia y sobredistensión alveolar, o la obstrucción parcial de la pequeña vía aérea, generan altas presiones transpulmonares en las zonas ventiladas y aumentan el riesgo de rotura alveolar. El aire progresa a través de las vainas vasculares y se mantiene en el espacio intersticial (enfisema), o se acumula en el mediastino (neumomediastino) y/o en el espacio pleural (neumotórax). Para el neumotórax es también posible un paso directo del aire al espacio pleural por ruptura de bullas, generalmente de origen infeccioso. Como factores predisponentes son frecuentes en los casos de escape aéreo antecedentes de maniobras de reanimación, síndromes de aspiración, enfermedad de la membrana hialina, atelectasia, neumonía, neumatocele, o ventilación asistida (PPC, VPPI). Aparecen de modo espontáneo en el 1% de los RN sin patología pulmonar evidente y es más frecuente, hasta el 10-12%, en RN con alguno de los procesos señalados anteriormente.
Clínica
El enfisema intersticial pulmonar no presenta una sintomatología específica; el diagnóstico es radiológico, observándose pequeños quistes en la zona afecta (Fig. 2.17.2) y los cambios gasométricos (hipoxemia, hipercapnia) dependen del proceso pulmonar de base, siendo más frecuentes en los RN de muy bajo peso con enfermedad de membrana hialina grave. Puede ser uni o bilateral. En el neumomediastino es característica la auscultación de unos tonos cardiacos muy apagados, por la interposición de aire delante del corazón, en un RN con una situación hemodinámica generalmente estable. La Rx muestra el aire libre en la zona central del mediastino. La silueta tímica es frecuentemente delimitada por el aire como una vela de barco (Fig. 2.17.3). En el neumotórax se detecta una hipoventilación del lado afecto y un desplazamiento hacia el lado sano de los tonos cardiacos. El neumotórax espontáneo evoluciona favorablemente con mínima o nula sintomatología. En el neumotórax a tensión además se produce un rápido deterioro con hipoxemia, hipercapnia, taquicardia inicial y compromiso hemodinámico grave por dificultad para el recambio gaseoso y para el retorno venoso causado por el acúmulo de aire pleural, el colapso pulmonar y el aumento de resistencia y distorsión vascular. La radiografía (Fig. 2.17.4) puede mostrar el aire intrapleural y colapso pulmonar o una hiperclaridad del campo pulmonar afecto (neumotórax anterior). Cuando existe fístula broncopleural, el diagnóstico puede hacerse si el RN está con ventilación mecánica, observando la salida por el tubo de drenaje pleural de varias burbujas de aire coincidiendo con cada ciclo del respirador. En algunos casos, generalmente asociados a hipoplasia pulmonar o patología pulmonar grave, se produce un “bloqueo aéreo”, con aparición además de los cuadros anteriores, de enfisema subcutáneo (el aire pasa desde el mediastino al tejido celular subcutáneo a través de la fascia cervical superficial o media), neumopericardio o neumoperitoneo.
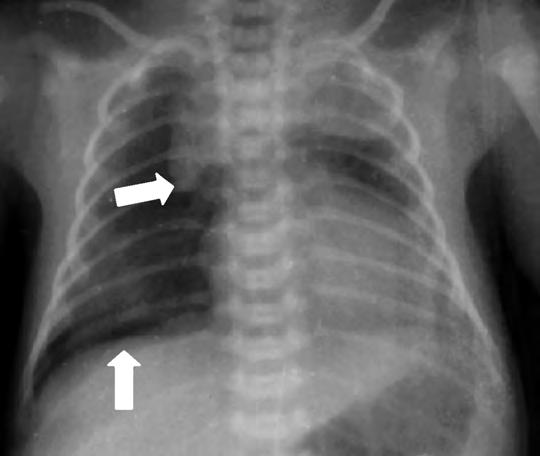
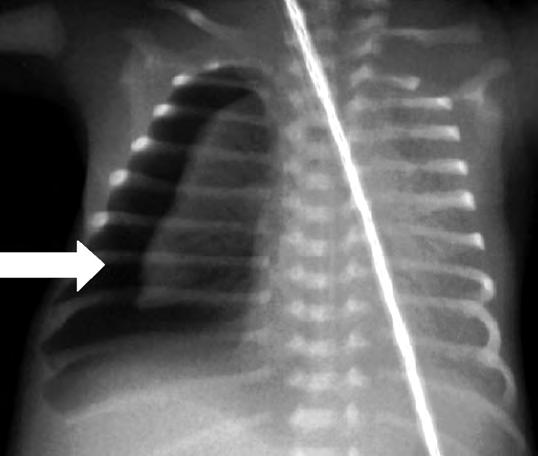
Tratamiento
En el enfisema intersticial grave puede ser útil la ventiloterapia con oscilación de alta frecuencia y vigilar la frecuente aparición de hipertensión pulmonar persistente neonatal. El enfisema intersticial unilateral se puede tratar poniendo al RN en decúbito lateral sobre el lado afecto durante 24-48 horas y en casos con gran enfisema y dificultad para el recambio gaseoso ensayar la intubación selectiva del bronquio sano. El neumomediastino no requiere habitualmente tratamiento específico. En el neumotórax espontáneo sin patología pulmonar asociada solamente es necesaria una vigilancia clínica y monitorización con pulsioximetría. La oxigenoterapia con FiO2 al 100% acelera la reabsorción del aire pleural, que contiene un 79% de nitrógeno, al bajar la concentración de éste en el gas alveolar. Esta medida está contraindicada en el prematuro por el riesgo de retinopatía y puede agravar el daño por radicales libres de oxígeno en RN con antecedentes de asfixia y encefalopatía hipóxico-isquémica. Por estos motivos su uso probablemente no supone una ventaja importante en RN con neumotórax asintomáticos o paucisintomáticos. Hay que evitar sobredistensión pulmonar y volutrauma, emplear ventilación sincronizada y vigilar la posición del tubo traqueal en caso de estar el paciente ventilado y no emplear, en general, CPAP superior a 7-8 cm H2O. Cuando existe compromiso para el recambio gaseoso o hemodinámico es necesario realizar una toracocentesis y evacuar el aire acumulado. Si existe una fístula broncopleural será necesario dejar un drenaje bajo sello de agua, poner aspiración de 5-15 cm H2O y valorar la indicación de ventilación de alta frecuencia que, al contrario que con ventilación convencional, convierte la zona de la fístula en el lugar de máxima resistencia al paso del aire.
Malformaciones pulmonares
Incluyen procesos muy diversos, algunos muy importantes y, en conjunto, frecuentes. Su estudio se desarrolla en otro capítulo.
Displasia broncopulmonar (o enfermedad pulmonar crónica)
La displasia broncopulmonar (DBP) es una enfermedad crónica pulmonar que afecta sobre todo a RN con peso al nacer inferior a 1.500 gramos (RNMBP) y que es tanto más frecuente cuanto menor es al nacer la edad postmenstrual (EPM) y el peso de los pretérmino, pudiendo llegar a afectar a más del 50% de los RN con peso al nacer inferior a 1.000 gramos. Se caracteriza por una dependencia prolongada de oxígeno junto con cambios clínicos y radiológicos que reflejan una patología pulmonar crónica. Los hallazgos histopatológicos muestran en lo que se ha denominado “nueva displasia broncopulmonar” una detención del desarrollo alveolar y vascular del parénquima pulmonar, a diferencia del cuadro clásico descrito por Northway en 1967, en el cual predominaba la metaplasia escamosa y fibrosis.
Para algunos autores, la DBP grave con necesidades de oxígeno y/o CPAP y/o VM a las 36 semanas de edad postconcepcional se correspondería con la enfermedad pulmonar crónica (EPC) propiamente dicha.
Factores etiopatogénicos
El factor más determinante es la inmadurez pulmonar, y a éste se suman oxigenoterapia, volutrauma/atelectrauma secundario a la intubación y ventiloterapia (en especial con enfisema intersticial), hiperhidratación, persistencia del ductus con edema pulmonar, corioamnionitis e infección pulmonar postnatal. El motivo de la ventiloterapia suele ser una enfermedad de la membrana hialina pero puede ser cualquier otra neumopatía. La toxicidad del oxígeno se debe a un daño celular inducido por radicales libres de O2 que dan lugar a la peroxidación de los lípidos de la membrana y a la oxidación de sulfidrilos proteicos y de ácidos nucleicos, condicionando la lesión de las membranas, inactivación enzimática y muerte celular. Algunos casos se presentan en RN que apenas han recibido oxígeno ni ventilación mecánica en los primeros días tras el nacimiento, por lo que se considera que factores genéticos o nutricionales (déficit de vitamina A o selenio), modificando la regulación de los factores angiogénicos, pueden influir también en el desarrollo del cuadro.
Cuadro clínico
Además de la insuficiencia respiratoria, es necesario evaluar en los controles las manifestaciones clínicas y datos ecocardiográficos de posibles alteraciones cardiocirculatorias, como hipertensión arterial sistémica, hipertensión pulmonar, fallo ventricular derecho o izquierdo.
Diagnóstico
Al tratarse de un cuadro con criterios diagnósticos cronológicos y en los que otras patologías pulmonares previas juegan un papel importante, el diagnóstico se basa en la evolución clínica hacia una dificultad respiratoria crónica con hipoxemia que requiere oxígeno suplementario, retención de CO2 y cambios radiológicos característicos. Se deben excluir posibles causas de distrés respiratorio crónico tales como infección por citomegalovirus, micoplasma o clamidia. La infección pulmonar por Ureaplasma urealyticum, de origen perinatal, ha mostrado en diferentes publicaciones datos discordantes acerca de su relación con un riesgo más elevado de DBP. Aunque se han identificado en lavado broncoalveolar diferentes marcadores bioquímicos, como expresión del proceso inflamatorio de RN con riesgo de DBP o DBP establecida (quimocinas, citocinas pro y antiinflamatorias, moléculas de adhesión, proteasas, factores del crecimiento y otras substancias), su determinación no es de uso clínico habitual para el diagnóstico.
Profilaxis
El uso de esteroides postnatales precoces (dexametasona, 1a semana de vida) ha sido objeto de numerosos estudios. Actualmente su empleo se considera contraindicado puesto que, aunque mejora la patología pulmonar, aumenta significativamente el riesgo de complicaciones agudas (infección, sangrado digestivo, hiperglucemia) y de secuelas neurológicas. Otros tratamientos farmacológicos (diuréticos, broncodilatadores, esteroides inhalados, superóxido dismutasa), han sido ensayados y, aunque pueden producir alguna mejoría transitoria en la función pulmonar, no han demostrado eficacia para reducir la incidencia de DBP.
Tratamiento de la DBP establecida
Debe adecuarse a la gravedad y características del paciente. La insuficiencia respiratoria puede ser leve/moderada, requiriendo solamente oxígeno suplementario con FiO2 inferior al 30%. Los casos más graves pueden precisar CPAP o ventilación mecánica prolongada. Se puede aceptar hipercapnia permisiva (PaCO2 superiores a 55-60 mmHg si hay hipercapnia crónica y pH > 7,25) y mantener saturación de oxígeno de 93-94% cuando los vasos retinianos estén maduros para prevenir el desarrollo de hipertensión arterial pulmonar. El empleo de dexametasona puede en los casos graves, DBP establecida o alto riesgo de mala evolución a partir de la 2ª-3ª semana de vida, mejorar la función pulmonar y permitir la extubación. En estos casos, el beneficio obtenido con el tratamiento parece compensar el riesgo de secuelas neurológicas inducido por la medicación y la incidencia de complicaciones agudas también es menor que en edades más tempranas. Además se ha sugerido que el empleo de otros esteroides (hidrocortisona) y/o dosis más bajas podrían tener efectos similares sobre el pulmón y menos efectos sistémicos o neurológicos. Es muy importante conseguir una nutrición adecuada pues las necesidades de nutrientes y energía están aumentadas en los RN con DBP y pueden llegar a 140-150 kcal/kg/día, y los aportes excesivos de líquidos pueden empeorar el edema pulmonar. Como la osteopenia de la prematuridad debilita la caja torácica, se administrará vitamina D, calcio, fósforo y suplementos diarios de vitamina A (2.000 UI), E (25 mg) y de hierro (2-6 mg/kg); los broncodilatadores tienen una respuesta errática, en algunos casos pueden mejorar el fondo espástico, pero empeoran la traqueobroncomalacia, Por la gravedad que suponen las infecciones en la evolución de la enfermedad, estaría indicada la protección de infecciones por VRS con medidas higiénicas y de educación sanitaria y administrando palivizumab (anticuerpo monoclonal) en las etapas de otoño-invierno.
Los RN con DBP grave pueden necesitar oxigenoterapia de modo continuado o intermitente, durante las tomas, y monitorización con pulsioximetría tras el alta hospitalaria. Se debe preparar cuidadosamente el alta hospitalaria, informar de las medidas higiénicas recomendables para prevenir infecciones respiratorias, que son motivo de reingreso hospitalario con mayor frecuencia que en RN sanos, programar las visitas y controles para valoración nutricional, neumológica, neurológica y cardiológica y seguir el calendario vacunal incluyendo la vacuna antigripal, esta última, tanto al RN como a sus padres. La función pulmonar en los 2 primeros años de vida va mejorando paulatinamente y más tarde desaparece en general la sintomatología clínica, si bien existe un mayor riesgo de asma y los estudios de función pulmonar siguen mostrando alteraciones subclínicas al menos hasta la adolescencia.
Proteinosis alveolar
De este infrecuente proceso respiratorio existen formas congénitas, de comienzo neonatal, y formas adquiridas. El cuadro neonatal inicialmente es indistinguible de una enfermedad de membrana hialina o una neumonía. Se produce por mutaciones en algunos de los genes que codifican la síntesis de las proteínas B (SP-B) o C del surfactante o la cadena beta del factor estimulante de colonias de granulocitos-macrófagos y su herencia es AR. La evolución es uniformemente desfavorable en los primeros meses de vida a pesar de cualquier medida de soporte respiratorio en los casos homocigotos sobre todo para déficit de SP-B. Por el contrario, algunos heterocigotos para SP-B han sido identificados con función pulmonar normal en la cuarta década de la vida.
Hemorragia pulmonar masiva
Consiste en un edema hemático intraalveolar difuso que se produce en RN con patología pulmonar previa, trastornos de la coagulación o afectos de problemas circulatorios con aumento de la presión capilar pulmonar, sobre todo ductus arterioso persistente o infección pulmonar en RN de muy bajo peso, daño hipóxico miocárdico y de los vasos pulmonares en términos con asfixia perinatal e insuficiencia cardiaca en RN con cardiopatía congénita. Se trata generalmente de RN en los que, súbitamente o tras un deterioro respiratorio con hipoxemia e hipercapnia, se observa la salida de sangre espumosa y roja (bien oxigenada) por boca y fosas nasales o, más frecuentemente, a través del tubo endotraqueal.
Este cuadro debe ser diferenciado de pequeños sangrados autolimitados que pueden producirse por lesión de la mucosa de la vía aérea durante las maniobras de aspiración del tubo traqueal y otros tipos de hematemesis y hemoptisis muy poco frecuentes en el RN. Radiológicamente, en la fase inicial aparecen infiltrados reticulogranulares difusos o bien intersticiales. Si la hemorragia intraalveolar prosigue, se mostrarán desde infiltrados segmentarios hasta una opacificación difusa de los pulmones.
Tratamiento
Consiste en aspirar la sangre para mantener la vía aérea permeable, administrar oxígeno y ventilación mecánica. Puede ser necesario emplear PEEP altas para incrementar la presión alveolar y frenar el edema y paso de sangre desde el intersticio. Corregir la anemia si es necesario. Además, se debe iniciar tratamiento de la patología de base causante de la hemorragia. Dado que la presencia de sangre alveolar puede inactivar el surfactante, algunos autores recomiendan su administración una vez controlada la fase aguda de la hemorragia pulmonar.
Fibrosis quística
La patología predominante en la fibrosis quística (FQ) en el periodo neonatal es digestiva. Se debe sospechar este diagnóstico en los RN con íleo meconial. RN con diagnóstico de FQ realizado por cribado neonatal en Australia no mostraron diferencias con los RN sanos en función pulmonar en los primeros 6 meses de vida. Los síntomas respiratorios suelen presentarse en edades posteriores.
Insuficiencia respiratoria neonatal por afecciones generales
Se trata de malformaciones, miopatías, cardiopatías, afecciones hematológicas, trastornos nerviosos periféricos o centrales, metabolopatías y, finalmente, cuadros de sepsis, que pueden presentarse en el periodo neonatal con un distrés respiratorio dominante o destacado. Entre las afecciones extrarrespiratorias, en la época neonatal con alguna frecuencia, originan insuficiencia respiratoria:
- malformaciones extrapulmonares (atresia de coanas, glosoptosis, macroglosia, estenosis laríngea congénita, membrana traqueal, fístula traqueoesofágica, hernia diafragmática;
- quilotórax neonatal;
- neuropatías periféricas, como parálisis del frénico y lesiones de la médula espinal;
- enfermedades musculares (miastenia, distrofia miotónica);
- alteración por fármacos (sedantes, analgésicos, anestésicos, morfina).
Las cardiopatías neonatales pueden manifestarse con alteraciones respiratorias dominantes. En las alteraciones hematológicas, tanto el neonato anémico e hipovolémico como el poliglobúlico, pueden presentar dificultad respiratoria. La afectación del centro respiratorio suele apreciarse en graves afecciones del sistema nervioso (hemorragia cerebral, hipertensión intracraneal, edema cerebral e ictericia nuclear), con todo tipo de trastornos respiratorios (apnea, cianosis, tiraje). Las afecciones metabólicas, en especial la acidosis metabólica, estimulan la hiperventilación compensatoria, simulando un cuadro de neumopatía. Igualmente lo producen situaciones graves de hipoglucemia, hipocalcemia, síndrome de enfriamiento o golpe de calor. La sepsis con frecuencia se complica con procesos neumónicos, motivados generalmente por el mismo germen, o trastornos funcionales respiratorios que justifican el distrés con una radiografía de tórax sin alteración visible.