Síndrome de dificultad respiratoria
El síndrome de dificultad respiratoria (SDR), también conocido como enfermedad de las membranas hialinas, es un cuadro respiratorio agudo que afecta casi exclusivamente a los RN pretérmino. En estos neonatos el pulmón presenta inmadurez morfológica, bioquímica y funcional, ya que el desarrollo pulmonar fetal no se ha completado en el momento de nacer. La madurez bioquímica del sistema surfactante pulmonar no se ha desarrollado completamente, por lo que al nacer el pulmón con déficit de surfactante alveolar es incapaz de mantener una aireación y un intercambio gaseoso adecuados. Los síntomas comienzan al poco de nacer, con dificultad respiratoria debida a alteraciones de la función mecánica del pulmón y cianosis secundaria a anomalías del intercambio gaseoso. La dificultad respiratoria que lo caracteriza progresa durante las primeras horas de vida, alcanzando la máxima intensidad a las 24-48 horas y, en los casos no complicados, mejora a partir del tercer día de vida. La incidencia y gravedad aumentan al disminuir la edad gestacional, presentándose sobre todo en menores de 32 semanas, siendo del 50% entre las 26 y 28 semanas. La incidencia es mayor en varones, en los nacidos por cesárea y segundos gemelos. También se puede presentar en niños de mayor gestación nacidos de madres diabéticas con mal control metabólico, los que han sufrido asfixia perinatal o hemorragias intraparto.
Tensión superficial (TS) y mecánica pulmonar
A nivel molecular existen fuerzas eléctricas de cohesión o adhesión que aproximan las moléculas. En un líquido, las moléculas están en equilibrio pero, en la interfase aire-líquido, éstas no están tan equilibradas y la fuerza resultante se dirige hacia el interior del líquido, lo que da lugar a que su superficie se asemeje a una membrana tensa que tiende a reducir su área al mínimo. Los alvéolos pulmonares presentan una superficie esférica y cuando la TS de la interfase aire-líquido es elevada, tienden a colapsarse. Este fenómeno es mucho más evidente cuando los alvéolos son pequeños y, según la ley de Laplace, la tendencia al colapso es mayor debido al pequeño radio alveolar.
En 1929, von Neergaard mostró el importante papel de la TS en la función pulmonar de los mamíferos, al mostrar la necesidad de aplicar más fuerza para distender un pulmón con aire que con un líquido. Inicialmente, cuando el aire entra en el pulmón, es necesario aplicar una gran presión para introducir los primeros mililitros de aire; después el incremento de volumen es mayor por unidad de presión. En la espiración, al disminuir progresivamente la presión, el volumen pulmonar es mayor que a la misma presión en la insuflación. Esta diferencia de volumen a igualdad de presión durante la inspiración y espiración, se conoce como histéresis; produciéndose a consecuencia de la interfase aire-líquido a nivel del alveolo pulmonar y a la acción del surfactante. Esta interfase desaparece cuando el pulmón se rellena completamente de un líquido. En los mamíferos, el intercambio gaseoso se realiza en el pulmón a través de la gran superficie aire-líquido, la interfase alveolar, que genera grandes fuerzas tensoactivas y que son moduladas por el surfactante alveolar. El surfactante es sintetizado en las células alveolares o neumocitos tipo II.
Estructura y composición del surfactante pulmonar
El surfactante es una compleja estructura de agregados macromoleculares: proteínas, fosfolípidos y carbohidratos. La mielina tubular es su forma nativa más activa que, a modo de malla elástica de estructuras fosfolipídicas cilíndricas y alargadas con proteínas en sus interconexiones, modula la TS. Los cuerpos lamelares y formas vesiculares son estructuras menos organizadas, representando formas intermedias o productos catabólicos. El componente principal del surfactante es la fosfatidil-colina, que representa el 70% de los lípidos, un 60% de ella en forma de dipalmitoil-fosfatidil-colina (DPPC). La DPPC es el principal componente responsable de reducir la TS en la interfase aire-líquido alveolar, a valores próximos a cero, pero presenta dificultades para la adsorción en dicha superficie, acción que favorece la presencia de otro fosfolípido, el fosfatidil-glicerol.
Se han descrito cuatro proteínas asociadas al surfactante, SP-A, SPB, SP-C y SP-D. La SP-A interviene en la secreción y reciclaje del surfactante y en la estabilización de la mielina tubular, aumentando su actividad. También tiene un importante papel en las defensas del huésped.
La SP-B aumenta la acción superficial de los fosfolípidos, facilitando su reciclado por los neumocitos tipo II. Su déficit causa un cuadro de dificultad respiratoria letal en RN a término. La SP-C aumenta asimismo el reciclado de fosfolípidos, habiéndose descrito una enfermedad pulmonar intersticial asociada a su déficit. La función de la SP-D no es bien conocida, pero su presencia facilita la rápida distribución del surfactante en la interfase aire-líquido (adsorción). Existen otras proteínas presentes en el lavado bronco-alveolar cuya función no se ha determinado con precisión.
Metabolismo del surfactante
La DPPC es sintetizada en el retículo endoplásmico de las células tipo II, acumulándose en los cuerpos lamelares y, por exocitosis, alcanza la hipofase alveolar junto a la SP-A, SP-B y SP-C, donde se desenmaraña su estructura para constituir la mielina tubular. A partir de esta estructura se produce su adsorción hacia la interfase aire-líquido alveolar, disminuyendo la elevada TS de la interfase alveolar, evitando el colapso del alveolo en espiración. Además del déficit primario de surfactante en el SDR, diversas lesiones pulmonares pueden disminuir las formas activas de surfactante y aumentar las vesiculares, de poca actividad biofísica. La función del surfactante puede estar disminuida también por dilución de la hipofase por edema o por la presencia de sustancias inhibidoras del mismo.
Fisiopatología
El SDR se produce por un déficit transitorio de surfactante, por disminución de la síntesis, alteraciones cualitativas o inactivación. La pérdida de su función tensoactiva produce colapso alveolar, con pérdida de la capacidad residual funcional (FRC), con atelectasias progresivas que conllevan alteraciones de la ventilación y la relación ventilación-perfusión. El pulmón se hace más rígido (cuesta hincharlo), a la vez que elástico (tiende fácil y rápidamente al colapso), aumentando el trabajo o esfuerzo respiratorio. Este aumento del esfuerzo no podrá mantenerse, debido a la limitación de la fuerza muscular, la debilidad de la pared torácica con tendencia a deformarse y que dificulta la ventilación. Se produce cianosis por hipoxemia secundaria a las alteraciones de la ventilación perfusión, reteniéndose CO2 por hipoventilación. Todo ello lleva a la acidosis mixta, que aumenta las resistencias vasculares pulmonares, favorece la aparición de cortocircuito derecha-izquierda a nivel del ductus y foramen, aumentando la hipoxemia.
En el pulmón aparecen micro-atelectasias difusas, edema, congestión vascular y lesión del epitelio respiratorio, más evidente en los bronquiolos terminales, con un aspecto “hepatizado”, poco aireado (Fig. 2.18.1).
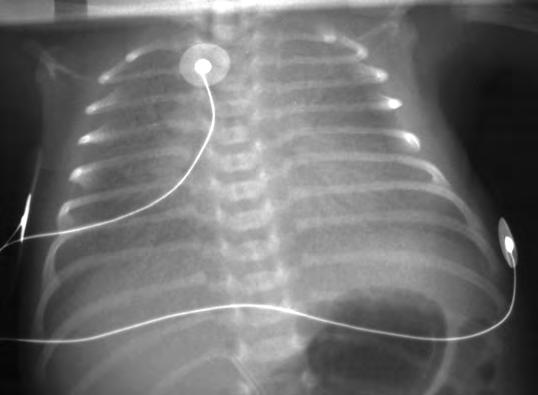
El examen microscópico muestra atelectasias generalizadas, ocupando las vías aéreas distales un material hialino compuesto de fibrina y residuos celulares epiteliales, debidos a necrosis celular, las “membranas hialinas”, que son la consecuencia y no la causa de la enfermedad. Además, el edema alveolar rico en proteínas inactiva el surfactante. El pulmón con déficit de surfactante precisa elevadas presiones para la apertura de los alvéolos colapsados, que son superiores a 25-30 cm H2O para los alvéolos de menor radio. Cuando el paciente es sometido a ventilación asistida, puede aparecer sobre-distensión y rotura de alvéolos de mayor diámetro, dando lugar a un enfisema intersticial y a un acúmulo de aire extrapulmonar (Fig. 2.18.2).
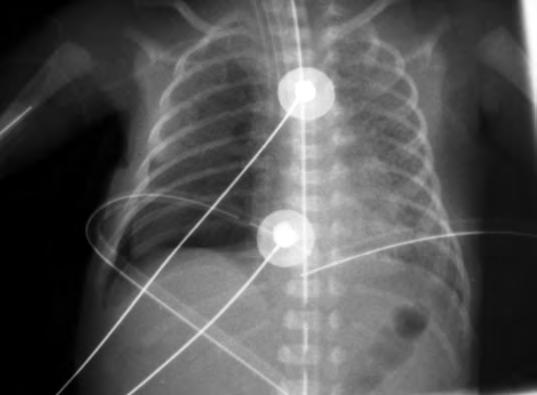
La ventilación asistida sin la aplicación de presión positiva espiratoria induce el paso de surfactante activo a formas catabólicas con escasa función biofísica. El tratamiento con surfactante exógeno disminuye la TS y, por ello, la presión de apertura necesaria para iniciar la inspiración.
Por otra parte, dificulta el colapso alveolar espiratorio al retrasar su vaciamiento, por lo que mantiene la capacidad residual funcional. Ambas acciones favorecen el reclutamiento alveolar, mejorando la oxigenación y la ventilación, es decir, el intercambio gaseoso pulmonar.
Clínica
En la actualidad el cuadro clínico es muy recortado debido a la administración precoz de surfactante y al soporte respiratorio. Los primeros síntomas aparecen al nacer o en las primeras horas, empeorando progresivamente, apareciendo dificultad respiratoria moderada o intensa con polipnea, tiraje costal y xifoideo, quejido, aleteo nasal y cianosis en aire ambiente. El quejido espiratorio es característico y es debido al paso del aire espirado a través de la glotis semicerrada, para intentar mantener un volumen alveolar adecuado y evitar el colapso alveolar. En fases avanzadas y en pacientes sin asistencia respiratoria pueden aparecer pausas de apnea o una respiración irregular, premonitorios del fracaso total de la ventilación. En los cuadros más leves hay un empeoramiento inicial en las primeras 24 horas de vida, con mejoría progresiva y recuperación completa. En los más graves el empeoramiento es rápido, precisando asistencia respiratoria desde los primeros momentos. Los niños más inmaduros presentan mayor riesgo de desarrollar enfermedad pulmonar grave y un mayor grado de complicaciones pulmonares y extrapulmonares. El tratamiento con surfactante exógeno ha modificado la evolución natural de la enfermedad, disminuyendo los síntomas clínicos, la duración de la asistencia respiratoria y las tasas de mortalidad.
Diagnóstico
En un neonato pretérmino con dificultad respiratoria, el diagnóstico se basa en los antecedentes y, sobre todo, en el aspecto radiográfico de los pulmones, si bien la radiografía puede no reflejar la gravedad de la afectación pulmonar. La radiografía puede ser normal en los primeros momentos, pero progresivamente aparecen los cambios típicos, pero no patognomónicos de SDR: disminución del volumen pulmonar, opacificación difusa de los campos pulmonares con un moteado fino de aspecto de vidrio esmerilado y broncogramas aéreos. La imagen radiológica depende del ciclo respiratorio y del tipo de asistencia respiratoria recibida. Además, se debe valorar siempre la posible presencia de complicaciones, como enfisema intersticial, neumotórax o evolución hacia una displasia broncopulmonar (DBP). Puede aparecer cardiomegalia y aumento del flujo pulmonar por cortocircuito izquierda-derecha a nivel del ductus arterioso. La valoración de la expansión pulmonar es útil para ajustar los parámetros del ventilador.
Monitorización
El cuidado de estos pacientes debe efectuarse en unidades de cuidados intensivos neonatales, donde personal de enfermería especialmente entrenado los asistirá y controlará. Preferentemente se usa monitorización incruenta de la temperatura cutánea, frecuencias cardiaca, respiratoria, pausas de apnea, tensión arterial por oscilometría, y la saturación transcutánea de oxígeno (SAtcO2) por pulsioximetría, o bien la PO2 estimada por un electrodo transcutáneo (PtcO2). Se reserva la monitorización invasiva (cateterización radial o umbilical para la medición discontinua o continua de la PaO2 y PaCO2) para los pacientes más graves, inestables e inmaduros. Los gases arteriales son un buen indicador de la intensidad de la enfermedad, presentando los casos más graves una acidosis mixta con hipoxemia y retención de CO2. Además, el llamado índice de oxigenación (IO: producto de la FiO2 por la presión media aplicada a la vía aérea, dividido por la PaO2) es muy útil para juzgar la gravedad.
Así, un IO mayor de 15 indica una enfermedad pulmonar grave.
Los parámetros bioquímicos y hematológicos no sugieren infección y los cultivos son negativos. Hay que señalar que, si bien la hipoxia es indeseable, la hiperoxia también lo es. Asimismo, los pulsioxímetros son adecuados para monitorizar los episodios de hipoxemia, pero no lo son para detectar la hiperoxemia. Si bien en aire ambiente la SAtcO2 se correlaciona bien con al PaO2, esta correlación se pierde cuando se respira aire enriquecido con oxígeno. Entonces, a una SAtcO2 la PaO2 puede ser de 100, pero también de más de 300 mmHg. Por ello, durante la oxigenoterapia, la alarma de los monitores de SAtcO2 se debe seleccionar a cifras inferiores al 100%.
Prevención
Lo ideal es realizar la prevención primaria evitando el parto pretérmino y, la secundaria, mediante la administración de corticoides prenatales. Ha sido demostrado que la administración de corticoides a la madre disminuye la incidencia de SDR, su mortalidad y la tasa de hemorragia intraventricular (HIV). Este tratamiento produce, no sólo un aumento de la síntesis de DPPC, sino también la remodelación y maduración de la estructura elástica pulmonar. La aplicación de CPAP precoz puede evitar la inactivación del surfactante, incluso cuando haya una cierta deficiencia, como ocurre en los menos inmaduros. De igual forma, después del tratamiento con surfactante, el mantenimiento de un volumen alveolar adecuado mediante CPAP puede contribuir a una evolución favorable.
Tratamiento
Está encaminado fundamentalmente a asegurar una buena función pulmonar y un adecuado intercambio gaseoso, evitando complicaciones como el enfisema intersticial, el neumotórax y la DBP. Desde que en 1980 se empezase a emplear el surfactante exógeno, ha disminuido de forma considerable la morbimortalidad. Además, la aplicación de diferentes técnicas de asistencia respiratoria y el mantenimiento de la homeostasis contribuyen a ello. En este capítulo no se revisan todos los aspectos de los cuidados de estos pacientes, sino sólo el manejo de las alteraciones pulmonares.
Administración de surfactante exógeno
La instilación traqueal de surfactante exógeno, a partir de 1985, es el tratamiento que ha sido mejor evaluado en el cuidado neonatal. Produce una rápida mejoría de la oxigenación y de la función pulmonar, aumentando la FRC y la distensibilidad pulmonar, lo que supone una disminución de las necesidades de O2 y del soporte ventilatorio, con menores tasas de enfisema intersticial y neumotórax. Además, aumenta la supervivencia y la calidad global de vida, dado que no se incrementan las alteraciones neurológicas a largo plazo.
Se han usado diversos tipos de surfactante naturales y sintéticos, pero los naturales son más efectivos, tienen un efecto inmediato y disminuyen la exposición al O2 y a presiones ventilatorias elevadas, seguramente por contener proteínas específicas que favorecen su adsorción alveolar. Se sigue investigando sobre nuevos productos sintéticos. Se han publicado buenos resultados con un producto sintético a base de fosfolípidos y un péptido con funciones análogas a las de la SPB. Estos nuevos surfactantes evitarían las posibles consecuencias inmunológicas e infecciosas de las proteínas heterólogas de los surfactantes naturales.
Existen dos estrategias de aplicación de surfactante, la profilaxis, o mejor instilación muy precoz, y la de rescate entre las primeras 2 y 24 horas, cuando la gravedad del SDR ha sido contrastada. La profilaxis al poco de nacer se reserva para los más inmaduros (menores de 29 semanas), con un alto riesgo de presentar un SDR grave. Esta estrategia está avalada por varios ensayos clínicos. Sin embargo, ello conlleva la aplicación de surfactante a pacientes que no desarrollarían SDR. Las técnicas para su instilación traqueal han sido estandarizadas según el tipo de preparado utilizado, aceptándose como tratamiento completo la aplicación de una dosis inicial, seguida de un máximo de dos dosis adicionales, a las 6-12 horas desde la instalación de la primera, si el paciente sigue intubado y precisa una FiO2 (fracción inspirada de oxígeno) superior a 0,3. La mayoría de casos responden favorablemente al tratamiento, pero un 20% no lo hacen, debiéndose descartar la presencia de otras alteraciones, como neumonía, hipoplasia pulmonar, hipertensión pulmonar o, más raramente, de una cardiopatía congénita.
La única complicación grave descrita tras aplicar surfactante es la aparición ocasional (menos del 3%) de una hemorragia pulmonar, que es más frecuente en los pretérminos de menor peso y baja edad gestacional.
Este riesgo es menor si se han administrado corticoides prenatales y se ha tratado precozmente la persistencia del conducto arterioso con inhibidores de las prostaglandinas. Otras complicaciones agudas descritas son hipoxemia, bradicardia e hipotensión, que pueden minimizarse con la aplicación del surfactante de manera lenta y sin retirar la ventilación mecánica, a través de tubos traqueales de doble luz.
Oxigenoterapia
Debe incrementarse la FiO2 para mantener la PaO2 entre 50 y 60 mmHg, evitando cifras más elevadas para disminuir el riesgo de lesión pulmonar y retinopatía de la prematuridad. El oxígeno debe prescribirse según la FiO2 deseada para alcanzar un cierto nivel de saturación de oxígeno o PaO2, y no por el flujo del gas. El oxígeno puede aplicarse mediante diversos dispositivos (carpa, mascarilla o piezas nasales), pero será previamente humedecido y calentado, para evitar dañar el epitelio de la vía aérea.
Presión positiva continua de la vía aérea (CPAP)
La CPAP es parte habitual del tratamiento del SDR. Puede aplicarse mediante cánulas nasales desde los primeros minutos de vida, después de la administración de surfactante o al realizar una extubación precoz después de utilizar ventilación mecánica. Produce un progresivo reclutamiento alveolar, aumenta la FRC, mejora la oxigenación, favoreciendo la síntesis de surfactante. La utilización de CPAP desde la sala de partos, en pretérminos de entre 27 y 30 semanas de edad gestacional, puede disminuir la incidencia de SDR, evitando la necesidad de intubación.
Sin embrago no se debe retrasar la administración de surfactante en los niños más inmaduros cuando se precisan suplementos de oxígeno o CPAP con presiones elevadas para mantener una oxigenación y reclutamiento pulmonar adecuados. Se aplica mediante cánulas nasales, nasofaríngeas o mascarillas faciales, con respiradores de flujo continuo. La presión positiva intermitente mediante cánulas nasales también puede disminuir la necesidad de ventilación mediante intubación traqueal. Recientemente, se han diseñado sistemas de baja resistencia que son eficaces, pero que no tienen grandes ventajas sobre los anteriores.
Para que la CPAP sea eficaz debe producir un óptimo reclutamiento, es decir, conseguir la mayor expansión pulmonar sin alterar el retorno venoso auricular ni aumentar el riesgo de fuga aérea y evitando otras complicaciones (obstrucción o lesión de la mucosa nasal y distensión gástrica). Si durante el tratamiento con CPAP, se precisa una FiO2 mayor de 0,3, hay retención de CO2 o aumento del trabajo respiratorio, se debe realizar un control radiológico para completar la valoración clínica y decidir la intubación traqueal, administración de surfactante y utilización de ventilación mecánica. Al mejorar la oxigenación, se puede disminuir la FiO2 y la presión y retirarla de forma progresiva.
Ventilación asistida
Los respiradores de flujo continuo, con límite de presión y ciclados por tiempo, son los más empleados. Tienen dispositivos específicos con microprocesadores que permiten sincronizar los ciclos del aparato a las respiraciones del niño, mediante diferentes modalidades de asistencia (sincronizada, asistida/controlada, presión de soporte, etc). Esto parece disminuir el esfuerzo respiratorio del paciente, su nivel de agitación y acoplamiento al dispositivo mecánico, evitando complicaciones graves, como la HIV. Otras modalidades ventilatorias, como el volumen garantizado o la ventilación con presión de soporte, facilitan una rápida adecuación de los parámetros del respirador a los cambios de la función pulmonar del niño, disminuyendo la necesidad de controles analíticos, si bien no se han confirmado beneficios a largo plazo. Además, la medición e integración de la señal de flujo permiten monitorizar el volumen corriente y la función pulmonar de forma numérica. Es muy importante visualizar simultáneamente los trazados de presión, flujo y volumen, y las curvas de presión-volumen para individualizar los parámetros ventilatorios y racionalizar el manejo del ventilador.
Al iniciar la ventilación asistida, se evitarán situaciones que favorezcan el barotrauma y volutrauma, usando presiones inspiratorias pico (PIP) bajas, de 15-22 cm H2O, presiones espiratorias (PEEP) de 4-6 cm H2O, frecuencias de ventilación elevadas y tiempos inspiratorios no superiores a 0,3 segundos, para conseguir volúmenes corrientes entre 4 y 6 mL/kg, sin provocar PEEP inadvertida. Tras aplicar surfactante, se puede aumentar la PIP un 10% durante unos minutos. Posteriormente, se evalúa la respuesta para disminuir progresivamente la PPI, FiO2 y, por último, la frecuencia de ventilación, vigilando las variaciones del volumen corriente.
Se valorará de forma continuada la posibilidad de retirar lo antes posible la asistencia ventilatoria. El uso de CPAP nasal tras la extubación favorece el mantenimiento de la FRC, pero nunca debe aplicarse mediante un tubo traqueal. Se realizarán controles radiológicos periódicos para conocer la posición del tubo endotraqueal y evaluar cambios del parénquima pulmonar, para ajustar los parámetros a cada situación.
Cuando los resultados no son satisfactorios o el riesgo de fuga aérea complica la evolución, la ventilación de alta frecuencia puede ser muy útil. Ésta consiste en aplicar volúmenes corrientes mínimos, próximos al espacio muerto a frecuencias suprafisiológicas, aplicando una presión media de la vía aérea elevada para conseguir un óptimo reclutamiento alveolar. De esta manera, el pequeño volumen administrado llega a la vía aérea distal, sin incrementar las resistencias pulmonares o disminuir el gasto cardiaco. Con ello parece que disminuye la agresión al pulmón que suponen las altas demandas de ventilación mecánica convencional que en ocasiones requieren estos niños.
En el SDR puede coexistir una hipertensión pulmonar funcional, por vasoconstricción pulmonar, que puede ser tributario de tratamiento específico, con aplicación de óxido nítrico inhalado. Sin embargo, la eficacia de este gas en SDR no ha sido aún demostrada, debiendo reservarse para casos de extrema gravedad, sin respuesta a tratamientos convencionales.
Otros métodos no farmacológicos, como la limitación de la intensidad sonora y la lumínica ambiental, pueden disminuir la agitación y la hipoxemia, favoreciendo el confort de estos niños críticamente enfermos.