Causalidad en Epidemiología
Introducción
El tratamiento filosófico de la causalidad se remonta a la Antigüedad. Ya Hipócrates (siglo V a.C.) sugirió que el desarrollo de la enfermedad humana podría estar relacionado con factores de estilos de vida y con el medio ambiente externo; es decir, enunció que las enfermedades tenían causas.
En la segunda mitad del siglo XIX , la desmedida búsqueda en la medicina de agentes infecciosos con la pretensión de identificarlos como causa de enfermedades llevó a Koch y Henle a proponer criterios que delimitasen qué agentes desempeñaban realmente un papel etiológico. Este episodio lo podemos transferir de los cazadores de microbios a los actuales cazadores de factores de riesgo o de genes. Lo inútil en sí no es la búsqueda de nuevas causas de enfermedades, sino el hacerlo fuera de un contexto metodológico y sustantivo que le dé sentido real, práctico. A esto ayudan los denominados criterios de causalidad, que, muchas veces pero no siempre, son consustanciales e implícitos en la buena investigación científica. Con el predominio de las enfermedades crónicas en el siglo XX, los criterios de Koch y Henle dieron lugar a un ulterior desarrollo y su consiguiente crítica.
El interés por la inferencia causal en la epidemiología es claro. Para MacMahon, el propósito más importante de la epidemiología es adquirir conocimiento de las causas de las enfermedades que no son prevenibles actualmente. Para ello hay que desarrollar hipótesis que expliquen la distribución de los patrones de enfermedad, y contrastar dichas hipótesis a través de estudios específicamente diseñados. De este modo podremos clasificar a las personas enfermas en grupos que parezcan tener factores etiológicos en común.
Así pues, establecer las causas de los fenómenos de interés es uno de los principales objetivos —y problemas— de la actividad científica. Este capítulo tiene dos objetivos concretos y prácticos; el primero es responder a la pregunta: ¿qué es una causa?, para lo cual revisamos los modelos o representaciones formales de la causalidad de mayor interés en epidemiología y salud pública; el segundo objetivo es responder a la pregunta: ¿cómo reconocemos en la práctica que una variable o fenómeno concreto es la causa de otro? Para identificar una causa, se dispone de reglas metodológicas llamadas criterios de causalidad; sin embargo, de ellos es suficiente para demostrar la causalidad, pero cuanto más y mejor se cumplan, más verosímil será que la relación entre dos variables sea causal.
Por último, ya que son muchos los criterios de causalidad existentes, concluimos con un comentario sobre la forma de combinar y organizar su aplicación en situaciones concretas.
Cuando se aborda el tema de la causalidad, suele aparecer el término inferencia. Sin embargo, la inferencia (causal) podría comprenderse mejor si la ubicáramos en el marco general, más amplio y más adecuado de la explicación (causal) (fig. 18-1). Explicación, comprobación e inferencia siempre entran en juego en el método científico, aunque dependiendo de cuál es nuestra situación problemática: la búsqueda de una hipótesis (causal) explicativa, la comprobación de una hipótesis ya formulada, o la inferencia sobre una hipótesis ya contrastada. La inferencia siempre va precedida por la explicación y consiste esencialmente en valorar los resultados de las comprobaciones (observaciones, experimentos y argumentos relevantes).
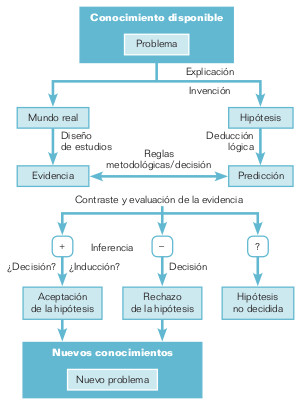
Para valorar las evidencias o resultados contrastados, nos ayudamos de reglas metodológicas, es decir, de elementos no lógicos que ayudan a la decisión sobre si la evidencia apoya o no a la hipótesis causal, y en qué medida. La evidencia —y, por lo tanto, la hipótesis— se decide por un acuerdo o convención razonado, reglamentado y objetivo. En caso de duda, hay que renunciar a tomar un acuerdo y proseguir la comprobación y discusión. Precisamente, que sean decisiones y no conclusiones (lógicas) lo que en último término decide el destino de una hipótesis (causal) habla de que la evaluación de la hipótesis es tentativa, provisional, no concluyente o definitiva, tal como dicen Popper y otros autores.
Modelos de causalidad en epidemiología
Modelo determinista modificado
Algunos autores, como Rothman, propugnan un modelo general de causación que permite relacionar algunos de los principales principios epidemiológicos: fuerza de los efectos, interacción entre causas, proporciones de la enfermedad debidas a causas específicas, período de inducción, etc. El modelo propuesto es un modelo teorético —es decir, imaginario— pero que ayuda a visualizar cómo podrían ser las cosas y, por lo tanto, alienta a comprobarlas. En este modelo, causa se define como el suceso, condición o característica que inicia o permite, sola o en conjunto con otras causas, una secuencia de sucesos que resulta en un efecto. Se trata de un modelo determinista modificado. Es determinista porque supone que una enfermedad puede tener una o más causas suficientes (CS), cada una de las cuales, por sí mismas, determina inexorablemente la enfermedad en un individuo, y una proporción determinada de casos de la enfermedad en la población. Cada CS (o mecanismo causal teórico) está compuesta de una constelación mínima de causas componentes (CC) que interactúan para producir un efecto (fig. 18-2).
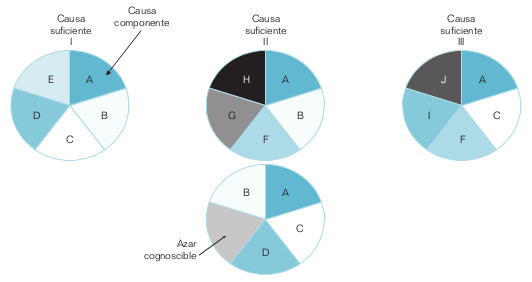
Mínima significa que cada una de las CC es necesaria para producir la enfermedad debida a una determinada CS. Un problema de la concepción determinista es que en el estado actual del conocimiento, para la mayoría (si no todas) de las enfermedades conocemos sólo algunos de sus componentes. Por eso el modelo comentado atempera el determinismo modificándolo, dando cabida al azar en forma de factores o CC todavía no identificados. No conocemos una CS, ni siquiera del cáncer de pulmón. Así pues, que un individuo fumador, o expuesto a radón o asbestos, desarrolle o no cáncer de pulmón podría deberse a que actúen o no otros factores causales aún desconocidos, necesarios para completar una CS. Por último, se denomina causa necesaria a aquella CC que está presente en todas las CS de una enfermedad, y sin la cual, por lo tanto, no se produce ningún caso de enfermedad.
Por el contrario, un modelo indeterminista clásico, o modelo probabilístico, de causalidad plantea que dado que no conocemos todos los determinantes de una enfermedad, es preferible hablar de factores de riesgo. El modelo indeterminista es útil para orientar la investigación epidemiológica y la toma de decisiones. Según este modelo, un factor es una causa de un evento si su alteración conlleva una variación de la frecuencia (probabilidad) de la enfermedad, pues, desde un punto de vista pragmático, la epidemiología persigue descubrir relaciones que ofrezcan posibilidades para la prevención. La causación necesaria y suficiente son simplemente extremos de esta definición. Al menos hasta ahora, la mayor parte de los factores causales conocidos no pueden ser considerados necesarios ni suficientes para producir la enfermedad: la actuación del factor causal incrementa la frecuencia del resultado; pero el resultado no siempre ocurre, y puede darse sin la actuación del factor. Por este motivo, muchos autores se inclinan a hablar sólo de factores de riesgo y no de causas. Realmente existe una correspondencia entre lo que se denomina causa componente en el modelo determinista modificado y lo que se llama factor de riesgo causal en el modelo indeterminista o probabilístico. Para una causa componente, en un contexto de causa suficiente incompleta —es decir, en presencia de azar—, sólo puede cuantificarse su efecto en forma probabilística o de riesgo (esto es, no de certeza determinista). Lo mismo pasa para un factor de riesgo genuino, que aunque no es un mero predictor estadístico de la enfermedad y mantenga su influencia cuando se tiene en cuenta la acción de otros factores de riesgo, su efecto sólo puede cuantificarse probabilísticamente.
Apoyándonos en estos conceptos y en la figura 18-2, es posible visualizar cómo el modelo determinista modificado por el probabilismo acomoda algunos principios epidemiológicos, como veremos a continuación. Primero, no es necesario conocer todas las CC para prevenir la enfermedad.
Eliminando uno solo de los elementos de la CS se previenen todos los casos de enfermedad (o fracción etiológica [FE]) que esta CS origina. Así, si una CS de una enfermedad tiene cinco CC (a saber, A, B, C, D, E), y la FE de la CC «D» es 20%, la FE de la(s) CS de la que forma parte es también 20%, pues sin «D» la CS no se completa y, en consecuencia, la enfermedad no se produce. Eliminando «D» se eliminan el 20% de los casos de esa enfermedad. Por ejemplo, la eliminación del uso de jeringuillas contaminadas (sólo una causa componente) prevendría la aparición de un gran número de casos de sida, hepatitis viral, etc.
Segundo, la suma de las FE de todas las CS de una enfermedad es siempre el 100%. Sin embargo, la FE correspondiente a cada CC equivale a la suma de las FE de la(s) CS de las que forma parte. De este modo, si una enfermedad tiene tres CS, siendo la FE de la CS primera FE (I) = 20%, y la de la tercera FE (III) = 50%, entonces la FE (II) = 30%. Y si la CS (I) la forman las CC A, B, C, D, E; la II está formada por las A, B, F, G, H, y la III lo está por las A, C, F, I, J, entonces:
$$FE \left (D \right ) = FE \left (E \right ) = FE \left (I \right ) = 20\%$$
$$FE \left (B \right ) = FE \left (I \right ) + FE \left (II \right ) = 50\%$$
$$FE \left (A \right ) = FE \left (I \right ) + FE \left (II \right ) + FE \left (III \right ) = 100\%$$
$$FE \left (A \right ) + FE \left (B \right ) + FE \left (C \right ) + … + FE \left (J \right ) = 500\%$$
Parece colegirse que en salud pública debería considerarse en la priorización de factores causales, aquellas CC que por estar implicadas en varias CS responderían de una mayor proporción de enfermedad.
Que la suma de las FE de todas las CC pueda superar el 100% no significa obviamente que pueda prevenirse más del 100% de una enfermedad. No hay límite superior a la suma de las FE. Sólo la FE atribuible a una causa aislada no puede exceder el 100%. Y sólo una causa necesaria contribuirá al 100%. Por consiguiente, para cualquier enfermedad, la suma de las FE de las CC es al menos del 100%. Así, se ha declarado que los porcentajes de casos de cáncer atribuibles a factores de riesgo son los siguientes: el 10-70% a la alimentación insalubre, el 25-35% al tabaco, el 10-40% a los tóxicos laborales, el 5-10% a los tóxicos ambientales y el 10-20% al alcohol. Por su parte, el porcentaje de cardiopatías atribuibles a factores de riesgo es el siguiente: el 30-40% se debe al colesterol sérico, el 20-25% al tabaco, el 20-25% a la hipertensión arterial y el 10-20% a la inactividad física.
Tercero, la medida en que una CC afecta a la frecuencia de la enfermedad depende de la frecuencia relativa de las restantes CC pertenecientes a la misma CS en la población. Así, si en la CS I de una enfermedad, la CC «E» está presente en el 50% de la población, y el resto de CC (A, B, C, D) están presentes de forma combinada en la población en un 20%, entonces «E» contribuirá con 0,50 × 0,20 = 10% de casos de enfermedad en la población. Si, por el contrario, «E» sigue presente en el 50% de la población, y el resto de CC de forma combinada en el 2% de ella, entonces la presencia de «E» conduciría a la enfermedad en un 1% de los individuos. Del mismo modo, la fuerza o riesgo relativo (RR) de una CC depende de la frecuencia relativa de las restantes CC pertenecientes a la misma CS en la población. Es por ello que existe interacción entre las CC de una CS, que depende de la prevalencia relativa de dichas CC en la población. Se habla de sinergismo si el efecto conjunto es superior a la suma de los efectos por separado, y de antagonismo si es al revés. Es decir, hay interacción (bajo un modelo aditivo) si el riesgo atribuible (RA) a la exposición conjunta de dos CC (A y B) es superior a la suma de sus RA por separado: RA (A + B) > RA (A) + RA (B). Y antagonismo, si es al revés.
Por último, los períodos de inducción no son constantes para las enfermedades, sino específicos de cada CC. Las CC actuando al inicio de la secuencia causal tienen un período de inducción largo; las CC finales, breve. Además, no hay tiempos de inducción constantes para una enfermedad en relación con sus CC. Dosis pequeñas requieren un conjunto de CC para completar una CS mayor que las dosis grandes. Éstas tienen un período de inducción más corto al precisar menos CC para completar una CS.
Otros modelos causales. Modelo de red
A pesar de las bondades del modelo anterior, se dispone actualmente de escasa información sobre las varias causas de muchas enfermedades. De ahí el interés de otros modelos causales más clásicos. En epidemiología, muchos de los factores causales que se estudian no son mecanismos bioquímicos o moleculares de las enfermedades, aunque éstos brinden plausibilidad a las relaciones epidemiológicas. Sin embargo, dichos mecanismos son también causas. El modelo multicausal de la red acomoda de forma secuencial las causas distales y proximales de la enfermedad en un solo esquema.
Por lo general, una enfermedad tiene varias causas que, conjunta o independientemente, dan lugar a su aparición. De igual manera, una sola causa puede contribuir a la aparición de varias enfermedades diferentes. Las causas de las enfermedades pueden dar origen a éstas de forma indirecta —es decir, a través de la producción de otras causas de enfermedad— o directa. En realidad casi siempre hay indicios de causas intermediarias, por eso la relación de causalidad está mejor caracterizada por el grado de proximidad que por su carácter directo o indirecto. De hecho, el que una asociación causal sea directa o no depende del estado actual del conocimiento de los mecanismos de una asociación particular, por lo que no tiene implicaciones necesarias para la prevención.
La llamada «red causal» es un modelo que ilustra de forma secuencial las relaciones entre causas y enfermedad. La figura 18-3 muestra simplificadamente la red causal o modelo teórico de producción de la cardiopatía isquémica. Las causas que ocupan en la red los niveles jerárquicos más altos, a menudo características sociales, determinantes a su vez de estilos de vida o factores relacionados, son del máximo interés desde el punto de vista epidemiológico y preventivo. El modelo teórico es un modelo reduccionista (pueden existir varias redes causales para una enfermedad dada) que ayuda sobre todo a identificar los elementos implicados (principales, confusores, modificadores de efecto, etc.) en estudios concretos, y ayuda a comprender que la prevención (reducción) de la enfermedad depende de la eliminación de un elemento troncal de la red.
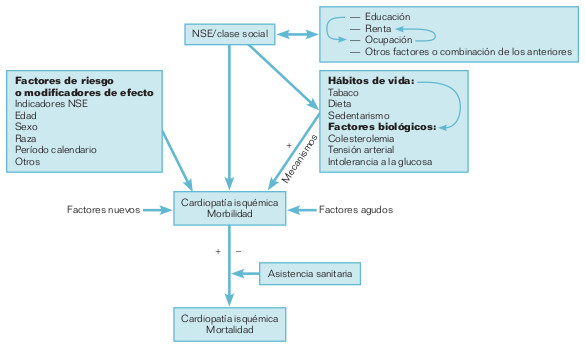
Este modelo está relacionado con el modelo determinista modificado. Cada uno de los eslabones en la cadena causal pueden ser componentes de CS. Sin embargo, cada una de las CC tiene sus propias redes causales, y una enfermedad determinada puede resultar de varias redes de CS, que pueden tener o no componentes en común.
Criterios de causalidad
Cuando las principales enfermedades eran infecciosas, la cuestión se centraba en saber qué evidencia era necesaria para probar que un organismo causaba la enfermedad. En 1840, Henle propuso postulados de causación, expandidos por Koch en la década de 1880. Sin embargo, conforme las enfermedades no infecciosas ganaron importancia a mediados del siglo XX, se replantearon estos criterios. En 1954, E. Cuyler Hammond enunció una serie de criterios, posteriormente discutidos y ampliados por Yerushalmy y Palmer en 1959, Sartwell y otros. En 1964, un comité de expertos nombrado por el Surgeon General de Estados Unidos desarrolló directrices para evaluar la evidencia sobre la relación entre el tabaco y el cáncer de pulmón. Estas guías han sido revisadas desde entonces. Entre ellas, y por ser las más conocidas y usadas en epidemiología, comentamos de forma detallada las guías o criterios que sir Arthur Bradford Hill publicó en 1965 para valorar la posible causalidad de una asociación.
Criterios de Hill
Los criterios o estándares se dirigen a la evaluación de la evidencia disponible sobre la relación entre dos factores: generalmente, la exposición a un agente y una enfermedad.
No comentaremos los criterios en el orden en que Hill los enumeró (tabla 18-1); aunque los enumeró, Hill no estableció una jerarquía entre ellos. Según dijo, «ninguno de los nueve puntos de vista es incuestionable para aceptar o rechazar la causación». Además, los comentamos más allá de lo descrito por Hill, haciendo referencias a su moderna valoración. Muchos de los criterios se corresponden con los enunciados antes y después por otros autores.
| Criterio | Descripción |
|---|---|
| Fuerza | Riesgo relativo grande |
| Consistencia | Asociación observada repetidamente por varias personas, en sitios, circunstancias y épocas diferentes |
| Especificidad | Una causa lleva a un solo efecto |
| Temporalidad | La causa precede al efecto |
| Gradiente biológico | La magnitud de la enfermedad aumenta con la magnitud de la exposición a la causa |
| Plausibilidad | La asociación tiene sentido de acuerdo con el conocimiento biológico del momento |
| Coherencia | Ausencia de conflicto con la historia natural y biológica de la enfermedad |
| Experimento | La reducción de la exposición a la causa se asocia a una disminución de la enfermedad |
| Analogía | Relación causa-efecto ya establecida para un agente-enfermedad similares |
Aunque muchos autores (y el propio Hill) recomiendan usar los criterios causales sólo ante una relación estadísticamente significativa, matizan esta cuestión. Por ejemplo, si el tamaño muestral es pequeño, hay que interpretar una diferencia sustantiva no significativa como «no probada» y no como «no real o no causal». Además, Hill resaltaba que los criterios causales sólo eran necesarios ante una evidencia observacional.
Ante buenos datos experimentales, en un ensayo bien realizado, la existencia de significación estadística bastaría para inferir una relación como causal. Pero al margen de las dificultades prácticas y éticas, muchos experimentos reales, no ideales, no garantizan automáticamente que las variables extrañas hayan sido controladas. El propio Hill matizó esto en algunos de sus escritos. Los criterios, al menos algunos (ej. consistencia o plausibilidad), pueden seguir siendo útiles en los ensayos clínicos. En definitiva, dice Hill, cuando la diferencia observada es muy grande o muy constante, sería absurdo atribuirla al azar y carece de importancia un test de significación; y si es muy pequeña, no interesa si técnicamente es significativa o no. Pero entre estos dos extremos, los test ayudan en la interpretación.
Temporalidad
La exposición al factor presuntamente causal debe preceder en el tiempo a la aparición del efecto. Pues podría ocurrir que fuera la consecuencia del «efecto»; así, muchos estilos de vida (ej. la dieta) cambian tras (y a consecuencia de) las etapas iniciales de la enfermedad que presuntamente causan, sobre todo si es una enfermedad crónica de instauración lenta. No obstante, que la «causa» siga al efecto no significa que la «causa» no pueda causar ese efecto en los casos en que le precede (la dieta desequilibrada puede causar enfermedad, aunque en una situación dada se altere tras los primeros síntomas de la enfermedad asociada).
Un refinamiento útil de este criterio es considerar que el tiempo en que la causa putativa precede al efecto es relevante, es decir, compatible con el período de inducción de la enfermedad o consistente con un mecanismo biológico. No todos los estudios epidemiológicos tienen la misma capacidad para poner de manifiesto este criterio. Por ejemplo, si el estudio es de cohortes prospectivo, el criterio es más fácilmente comprobable que si es de casos y controles retrospectivo. Si el estudio es transversal, el criterio queda garantizado sólo si el factor de exposición es una característica fija (ej. el grupo sanguíneo o la fecha de nacimiento). No sólo el tipo de diseño, sino también la medida de frecuencia elegida tiene diferente eficacia para demostrar la secuencia cronológica: es mejor la incidencia que la prevalencia, y la prevalencia de punto a la de sobrevida.
Éste es el único criterio considerado por algunos autores como sine qua non. Sin embargo, el propio Hill no lo consideró imprescindible, probablemente por la dificultad de su consecución en ocasiones. Ser taxativo en la exigencia de este criterio llevaría a despreciar muchos estudios observacionales. Además, el período de inducción de la última CC de una CS cuyos componentes actúen secuencialmente (algunos cánceres) es prácticamente cero, es decir, la causa sería prácticamente simultánea con el efecto. Por otro lado, el criterio es muy obvio con algunos tipos de estudios (experimentos) o con variables fijas.
Fuerza
También denominado magnitud o tamaño del efecto, es el primer criterio que Hill puso en su lista, y es el grado de intensidad de la asociación entre el factor y la enfermedad.
En epidemiología, la fuerza de la asociación es usualmente medida por el grado en que el RR o la odds ratio se separan de la unidad, sea por encima de 1 (en el caso de exposiciones que causan enfermedad) o por debajo de 1 (en el caso de intervenciones preventivas). Pero también puede estimarse por una diferencia de riesgos, de medias o de proporciones, o por un coeficiente de regresión. La medida relativa del riesgo parece preferible a la diferencia absoluta para valorar la fuerza de la asociación por ser más informativa: los números relativos son más elocuentes en relación con la etiología.
Así, en la relación del tabaco con el cáncer de pulmón, un RR de 8 (ratio de tasas 0,57-0,07/1.000 y año en fumadores de 1-14 cigarrillos/día frente a no fumadores) es más elocuente que una diferencia de tasas de 0,50/1.000/año. Asimismo, una diferencia de 2,2 a 2,6/1.000 de mortalidad por cáncer de pulmón y cardiopatías entre dos grupos (fumadores y no fumadores) es menos probable que se deba a un error de medición si se presenta entre las tasas 2,27 y 0,07 (cáncer de pulmón, RR = 32) que entre las tasas 9,9 y 7,3 (enfermedad cardiovascular, RR = 1,4).
La regla de interpretación de este criterio es que cuanto mayor es la fuerza, más verosímil es la hipótesis causal (o más «probablemente» causal es, se suele decir). Un RR muy alto (ej. >10 como para el tabaco y el cáncer de pulmón) sólo puede deberse a una variable de confusión si es mucho más frecuente en los expuestos que en los no expuestos y se asocia fuertemente con la enfermedad. Los confusores rara vez dan cuenta de una diferencia tan considerable. Además, para Hill, un RR muy alto requiere un factor tan íntimamente ligado al factor estudiado que sería fácilmente detectable. Inversamente, RR próximos o inferiores a 2 (como en la relación tabaco-trombosis coronaria) inducen a pensar en factores de confusión (FC).
Se requiere experiencia en el área de investigación para apreciar cuándo un RR u otra medida del tamaño del efecto es realmente grande, importante para constituir una buena evidencia de causalidad. A esta valoración puede ayudar el examinar cuán consistentemente grande es el efecto a lo largo de una serie de estudios. En cualquier caso, en el contexto de las principales enfermedades crónicas, autores como Brownson o Hill hablan de RR débiles si son inferiores a 2; moderados, entre 2 y 4, y fuertes si son superiores a 4 (estos RR suelen estar ajustados para varios confusores). Weed ha propuesto recientemente, en el campo de la epidemiología nutricional, que RR estadísticamente significativos por encima de 1,2 o por debajo de 0,8 son valorables en el juicio causal, dada la rareza de encontrar RR mayores de 1,2 o menores de 0,8; un RR de 1,4-1,5 (o 0,5-0,6) sería fuerte. Otros autores, como Kassirer y Angell, por el contrario, son más exigentes y solicitan RR de al menos 4 o 5 para empezar a considerar que una relación sea causal. Sin embargo, exigir valores concretos al RR equivale a olvidar que los criterios no son reglas lógicas, autosuficientes. La valoración del tamaño del efecto es una cuestión de juicio informado.
Como todos los criterios, el de fuerza puede tener contraejemplos, excepciones. El propio Hill reconoce que una asociación débil puede ser causal. Así lo es la relativamente débil relación entre consumo de cigarrillos y enfermedad cardiovascular (hay otras muchas pruebas de ello); otro caso similar es el del tabaquismo pasivo y el cáncer de pulmón. También una relación fuerte puede ser no causal, debido a FC no controlados. Es el caso del síndrome de Down y el orden de nacimiento confundido por la edad materna. Por supuesto, una vez que el confusor está identificado, su control reduce la asociación.
Otra limitación del RR (u otra medida de la intensidad de la asociación) es que su magnitud depende de la prevalencia de las otras causas componentes necesarias para completar la causa suficiente o mecanismo causal del que forma parte. Cuanto más frecuentes son las causas complementarias de un factor, mayor es la fuerza de éste, y viceversa. De este modo, el RR es diferente entre poblaciones con distinta distribución de factores de riesgo: el RR de enfermedad coronaria por hipercolesterolemia en dos poblaciones con similar frecuencia de ésta será mayor en aquella que tenga mayor proporción de fumadores o hipertensos (las tres variables forman parte de la misma causa suficiente de la enfermedad, digamos la placa de ateroma).
En conclusión, una asociación fuerte sólo sirve ni más ni menos que para descartar la hipótesis de que la asociación se debe enteramente a un confusor u otra fuente de sesgo modesto. Pero cuanto más específico es el constituyente de una causa, más cerca del evento biológico está, o cuanto más específica o precisa es la medida de la exposición, más fuerte es la asociación. Cuando —como es frecuente— la variable de exposición medida es una estimación muy indirecta del verdadero factor biológico de interés, la asociación es débil (ej. medir un alimento en lugar de una vitamina). Cuando el factor evaluado es un estimador más próximo del agente biológico verdadero, el RR será mucho más alto. Ésta es otra razón por la que un RR fuerte es más verosímilmente causal.
Consistencia
No basta un resultado aislado para refutar o corroborar en la práctica una hipótesis causal. Es decir, aunque la evidencia circunstancial puede «apoyar» positiva o negativamente una hipótesis, ni el mejor y mayor estudio aislado descarta verosímilmente el error; los estudios aislados son raramente definitivos.
En epidemiología no es posible alcanzar el grado de control del laboratorio y, por lo tanto, el sustituto de la replicación exacta es la repetición en condiciones similares; basta que se reproduzcan razonablemente las condiciones relevantes del estudio (sujetos comparables, misma variable de resultado, etc.) para comprobar si el efecto es similar, es decir, si hay consistencia. Hallazgos similares obtenidos en diferentes poblaciones, bajo circunstancias y con métodos distintos, y por diferentes investigadores, tienen un peso mayor para apoyar la causalidad. Es poco probable que estudios con errores diferentes concluyan una misma cosa si ésta no es cierta; por ejemplo, el juicio causal sobre la relación entre el consumo actual de cigarrillos y el riesgo de enfermedad coronaria se fortaleció cuando se realizaron un gran número de estudios de casos y controles y de cohortes en los últimos 40 años en un amplio rango de poblaciones de culturas distintas, observando a millones de personas, y todos ellos mostraron consistentemente un riesgo aumentado.
Hay dos tipos de replicación: la primera es la mera repetición, con ánimo de verificar apresurada o fuertemente un resultado, y la segunda es la que varía las circunstancias o métodos para ver si la hipótesis resiste nuevas pruebas independientes, duras, severas: por ejemplo, con medición más precisa (técnicas más fiables) de la exposición o de la enfermedad, poblaciones de distintas características sociodemográficas, o consideración de otros factores «causales» o FC, etc. Esta segunda es la más rica y útil para la inferencia causal. Por ello, la comprobación de la hipótesis de Barker sobre los orígenes fetales de la enfermedad coronaria ha sido acusada de verificacionismo (lo cual no quiere decir que no sea cierta): para algunos sólo se han buscado pruebas a su favor, pero no se ha contrastado duramente, para ver si surgen contraejemplos (controlando el nivel socioeconómico a lo largo de la vida, o estudiando gemelos; o bien buscando mecanismos plausibles). En términos filosóficos, la refutación es más fuerte que la verificación. Las pruebas afirmativas son más fáciles de buscar y encontrar (sobre todo en los primeros estudios), y mientras que un conjunto finito de observaciones (si son verdaderas y contradicen a la hipótesis) puede refutarla, bajo ninguna condición podría verificarla al concordar con ésta (siempre habrá casos inobservados que pueden contradecirla).
La cuestión de cuándo una relación es consistente es materia de juicio, aunque, como en otros criterios, no es un asunto arbitrario. Además, que no haya un criterio nítido no significa que no haya una idea reguladora, una regla que nos oriente y que facilite el acuerdo. Una regla razonable puede ser la siguiente: para ser consistentes, los hallazgos obtenidos en estudios comparables y correctamente realizados deben ir en la misma dirección (RR por encima o por debajo de 1). Aunque los resultados pueden diferir en tamaño del efecto, y esto puede tener trascendencia práctica, ello va más allá de la valoración de la causalidad. Sin embargo, nadie duda que es deseable que los hallazgos «consistentes» tengan una magnitud (ej. RR) similar.
Este criterio tiene también sus excepciones. Si no se repite la asociación, no puede descartarse una relación causal porque algunos efectos ocurren sólo bajo circunstancias inusuales. Más precisamente, el efecto de un agente causal no puede producirse a menos que actúen antes o después las CC, que se complementan hasta producir una CS. Estas condiciones no son siempre satisfechas. Así, el contacto con el virus VIH puede causar infección, pero no siempre lo hace, el virus tiene que estar presente en una concentración determinada y en una zona permeable a su entrada (ej. zona de la piel con pérdida de integridad). Asimismo, en ocasiones ocurren acontecimientos singulares, como el exceso de cáncer de pulmón y senos nasales en trabajadores de refinería de níquel en Gales del Sur a principios de siglo.
Aparte de esto, son frecuentes los resultados inconsistentes al repetir estudios. No se trata de comparar el número de estudios con resultado positivo con el de los negativos. Cada estudio debe ser evaluado según su calidad, sesgos y otros criterios que veremos, y además hay que ponderarlos, siquiera sea por juicio cualitativo. Los resultados negativos que sean falsos pueden ocurrir por tamaño muestral pequeño, sesgos o FC. Un estudio que falle a la hora de encontrar una asociación, pero que es limitado en metodología y tamaño, de modo que no tiene poder suficiente para detectar un efecto (si existe), es de poco valor; por eso es de dudoso valor que un resultado nuevo y controvertido sea contradicho por estudios débiles, mal diseñados o pequeños. A veces los resultados aparentemente contradictorios pueden explicarse por la presencia de modificación de efecto, es decir, porque la exposición tiene efectos distintos en diversos sectores de la población. En cualquier caso, si los hallazgos de varios estudios son inconsistentes, la inconsistencia tiene que ser explicada. Por último, si la asociación se repite, podría deberse a un sesgo que ocurra siempre en la misma dirección. En consecuencia, ni la ausencia ni la presencia de consistencia garantiza la causalidad.
Por último, la consistencia está muy relacionada con la generalización (validez externa o aplicabilidad de los resultados a otras poblaciones). La repetición en diversas circunstancias es el mejor test de generalizabilidad; y la consistencia, de generalización. Por ejemplo, el estudio de Framingham para examinar las causas de la enfermedad coronaria se diseñó originalmente en individuos de edad media, de clase media, en una muestra sistemática en la pequeña ciudad norteamericana de Framingham; sin embargo, sus resultados (ej. la hipercolesterolemia como factor de riesgo cardiovascular) se aplican en otras partes del mundo, lo cual no es sólo porque la hipótesis es universal por la constancia de las relaciones biológicas subyacentes (y, por ende, de los patrones de enfermedad y RR) entre diferentes individuos, sino también porque se han obtenido resultados similares al volver a examinar esas relaciones o hipótesis en otras poblaciones, otras circunstancias y con otros métodos de estudio.
Además, la generalización no es sólo una manera de examinar la aplicabilidad de los resultados, sino además un método de enriquecer o elaborar la hipótesis causal, de corroborarla más fuertemente, pues una hipótesis más general ha probado su temple en más circunstancias.
Gradiente biológico o relación dosis-respuesta
Para algunos autores es una variante del criterio de magnitud. Nos dice que si un factor es causal, cuanto mayor es la exposición al factor, mayor es el riesgo de enfermedad. Es decir, hay una relación monotónica entre el factor y su efecto.
Si es posible, las variables predictoras deben medirse de forma continua o mediante varias categorías, para estudiar la relación dosis-respuesta. La asociación entre fumar cigarrillos y cáncer de pulmón es un ejemplo de esta relación: los fumadores moderados tienen tasas de cáncer más elevadas que los no fumadores, y los grandes fumadores presentan tasas aún mayores. También la relación de las radiaciones con el cáncer parece ser aproximadamente lineal a lo largo de todo el intervalo de exposición. Sin embargo, otras asociaciones producen relación curvilineal (ej. osteoporosis/ fractura, presión arterial/enfermedad cardiovascular), y otras son en forma de «U» o «J» (ej. la relación peso/ mortalidad) (fig. 18-4).
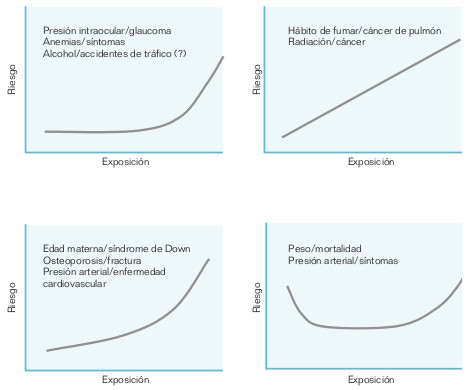
Hay relaciones causales que no cumplen este criterio. Algunos efectos sólo se producen por encima de un umbral de exposición, como en el caso de las relaciones presión intraocular/glaucoma, o dietilestilbestrol y cáncer de vagina.
Tampoco las asociaciones que muestren relación dosis-respuesta son necesariamente causales, pues pueden reflejar únicamente el efecto de un confusor no controlado; por ejemplo, la relación dosis-respuesta entre el tabaco y la cirrosis hepática se explica por la fuerte asociación monotónica entre el tabaco y el consumo de alcohol.
Plausibilidad
El apoyo que se «exige» a una hipótesis causal no tiene por qué consistir solamente en datos que corroboren sus implicaciones (convalidación empírica); puede venir también de hipótesis o teorías más amplias que tengan apoyo empírico independiente. Si se añade esta convalidación teórica, la explicación es más profunda, más satisfactoria. En una palabra, no nos conformamos con correlaciones consistentes, universales, explicativas de hechos o problemas; queremos saber el mecanismo que las explica.
Un mecanismo biológicamente plausible, conocido o postulado, debería poder explicar por qué la exposición altera el riesgo de desarrollar la enfermedad. No obstante, dado que su consideración depende del estado actual del conocimiento, su falta no descarta la causalidad. Un ejemplo es la asociación entre el tabaquismo y el cáncer de cérvix. Al principio le faltaba verosimilitud biológica y se creyó poco en ella, pero luego se identificaron componentes del humo del tabaco en el moco cervical y en otros líquidos corporales de las fumadoras. De hecho, la observación aparentemente no plausible alentó la búsqueda de mecanismos. Por otra parte, su presencia no garantiza causalidad. Un mecanismo aparentemente plausible para la asociación puede luego no demostrarse, y la asociación puede estar sesgada. Además, una hipótesis epidemiológica puede ser compatible con varias teorías mecanicistas.
Sin embargo, una teoría mecanicista es preferible a una que no considera el mecanismo, por ser lógicamente más fuerte (implica a ésta), más rica (mayor contenido), metodológicamente más exigente (da más numerosas y precisas oportunidades de contraste), y suministrar una explicación más profunda (detalla un nivel de la realidad distinto, más básico). Un ejemplo es la teoría oxidativa de las lipoproteínas de baja intensidad como mecanismo para explicar la relación entre colesterol sérico y cardiopatía isquémica.
La ausencia de este criterio tiene que ver con las llamadas relaciones o hipótesis de «caja negra», que ignoran los mecanismos de la relación observada, y que algunos identifican con la epidemiología de factores de riesgo. Las relaciones de caja negra pueden ser valiosas (hay muchos ejemplos de ello); además, son más generales, sencillas, precisas y seguras, por lo que muchos investigadores siguen proponiéndolas. Pero buscar su mecanismo («iluminar el interior de la caja») puede lograr un mejor conocimiento del problema y, por lo tanto, mejorar sus posibilidades de control. Aunque Snow no conocía la implicación de un microorganismo en la epidemia de cólera de Londres el siglo XIX, ni lo necesitó para controlar la epidemia, el conocimiento microbiológico (posterior) mejoró las medidas de prevención y tratamiento de este mal. Además, que se busquen los microhechos biológicos que subyacen a los macrohechos epidemiológicos es independiente, y compatible con que se busquen sus mecanismos sociales, las causas de las causas. No hay antagonismo entre epidemiología de factores de riesgo, epidemiología molecular y ecoepidemiología.
Por último, el criterio de plausibilidad está relacionado con el de consistencia o, mejor dicho, con el de repetibilidad. Al fin y al cabo, considerar los mecanismos equivale a examinar si la hipótesis causal se mantiene, y es consistente con circunstancias evidenciables biológicas, que son test más intensos y persuasivos de la hipótesis. Además, este criterio está relacionado con la generalización: considerar los mecanismos conocidos o postulados de una asociación ayuda a decidir si es aplicable a otros grupos de sujetos.
Especificidad y analogía
Son dos criterios despreciados por algunos autores. La especificidad postula que una causa conduce a un efecto único, no a efectos múltiples. Sin embargo, muchos factores aislados suelen tener muchos efectos (ej. el tabaco). En todo caso, cierta especificidad en la magnitud de la asociación puede contribuir a la verosimilitud de una hipótesis causal (así, en la relación tabaco-cáncer de pulmón, el RR aumenta mucho más que en la del tabaco con otras enfermedades).
La analogía postula que asociaciones causales similares podrían producir enfermedades similares. Por ejemplo, si un medicamento puede causar malformaciones congénitas, quizá puede hacerlo otro. Este criterio, contemplado por Hill y MacMahon, forma parte del concepto global de plausibilidad, pues se refiere a que la relación es análoga a alguna otra relación bien establecida; y, más bien, es útil para formular hipótesis más elaboradas que para evaluarlas.
Experimento
También se le denomina cesación de la exposición. Si un factor tiene un efecto, dicho efecto debería cesar cuando es removido el factor. El proyecto Women’s Health Initiative, que contrasta entre otros los efectos de una dieta baja en grasas sobre la incidencia del cáncer de mama, es un buen ejemplo.
Este criterio no siempre puede obtenerse en poblaciones humanas, pero si el experimento se puede llevar a cabo, constituye la prueba más sólida de causalidad. El criterio de experimentación es un criterio o regla metodológica de severidad o robustez de la hipótesis. Pero incluso puede ser visto, más que como un criterio, como un test directo de la hipótesis causal.
Coherencia
Para Susser y otros autores, la coherencia incluye el criterio de analogía y plausibilidad. La coherencia dice que la asociación no debe entrar en conflicto con lo que se sabe de la enfermedad; es decir, debe ser consistente con el conocimiento existente. Así, la asociación del cáncer de pulmón con el consumo de tabaco es coherente con el aumento temporal ocurrido en las dos variables desde principios del siglo XX, y con la diferencia sexual en la mortalidad. Contribuyen a la coherencia las alteraciones histopatológicas observadas en el epitelio bronquial de los fumadores, y la presencia en el humo del tabaco de carcinógenos para la piel de los animales de laboratorio.
Pero la no coherencia (distinguirla del conflicto) no debería ser una prueba en contra de la causalidad. Así, la ausencia de reproducción de la hipótesis en animales de laboratorio no va en contra de la relación en seres humanos. Y si el factor causa sólo una pequeña proporción de la enfermedad total, la influencia abrumadora de otros factores puede hacer al patrón global incoherente.
Otros criterios de causalidad
Aceptando que los criterios de Hill son útiles en la práctica, no capturan todos los elementos útiles para la inferencia causal. Por ello, recientemente diversos comités de expertos y autores a título individual han aumentado, modificado o desechado los criterios de Hill. Veamos algunos de esos otros criterios.
Descarte de explicaciones alternativas. Criterio de independencia
Puede haber explicaciones de la realidad alternativas a la causal, como son los sesgos y los FC y el azar. Algunos autores abogan por una discusión específica de estos factores (lo que, por cierto, siempre se hace en la práctica) y no considerarlos sólo indirectamente a través de algunos de los criterios de Hill.
Para muchos autores, estos criterios «negativos» (el descarte razonable de sesgos y FC apoya la causalidad) deben ser la primera consideración en la evaluación de una hipótesis causal. El orden de la valoración debe ser primero los sesgos y luego los FC, pues si hay sesgo severo, ninguna manipulación de los datos salvará el problema; la valoración del azar vendrá en tercer lugar.
Una concreción de la consideración de los FC es el llamado por algunos autores criterio de «independencia». Este criterio es considerado en muchos estudios bajo la forma general de que la asociación parece no deberse enteramente al efecto de un FC. El US Pooling Project (1978) de estudios observacionales prospectivos sobre determinantes de la enfermedad coronaria lo incluyó entre sus criterios de causalidad: un factor de riesgo es independiente si mantiene al menos un cierto grado de efecto una vez controlada (generalmente por métodos multivariados) la influencia de otros determinantes relevantes de la enfermedad. Este criterio lo cumplían en 1978 el aumento de colesterol sérico, el consumo de tabaco y la hipertensión arterial (tras ajustar por edad y los otros factores predictores).
Poder explicativo
Este criterio tiene que ver con la audacia, originalidad, novedad, contenido informativo, rendimiento o poder predictivo o explicativo, interés e importancia de una hipótesis (causal). Son características interrelacionadas que sirven para evaluar a priori una hipótesis causal, ayudando así al progreso de la ciencia si esa hipótesis resulta corroborada a posteriori.
Una hipótesis es «audaz» si es nueva, va más allá de la vigente, predice hechos previamente insospechados; o si da respuesta a una pregunta no contestada todavía o que lo ha sido de forma contradictoria o no replicadamente. MacMahon resaltaba que en epidemiología, como en otras ciencias, el progreso en la búsqueda de asociaciones causales se favorece con hipótesis nuevas o más específicas. Popper distingue dos componentes de la audacia. Audacia de predecir de la hipótesis aspectos observables hasta ahora pasados por alto, que son tan osados que corren el riesgo de ser falsos y, por consiguiente, es preciso intentar refutarlos. Por eso, si resisten los test (criterios), se admite provisionalmente la hipótesis como verosímil: es muy improbable que el éxito de una teoría tan audaz, tan improbable, tan poderosa se deba a errores o sesgos. La segunda audacia es suponer la realidad escondida tras lo observable: postular los mecanismos o las leyes biológicas subyacentes a la hipótesis o relación epidemiológica; se relaciona con la plausibilidad biológica.
La audacia, originalidad, novedad o interés de la hipótesis a priori se relacionan con su poder para predecir o explicar más hechos observables novedosos e interesantes que la hipótesis previa, vigente, o que una rival. Un rico contenido informativo de la hipótesis permite que su contrastabilidad sea independiente y, por lo tanto, más severa, más fértil y más corroborable. Pero para que se produzca progreso en el conocimiento, algunas de esas nuevas predicciones deben ser corroboradas de hecho, superar comprobaciones ingeniosas y rigurosas. Esas pruebas rigurosas presuponen un alto grado de contraste o contenido a priori. De ahí la importancia del criterio llamado por Susser «rendimiento predictivo»: nuevas predicciones que resulten exitosas, concepto tomado de Popper.
Un ejemplo de teoría audaz es la de Ross sobre la aterosclerosis (1976), según la cual la placa de ateroma es la consecuencia de la respuesta local a la lesión endotelial. La lesión endotelial daba lugar a la agregación plaquetaria, y el factor de crecimiento derivado de las plaquetas originaba una proliferación y emigración del músculo liso que producía la placa de ateroma. Incorporaba, pues, la plaqueta como nuevo elemento a la teoría clásica y subrayaba el fondo inflamatorio de la proliferación. Posteriormente (1986, 1993), nuevos hallazgos cambiaron la plaqueta por el monocito como célula fundamental. La teoría actual es una síntesis de las tres hipótesis iniciales: la inflamatoria de Virchow, la trombótica de Rokitansky y la lipídica de Anitschkow. El hecho clave de la aterosclerosis, particularmente de su comienzo, es la acumulación de lipoproteínas; la trombosis es fundamental en la placa rota inestable y el infarto de miocardio, y la inflamación es evidente en el papel de monocitos, macrófagos y proliferación muscular lisa en la génesis del ateroma. La moderna teoría subsume, pues, a las anteriores, predice los hechos previstos por ellas y, además, añade nuevas predicciones; es más rica en contenido (y verosímil tras contrastarse).
El interés de una teoría depende tanto de la sorpresa como de la importancia. El interés teórico es el potencial para cambiar lo que los científicos creen sobre importantes relaciones causales. Lo sorprendente, lo contra-intuitivo debería ser un criterio importante para las buenas hipótesis. El interés decae ante las numerosas replicaciones de una hipótesis; el interés se reaviva al buscar y encontrar factores contextuales que modifiquen el efecto. La importancia se relaciona con la frecuencia, gravedad y trascendencia social del problema implicado; los beneficios y aplicabilidad anticipables de su resolución; o el avance del conocimiento en ese u otros campos y las futuras guías de investigación que probablemente se deriven. Por ejemplo, las hipótesis sobre el cáncer son más importantes que aquéllas sobre varices porque son más las personas (y los fenómenos biológicos y psicológicos) que están afectadas más profundamente por el primero. Si bien, en ejemplos menos obvios las ramificaciones de una teoría suelen ser difíciles de anticipar.
Es fácil deducir la conexión de este criterio con los de consistencia, plausibilidad, independencia y con la generalización.
Calidad de la evidencia
Este criterio se refiere a la categorización de la evidencia por la calidad de sus fuentes o tipos de estudios. Se relaciona con la validez interna y la fuerza «demostrativa» de causalidad derivada de los tipos de estudios o fuentes suministradoras de la evidencia.
Aunque considerado en parte en el criterio de consistencia (replicación con diferentes métodos o diseños), la acepción moderna del criterio de calidad de la evidencia introduce la clasificación de los tipos o diseños en orden descendente según su fortaleza, es decir, del grado en que éstos consiguen el control de variables extrañas. Así, diversos grupos han establecido clasificaciones jerárquicas de la calidad de la evidencia científica, fundamentalmente de cara a priorizar intervenciones preventivas o a evaluar tecnologías sanitarias (tabla 18-2).
Tabla 18-2. Clasificación de la calidad de la evidencia según el diseño del estudio fuente. Los tipos de estudio están enumerados en orden descendente de calidad. Estos criterios o similares son utilizados por los grupos de trabajo americano y canadiense de servicios clínicos preventivos, así como por diversas agencias de evaluación de tecnologías sanitarias, para juzgar la calidad de evidencia en la que apoyar algunas recomendaciones de práctica clínica.
Diseño:
- Ensayo clínico
- Estudio de cohortes
- Estudio de casos y controles
- Estudio transversal
- Estudio de riesgo agregado
- Serie de casos
- Informe de un caso
La corroboración de una hipótesis causal es mayor cuanto más severas son las condiciones para contrastar; en este caso, la homogeneización o minimización de factores perturbadores (típicamente FC) de la relación «causal» en el estudio contrastador, que puede conseguirse en mayor grado por la aleatorización en estudios experimentales; en un grado menor por restricción, equiparación, análisis estratificado o modelos matemáticos en estudios observacionales de cohortes o casos y controles; a continuación, los estudios correlacionales poblacionales; y en un grado mínimo en estudios descriptivos, series de casos o experiencias clínicas.
Práctica de la inferencia causal
Weed examina la práctica de la inferencia causal en epidemiología, y encuentra un uso relativamente pobre y heterogéneo de los criterios de causalidad de Hill, por lo que propugna un mayor uso de estos criterios, estudiar sus relaciones y desarrollar otros. Dado un determinado conjunto de criterios, no está claro cómo combinarlos o priorizarlos, ni si esto es realmente necesario o factible. En una aproximación muy intuitiva, y a raíz de un reciente debate sobre los límites de la epidemiología como ciencia no experimental, se llegó a comentar que no son creíbles, de entrada, asociaciones cuyos RR no sean superiores a 3 o 4. Otros autores (Trichopoulos y MacMahon) apuestan por hacer jugar un papel esencial a la plausibilidad biomédica ante efectos inconsistentes y generalmente débiles, y apostar por la causalidad ante asociaciones fuertes y consistentes, aun en ausencia de apoyo biológico. Estos mismos autores apuntan que ante resultados no concluyentes, moderadamente compatibles con la hipótesis, puede ajustarse la principal medida de efecto no sólo por confusores claros, sino también por variables con cuestionable (incluso improbable) influencia de confusión. Esto mejora el control de la confusión y la consiguiente ampliación del intervalo de confianza reduce la tentación de sobreinterpretación.
En la práctica de la epidemiología y salud pública también se empieza a considerar conjuntamente los criterios de Hill y los de calidad de la evidencia, es decir, a ponderar los criterios de evidencia a la luz de los diseños de las fuentes de la evidencia, considerando adicional y específicamente los sesgos y FC. Algunos autores sitúan en un primer escalón de evidencia los estudios de mayor peso de diseño (ensayos clínicos y estudios de cohortes), en segundo nivel a los RR grandes y consistentes, y a los estudios de casos y controles y series temporales, y en el último lugar los RR pequeños aunque plausibles y los estudios transversales.
Sin embargo, prácticamente siempre el juicio causal se realiza valorando evidencias de muchos tipos de estudios. Así, se han demostrado los efectos del consumo de cigarrillos mediante experimentos con animales, grupos controlados y encuestas con seres humanos. De hecho, la investigación en humanos muchas veces comienza con pistas etiológicas de observaciones clínicas o estudios descriptivos, prosigue con estudios observacionales analíticos y, si éstos parecen corroborar los hallazgos, se realiza una evaluación experimental, cuando es posible (agentes potencialmente beneficiosos). Ésta es una secuencia inversa a la evaluación de calidad de las evidencias de las escalas jerárquicas. La consideración conjunta de los tres grandes tipos de estudios disponibles, la variedad de diseños (no la jerarquización y prima excesiva de los experimentos) es, como vimos en el criterio de consistencia, una regla que realza la inferencia.
Como señala Weed, un problema adicional es que la selección, clasificación, definición e interpretación de criterios varían de usuario a usuario y de grupo a grupo, lo que puede producir juicios muy diferentes sobre la causación a partir de la misma evidencia. De hecho, se suele decir que la valoración causal es materia de juicio subjetivo. De juicio, sí; subjetivo, no tanto. A pesar de la aparentemente subjetiva disparidad, el proceso inferencial se objetiva al abrirse la discusión a los demás. Las razones en pro y en contra se pueden sopesar y discutir; así se posibilita el acuerdo. El refinamiento de los criterios y su sistematización, su mayor reproducibilidad por todos, el mayor consenso sobre su definición y reglas de interpretación, mejorará la toma de decisiones causales, pero ésta es siempre provisional, revisable: todos podemos errar en la misma dirección, o la evidencia puede cambiar.
Dada la cantidad de criterios existentes y la diversidad de su manejo, en la tabla 18-3 se indican los criterios más importantes, en un orden razonable según diversas perspectivas. Se prioriza el descarte razonable de explicaciones o factores no causales. El cuadro distingue también los criterios que afectan a la validez interna, a la validez externa y a la comparación con otra evidencia. En general, los criterios más fuertes son la precedencia temporal, la magnitud de la asociación, la consistencia con otros hallazgos y la credibilidad biológica de la hipótesis.
Tabla 18-3. Cuestiones más relevantes para valorar la causalidad
A. Validez interna. Explicaciones no causales (o incluso ausencia de asociación)
- Sesgos
- Factores de confusión
- Azar
B. Validez interna. Características positivas
- Relación temporal
- Fuerza
- Dosis-respuesta
- Consistencia
C. Validez externa. Generalizabilidad
- Aplicación a otras poblaciones
D. Comparación con otra evidencia
- Calidad de la evidencia
- Consistencia
- Plausibilidad
Por último, las cuestiones teóricas son independientes de si el epidemiólogo, como científico, debe aconsejar la acción, basándose en las evidencias de causalidad. Su decisión puede quedar limitada a su evaluación metodológica de la hipótesis causal, basada en la evidencia científica. Si no decide él sobre la acción, no faltarán otros, científicos o políticos, que, con evidencias científicas u otras consideraciones, tomarán la decisión práctica en nombre de todos.